БИОХИМИЯ методичка. Учебнометодическое пособие введение
 Скачать 0.89 Mb. Скачать 0.89 Mb.
|
Раздел 3. НУКЛЕИНОВЫЕ КИСЛОТЫ И ИХ ОБМЕНТема 9 СТРУКТУРА И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ. НУКЛЕОПРОТЕИДЫНуклеиновые кислоты – биополимерные молекулы, основная биологическая роль которых состоит в хранении и реализации генетической информации. Два вида нуклеиновых кислот – ДНК и РНК. Полимерная цепочка нуклеиновой кислоты состоит из мономерных звеньев – нуклеотидов, которые в свою очередь состоят из трех частей: азотистого основания (пуриновое: аденин, гуанин; пиримидиновое: урацил, цитозин, тимин) (рисунок 6, 7); остатка сахара (D-рибозы или D-дезоксирибозы); остатка фосфорной кислоты. Пуриновые и пиримидиновые циклические соединения, входящие в состав нуклеиновых кислот, называют просто основаниями. N-гликозиды оснований, содержащие рибозу или дезоксирибозу, называются нуклеозидами (таблица 21). Фосфатные эфиры нуклеозидов – нуклеотидами (рисунок 8). Нуклеотиды связаны друг с другом фосфодиэфирными связями. 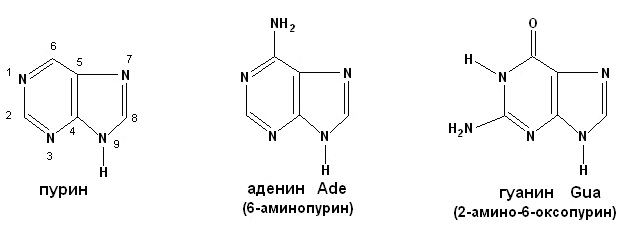 Рисунок 6. Пурин и его производные. 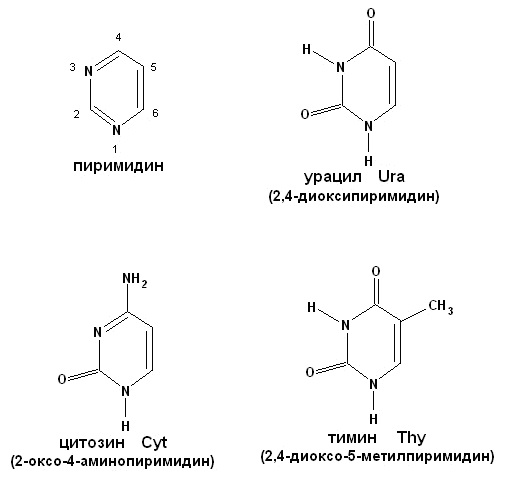 Рисунок 7. Пиримидин и его производные. 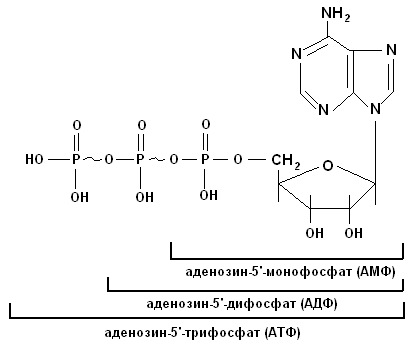 Рисунок 8. Структурная формула нуклеотида АТФ. Таблица 21 Названия нуклеотидных звеньев РНК и ДНК
* Изомеры 5'-нуклеотидов, в которых фосфат связан с кислородом при С-3', называют 3'-нуклеотидами. Нуклеопротеиды – сложные белки, состоящие из простого белка и небелковой части – нуклеиновых кислот. Нуклеопротеиды содержатся в большом количестве в ядерном веществе клеток. Кроме того, они выделены из цитоплазмы. Нуклеопротеиды обладают свойствами кислот, нерастворимы в воде и растворимы в щелочах. Нуклеопротеиды содержат простой белок, в основном состоящий из протаминов или гистонов, которые обладают щелочными свойствами за счет большого количества входящих в них диаминомонокарбоновых кислот (аргинин, лизин и гистидин). Небелковая часть нуклеопротеидов представлена нуклеиновыми кислотами. Лабораторная работа №25 ВЫДЕЛЕНИЕ ДЕЗОКСИРИБОНУКЛЕОПРОТЕИДОВ (ДНП) ИЗ ТКАНЕЙ ПРИНЦИП РАБОТЫ: Дезоксирибонуклеопротеиды растворяются в растворах солей средней концентрации (например, в 1 М хлориде натрия) с образованием вязких растворов и снова осаждаются при разведении их (0,15 М) в виде нитей нуклеопротеидов. РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) NaCl, 2 М и 1 М растворы, содержащие 0,04 % трехзамещенного цитрата натрия (раствор хранят в холодильнике); 2) NaOH, 0,4 и 10 %; 3) дифениламиновый реактив, 1 % (1 г дифениламина, дважды перекристаллизованного из 70 % спирта или петролейного эфира, растворяют в смеси 2,75 мл концентрированной серной кислоты и 100 мл ледяной уксусной кислоты); 4) CuSO4, 1 %; 5) селезенка, печень. ХОД РАБОТЫ: 1. Экстракция и выделение ДНП из тканей. 1) В ступке, охлаждаемой льдом, растирают 2 г ткани органа, затем постепенно добавляют 5 мл охлажденного 2 М раствора хлорида натрия, содержащего 0,04 % трехзамешенного цитрата натрия, и растирают в ступке еще в течение 15 мин. 2) Затем, перемешивая содержимое, постепенно, малыми порциями добавляют 50 мл охлажденного 1 М раствора хлорида натрия. Образовавшуюся гомогенную массу переносят в центрифужные пробирки и центрифугируют 15 мин при 3000 об/мин. 3) Надосадочную жидкость после центрифугирования сливают в маленький стакан, измеряют в цилиндре объем полученного центрифугата и медленно вливают его в шестикратный объем дистиллированной воды тонкой струйкой, размешивая жидкость деревянной палочкой. Выделившиеся нити ДНП наматывают на деревянную палочку. Затем часть нитей ДНП осторожно собирают и вместе с палочкой переносят в другую пробирку. 4) Нити выделенного ДНП растворяют в 1 мл 0,4 % раствора NaOH. Полученный раствор делят на две части и ставят: 1) биуретовую реакцию (на белок); 2) реакцию с дифениламином (на ДНК). 2. Качественная реакция на белковый компонент ДНП. К 5-10 каплям раствора ДНП добавляют 10 капель 10 % раствора NaOH и по 1 капле 1 % раствора CuSO4. Раствор окрашивается в сине-фиолетовый цвет. 3. Качественная реакция на нуклеиновую кислоту в ДНП. При нагревании ДНП гидролизуются, а освободившаяся дезоксирибоза дает синее окрашивание. К раствору (15-20 капель) добавляют равный объем дифениламина, находящегося в смеси с уксусной и серной кислотами. Смесь нагревают на кипящей водяной бане 15 мин. Жидкость постепенно приобретает синюю окраску, обусловленную реакцией дифениламина с дезоксирибозой. РЕЗУЛЬТАТЫ и ВЫВОД: Лабораторная работа №26 ГИДРОЛИЗ НУКЛЕОПРОТЕИДОВ ПРИНЦИП РАБОТЫ: Для изучения состава нуклеопротеидов проводят кислотный гидролиз дрожжей в присутствии серной кислоты. При непродолжительном, т.е. частичном, гидролизе нуклеопротеиды распадаются на белок и нуклеиновые кислоты. Про продолжительном гидролизе наступает полный распад нуклеопротеидов. При гидролизе мононуклеотидов выделяются пуриновые или пиримидиновые основания, углевод (рибоза или дезоксирибоза) и фосфорная кислота. Составные части нуклеопротеидов в гидролизате можно открыть с помощью цветных (качественных) реакций. РЕАКТИВЫ и ОБОРУДОВАНИЕ: 1) Н2SO4, 10 %; конц.; 2) NaOH, 10 %; 3) CuSO4, 1 %; 4) аммиак концентрированный; 5) AgNO3, 2 % аммиачный раствор; 6) молибденовый реактив – раствор молибденовокислого аммония в азотной кислоте; 7) тимол, 1 % алкогольный раствор; 8) круглодонная колба с воздушным холодильником; 9) воронка с фильтром; 10) мерный цилиндр на 50 или 100 мл; 11) дрожжи (пекарские). ХОД РАБОТЫ: 1. Кислотный гидролиз нуклеопротеидов. Помещают 1 г пекарских дрожжей в круглодонную колбу на 100 мл, добавляют 20 мл 10 % раствора серной кислоты и 20 мл дистиллированной воды. Колбу закрывают пробкой с длинной стеклянной трубкой и кипятят под тягой в течение 1 часа на асбестовой сетке при слабом нагревании. Через час после начала кипения нагревание жидкости прекращают, дают ей остыть, переносят в цилиндр, доводят водой до первоначального объема и фильтруют. С фильтратом проделывают качественные реакции на составные части нуклеопротеидов. При гидролизе нуклеиновых кислот обнаруживаются фосфорная кислота, рибоза или дезоксирибоза и азотистые основания – пуриновые и пиримидиновые. 2. Качественные реакции на составные части нуклеопротеидов. 2.1. Биуретовая проба на полипептиды. К 5 каплям гидролизата прибавляют 10 капель 10 % раствора NaOH и 1 каплю 1 % раствора CuSO4. Жидкость окрашивается в розовый цвет. 2.2. Серебряная проба на пуриновые основания. Нейтрализуют 10 капель гидролизата 1 каплей концентрированного аммиака и добавляют 5 капель 1 % раствора AgNO3. При стоянии через 3-5 мин выпадает небольшой бурый осадок серебряных производных пуриновых оснований. 2.3. Качественная реакция Молиша на пентозную группировку. При взаимодействии концентрированной серной кислоты с гексозами или пентозами происходит дегидратация их: из пентоз образуется фурфурол, а из гексоз – оксиметилфурфурол. Они дают с тимолом (метилизопропилфенол) или α-нафтолом в присутствии концентрированной серной кислоты продукты конденсации красного цвета. К 10 каплям профильтрованного гидролизата дрожжей добавляют 2-3 капли 1 % алкогольного раствора тимола, перемешивают и по стенке пробирки осторожно (!) приливают 20 капель концентрированной Н2SO4. При встряхивании на дне пробирки образуется красное окрашивание вследствие образования продукта конденсации фурфурола с тимолом. 2.4. Молибденовая проба на фосфорную кислоту. К 3-5 каплям гидролизата приливают 20 капель молибденового реактива (раствор молибденовокислого аммония в азотной кислоте) и кипятят несколько минут. Жидкость окрашивается в лимонно-желтый цвет. При охлаждении образуется желтый кристаллический осадок комплексного соединения фосфорно-молибденовокислого аммония. РЕЗУЛЬТАТЫ и ВЫВОД: КОНТРОЛЬНЫЕ ВОПРОСЫ: Химический состав нуклеиновых кислот. Назовите особенности строения нуклеотидов ДНК и РНК. Что такое минорные основания? Приведите примеры. Какой состав имеют нуклеопротеиды. При каких условиях проводится гидролиз нуклеопротеидов? Что является продуктами такого гидролиза? Как можно его контролировать? Синтез пуриновых и пиримидиновых нуклеотидов de novo. Синтез нуклеотидов из готовых продуктов. Распределение нуклеотидов в организме. Циклические нуклеотиды. Типы и распределение рибонуклеиновых кислот в клетке. | ||||||||||||||||||||||||||||||||||||||||
