Учебное пособие для студентов непрофильных факультетов, рекомендованное учебнометодическим объединением омск 2 0 0 6
 Скачать 4.05 Mb. Скачать 4.05 Mb.
|
Показания для госпитализации больных ХОБЛ
Таким образом, можно выделить следующие основные принципы ведения больных при стабильном течении ХОБЛ:
Целенаправленная и систематическая терапия обеспечивает уменьшение риска прогрессирования ХОБЛ, облегчает симптоматику, повышает толерантность к физическим нагрузкам, что в целом улучшает качество жизни больных. Предотвращение и лечение обострений и осложнений в конечном итоге является профилактикой ранней инвалидизации пациентов и снижает смертность. БРОНХИАЛЬНАЯ АСТМА ОПРЕДЕЛЕНИЕ. Бронхиальная астма (БА) – это хроническое воспалительное заболевание дыхательных путей, которое проявляется распространенной, но изменяющейся по своей выраженности бронхиальной обструкцией, обратимой спонтанно, либо под влиянием лечения. Хроническое воспаление вызывает повышение гиперреактивности дыхательных путей, приводящее к эпизодам свистящих хрипов, одышки, чувства стеснения в груди и кашля. Эксперты из 48 стран мира разработали в начале 90-х годов руководство «Глобальная стратегия лечения и профилактики бронхиальной астмы» (англоязычная аббревиатура – GINA), которое стало основным международным документом по этой проблеме, регулярно обновляющимся (последние пересмотры в 2002, 2004 годах). АКТУАЛЬНОСТЬ ПРОБЛЕМЫ. Бронхиальная астма – одно из наиболее распространенных хронических заболеваний. По мнению экспертов, на сегодняшний день число больных БА в мире составляет 300 миллионов человек. Во всем мире ежегодно от БА умирают 180 тысяч человек. Лидируют по показателям смертности Китай и Россия: 36,7 и 28,6 на 100 тысяч населения соответственно, средний показатель по данным, полученным из 48 стран мира, составил 7,9 на 100 тысяч населения. ЭТИОЛОГИЯ. БА является полиэтиологическим заболеванием, в развитии которого играют роль как внутренние факторы риска, которые обуславливают предрасположенность человека к развитию болезни, так и внешние факторы, которые вызывают развитие БА у предрасположенных к этому людей или приводят к обострению заболевания. Внутренние факторы (или врожденные характеристики организма) включают генетическую предрасположенность к развитию либо БА, либо аллергической сенсибилизации, в том числе атопии, гиперреактивность дыхательных путей, пол и расу. Атопия – это важнейший фенотип БА, который определяется как предрасположенность к IgE-опосредованному ответу на воздействие распространенных аллергенов окружающей среды и верифицируется в клинических и эпидемиологических исследованиях тремя методами: кожными аллергопробами, высоким уровнем IgE сыворотки крови и эозинофилией крови. Гиперреактивность дыхательных путей – это состояние, при котором имеет место увеличенная реакция бронхов (бронхоспазм) в ответ на воздействие специфических (аллергенов) и неспецифических стимулов (биологически активных веществ – гистамина, ацетилхолина, метахолина, карбохолина; физической нагрузки, аэрополлютантов). Половые соотношения. В раннем детском и подростковом возрасте БА чаще наблюдается у мальчиков. Во взрослой популяции соотношение мужчины/женщины, страдающие БА, составляет 1:1,5 и даже достигает 1:3. При этом отмечается увеличение числа случаев тяжелой астмы среди женщин, что может быть обусловлено более высокой чувствительностью бронхов у них. Причинные или этиологические факторы – это внешние факторы, способствующие развитию БА у предрасположенных к этому людей:
Аллергены и профессиональные сенсибилизирующие агенты рассматриваются как наиболее важные причины БА, поскольку они могут первоначально сенсибилизировать дыхательные пути и провоцировать начало БА и в дальнейшем поддерживать развитие заболевания, вызывая появление астматических приступов. Триггеры – это пусковые факторы, которые вызывают обострение БА путем стимуляции воспаления и/или провоцирования бронхоспазма. У каждого индивидуума в каждое конкретное время триггерами могут быть разные факторы (причинные и усугубляющие). Воздействие причинных факторов (аллергены или профессиональные агенты), к которым уже сенсибилизированы дыхательные пути пациента с БА, может привести к приступу БА. К триггерам относятся также усугубляющие факторы – физические нагрузки, холодный воздух, раздражающие газы (ирританты), аэрополлютанты, изменение погоды, чрезмерные эмоциональные нагрузки. Кроме того, обострение БА могут вызвать респираторные инфекции (вирусные и бактериальные), болезни верхних дыхательных путей (риниты, синуситы, полипоз носа), паразитарные инвазии, гастроэзофагеальный рефлюкс, менструация и беременность, лекарственные препараты – усугубляющие факторы. ПАТОГЕНЕЗ. Современная концепция патогенеза БА постулирует, что в ее основе, вне зависимости от тяжести заболевания, лежит хронический воспалительный процесс в бронхиальной стенке, приводящий к спазму, отеку слизистой, гиперсекреции слизи и бронхиальной обструкции в ответ на воздействие различных триггеров. В формировании воспалительного процесса в дыхательных путях у больных БА участвуют различные клетки, выделяющие большое количество биологически активных веществ (более 100 провоспалительных медиаторов), вызывающих развитие и персистенцию воспаления (табл. 5). Таблица 5 Клетки и биологически активные вещества, вызывающие развитие и персистенцию воспаления в дыхательных путях
Результатами острого и хронического аллергического воспаления в дыхательных путях являются структурные и функциональные нарушения, приводящие к развитию таких патологических синдромов как гиперреактивность бронхов, бронхоконстрикция, экссудация плазмы (отек), гиперсекреция слизи, активация чувствительных нервов и ремоделирование. В последние годы большой интерес вызывают структурные изменения в дыхательных путях, называемые «ремоделированием», которые проявляются необратимыми нарушениями функции дыхания у некоторых больных БА. Однако, многие больные, длительно страдающие БА, на протяжении всей жизни сохраняют нормальную (или незначительно сниженную) функцию легких, что позволяет предположить важную роль генетических факторов, которые определяют, у каких пациентов могут развиться значительные структурные изменения. Патологические изменения происходят с элементами, составляющими структуру дыхательных путей. Из «Глобальной стратегии лечения и профилактики бронхиальной астмы» (GINA, 2002, 2004) вытекают ключевые положения современного подхода к определению БА:
ДИАГНОСТИКА. Анамнез. Часто наблюдается наследственная предрасположенность: бронхиальная астма или другие аллергические заболевания у родственников. Кроме того, у самого пациента могут быть сопутствующие аллергические заболевания – рецидивирующая крапивница, аллергические конъюнктивит и ринит, отек Квинке, дерматит. Клиническая картина. БА – весьма вариабельное по своим клиническим проявлениям и течению заболевание. Симптомы БА могут варьировать по своей интенсивности и по-разному проявляются у отдельных пациентов. Наиболее типичное время возникновения симптомов – ночь или раннее утро. Отмечается рецидивирующий характер эпизодов и стереотипность провоцирующих приступы факторов (аллергены, ирританты, физическая нагрузка, вирусные инфекции и т.д.). Основными клиническими симптомами БА являются:
Нередко приступу астматического удушья предшествует продромальная симптоматика: зуд под подбородком, чувство дискомфорта между лопатками, необъяснимый страх, чихание и другие. Приступ удушья или его эквиваленты (сухой кашель, чувство сдавления в грудной клетке) обычно завершаются выделением вязкой стекловидной мокроты. Осложнение бронхиальной астмы – беталепсия (от греч. beto-кашель). Это припадок с потерей сознания во время приступа кашля. Вначале лицо краснеет, затем появляется цианоз лица и шеи; судорог и упускания мочи не бывает. На ЭЭГ признаков эпилептической активности не выявляется. Признают роль гипоксии и венозного застоя в головном мозге для объяснения патогенеза беталепсии. Объективное обследование. При объективном обследовании наиболее частой находкой являются сухие свистящие хрипы при аускультации. При обострении заболевания могут обнаруживаться другие признаки, свидетельствующие о тяжести обострения: цианоз, сонливость, затруднения при разговоре, тахикардия, вздутие грудной клетки, включение дополнительной мускулатуры в акт дыхания, втяжение межреберных промежутков. Исследование крови. У больных бронхиальной астмой может отмечаться эозинофилия (количество эозинофилов более 4% от общего количество лейкоцитов). Анализ мокроты. Обнаружение эозинофилии мокроты при цитологическом исследовании является критерием подтверждения диагноза астмы. Контроль динамики содержания эозинофилов в мокроте важен для оценки эффективности проводимой терапии. Рентгенологическое исследование органов грудной клетки. При рентгенологическом исследовании легких выявляются либо нормальная картина, либо признаки гиперинфляции (перерастяжения) легких. Аллергологическое тестирование. Большинству больных бронхиальной астмой показано аллергологическое тестирование, которое проводится вне фазы обострения болезни. Кожный prick-test проводится стандартными аллергенами для подтверждения атопии и выявления причинно-значимых аллергенов. Для контроля делают пробу с гистамином (положительный контроль) и физиологическим раствором (негативный контроль). Определение специфических IgE. Определение содержания в крови специфических IgE (радиоаллергосорбентные тесты) показано при невозможности выполнения кожной пробы (например, при тяжелой экземе). Определение уровня общего IgE. У многих больных бронхиальной астмой имеет место повышение общего Ig E, но этот тест часто неинформативен. Уровень общего Ig E, также как эозинофилия, повышается у детей при паразитарных заболеваниях желудочно-кишечного тракта. Оценка функции внешнего дыхания (ФВД). Исследование ФВД, особенно обратимости ее нарушений, обеспечивает точную оценку обструкции дыхательных путей. Существует широкий спектр различных методов для оценки степени бронхиальной обструкции. Наиболее широкое признание для использования у пациентов старше 5 лет получили два идентичных показателя:
Должные значения показателей ОФВ1 и ПСВ определены по результатам популяционных исследований с учетом пола, возраста и роста пациента. По ним можно судить, являются ли полученные результаты нормальными или нет. Измерение ОФВ1 проводится с использованием спирометра путем выполнения маневра форсированного выдоха. ПСВ (пиковая скорость выдоха) измеряется пикфлоуметром и также является важным средством в диагностике и контроле проводимого лечения бронхиальной астмы. Пикфлоуметры удобны для использования в амбулаторных условиях с целью ежедневного объективного мониторирования бронхиальной астмы. Однократные измерения «скоростных» показателей не имеют большого значения для диагностики именно БА: ОФВ1 и ПСВ могут быть нормальными в межприступный период или стабильно сниженными в стадию необратимых морфологических изменений (ремоделирования) легочной ткани. Имеет значение вариабельность «скоростных» показателей, что свидетельствует об обратимости бронхиальной обструкции. Так, у больных БА находят:
Дополнительные методы диагностики.
Таким образом, основными диагностическими критериями БА являются:
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА. Основным дифференциально-диагностическим признаком, отличающим БА от других заболеваний, сопровождающихся синдромом обструкции бронхов, является приступ удушья (одышки) преимущественно экспираторного характера, типичного для бронхиальной астмы. Можно выделить несколько групп заболеваний, при которых обнаруживается бронхиальная обструкция. Заболевания бронхов и легких:
Заболевания сердечно-сосудистой системы:
Патология нервной системы:
Болезни системы пищеварения:
Гормоноактивные опухоли:
Системные заболевания соединительной ткани:
Дифференциальная диагностика БА и других заболеваний дыхательных путей. Чаще всего приходится проводить дифференциальный диагноз между БА и ХОБЛ. Основные дифференциально-диагностические критерии этих заболеваний представлены в таблице 6. Таблица 6 Основные критерии дифференциальной диагностики БА и ХОБЛ
КЛАССИФИКАЦИЯ БРОНХИАЛЬНОЙ АСТМЫ. КЛИНИЧЕСКИЕ ФОРМЫ (в зависимости от факторов, провоцирующих обострение). Основные клинические формы:
Диагностика биологических дефектов у практически здоровых лиц, прежде всего, кровных родственников больных БА позволяет проводить первичную профилактику развития заболевания. Диагноз предастмы был изъят, так как существует представление о бесприступной (кашлевой) форме БА. Диагностика и выявление отдельных клинико-патогенетических вариантов проводится на основании жалоб и анамнеза заболевания, однако чаще всего у каждого больного участвуют несколько этиологических факторов и патогенетических механизмов. Поэтому у большинства пациентов приходится говорить о смешанном генезе БА с выделением ведущего клинико-патогенетического варианта. ОСНОВНЫЕ ВАРИАНТЫ ТЕЧЕНИЯ БА: Интермиттирующий, характеризуется длительными ремиссиями (до нескольких десятков лет); Персистирующий, характеризуется постоянными рецидивами, невозможностью получения стойкой ремиссии. В «Глобальной стратегии лечения и профилактики БА» (GINA, 2002) предложена классификация БА по тяжести течения болезни, основанная на анализе клинических симптомов, количества бета-2-агонистов, применяемых для лечения симптомов, показателей ФВД. КЛАССИФИКАЦИЯ ТЯЖЕСТИ БРОНХИАЛЬНОЙ АСТМЫ ПО КЛИНИЧЕСКИМ СИМПТОМАМ ДО НАЧАЛА ЛЕЧЕНИЯ (GINA, 2005) Ступень 1. Интермиттирующая БА. Симптомы реже 1 раза в неделю. Короткие обострения. Ночные симптомы не чаще 2 раз в месяц. ОФВ1 или ПСВ > 80% от должных значений. Вариабельность показателей ОФВ1 или ПСВ < 20%. Ступень 2. Персистирующая БА легкого течения. Симптомы чаще 1 раза в неделю, но реже 1 раза в день. Обострения могут влиять на физическую активность и сон. Ночные симптомы чаще 2 раз в месяц. ОФВ1 и ПСВ > 80% от должных значений. Вариабельность показателей ОФВ1 или ПСВ 20 – 30 %. Ступень 3. Персистирующая БА средней степени тяжести. Ежедневные симптомы. Обострения могут влиять на физическую активность и сон. Ночные симптомы чаще 1 раза в неделю. Ежедневный прием в2-агонистов короткого действия. ОФВ1 или ПСВ 60 – 80% от должных величин. Вариабельность показателей ОФВ1 или ПСВ > 30%. Ступень 4. Персистирующая БА тяжелой степени. Ежедневные симптомы. Частые обострения. Частые ночные симптомы. Ограничение физической активности. ОФВ1 или ПСВ < 60% от должных величин. Вариабельность показателей ОФВ1 или ПСВ > 30%. Этот раздел классификации БА, основанный на тяжести болезни, важен в ситуации, когда необходимо принять решение в лечебной тактике при оценке состояния пациента. Это связано с предложенным ступенчатым подходом к лечению БА, при котором активность терапии увеличивается при возрастании степени тяжести заболевания. Примеры формулировки диагноза БА, исходя из предложенных классификаций. Интермиттирующая БА, аллергическая, легкое течение, ремиссия. Персистирующая БА, аллергическая, легкое течение, ремиссия. Персистирующая БА, смешанная (аллергическая, аспириновая), средней степени тяжести, тяжелое обострение. Персистирующая БА, смешанная, гормонозависимая, тяжелое течение, обострение. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ А. ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ 1. ГЛЮКОКОРТИКОСТЕРОИДЫ (ГКС)
2. СТАБИЛИЗАТОРЫ МЕМБРАН ТУЧНЫХ КЛЕТОК 3. АНТИЛЕЙКОТРИЕНОВЫЕ ПРЕПАРАТЫ Б. БРОНХОЛИТИЧЕСКИЕ ПРЕПАРАТЫ 1.БЕТА-2-АГОНИСТЫ
2. АНТИХОЛИНЕРГИЧЕСКИЕ ПРЕПАРАТЫ 3. МЕТИЛКСАНТИНОВЫЕ ПРЕПАРАТЫ. В. КОМБИНИРОВАННЫЕ ПРЕПАРАТЫ (ИГКС+ бета-2-агонист). А. ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ – основные препараты для лечения больных бронхиальной астмой. Глюкокортикостероиды – самые активные из противовоспалительных препаратов. Под действием ГКС уменьшается количество (активируется апоптоз) основных клеток воспаления дыхательных путей и происходит торможение синтеза этими клетками медиаторов воспаления и аллергии. Системные ГКС давно используются для лечения больных БА. Делятся на несколько групп. По происхождению:
По продолжительности действия:
По химическому составу:
Назначаются парентерально или per os. Побочные эффекты системных ГКС.
Ингаляционные ГКС (ИГКС). На сегодняшний день являются ведущей лекарственной формой ГКС для лечения БА. Основное действие ИГКС – выраженная местная противовоспалительная активность (сопоставимая с системными ГКС). Кроме того, имеют ряд преимуществ по сравнению с системными ГКС:
Основные препараты: Беклометазон дипропионат (Альдецин, Беклазон). Будесонид (Пульмикорт, Пульмикорт Турбухалер). Флутиказона пропионат (Фликсотид). Местные побочные эффекты ИГКС:
В большей степени выражены при использовании аэрозольных ИГКС, реже при использовании порошковых ингаляторов. Системные побочные эффекты ИГКС:
Системные побочные эффекты развиваются редко, при назначении больших доз ИГКС, обусловлены всасыванием ИГКС из желудочно-кишечного тракта (после заглатывания) и дыхательных путей (чаще при использовании аэрозолей). Профилактика возможных побочных эффектов ИГКС.
«Жидкие» ГКС (суспензии и растворы для небулайзеров) используются в Российском здравоохранении в течение последних лет. Имеют значительную противовоспалительную активность (превосходящую активность ИГКС). В то же время оказывают побочных эффектов не больше, чем ИГКС. Высокая эффективность этих препаратов позволяет использовать «жидкие» ГКС для лечения обострения БА (как альтернативу системным ГКС), а не только в качестве препаратов базисной терапии. Применяется суспензия будесонида (пульмикорт) для ингаляций с помощью небулайзера. Возможные побочные эффекты те же, что и при использовании ИГКС. 2. Стабилизаторы мембран тучных клеток давно и широко используются для лечения больных БА. Противовоспалительный эффект значительно ниже, чем у ИГКС. Основные препараты:
Препараты этой группы назначают детям, молодым людям при БА легкой степени тяжести. Побочные эффекты (крайне редко):
3. Антилейкотриеновые препараты – противовоспалительные препараты, которые относительно недавно стали использовать в клинической практике. Антилейкотриеновые препараты уменьшают эффект лейкотриенов, что проявляется нерезко выраженным расширением бронхов и слабым противовоспалительным эффектом. В зависимости от механизма действия выделяют:
Побочные эффекты (развиваются редко). Показаны больным аспириновой бронхиальной астмой, использование в качестве дополнительных средств при среднетяжелой и тяжелой астме позволяет снизить дозу ИГКС. Б. БРОНХОЛИТИЧЕСКИЕ ПРЕПАРАТЫ – наряду с ГКС являются базисными препаратами для лечения больных БА. 1. Бета-2-агонисты (бета-2-адреномиметики). Механизм действия связан со стимуляцией бета-2-адренорецепторов и расслаблением гладкой мускулатуры крупных и мелких бронхов. Они улучшают мукоцилиарный клиренс, снижают сосудистую проницаемость и экссудацию плазмы, стабилизируют мембрану тучных клеток и уменьшают выброс медиаторов. Основные препараты: Короткого быстрого действия (форма выпуска – дозированный аэрозольный ингалятор, растворы для небулайзеров): сальбутамол, фенотерол (беротек). Начало действия – через 1-3 мин., длительность действия – 4-6 часов. Длительного быстрого действия (форма выпуска – порошковый ингалятор): формотерол (оксис турбухалер). Начало действия – через 1-3 мин., длительность действия – не менее 12 часов. Длительного медленного действия: сальметерол (серевент). Форма выпуска – дозированный аэрозольный ингалятор (ДАИ). Начало действия – через 15-20 мин., длительность – не менее 12 часов. Побочные эффекты. Сердечно-сосудистая система: синусовая тахикардия, нарушения ритма, гипотензия, удлинение QT. Дыхательная система: гипоксемия, парадоксальный бронхоспазм. Нервная система: тремор, головокружение, бессонница. ЖКТ: тошнота, рвота. Метаболические: гипокалиемия, гипергликемия, гиперинсулинемия. 2. Антихолинергические препараты. Основной механизм действия – бронходилатация, которая обусловлена блокадой мускариновых холинорецепторов, в результате чего подавляется рефлекторное сужение бронхов, вызванное раздражением холинергических рецепторов, и ослабляется тонус блуждающего нерва. У пациентов пожилого возраста, при сопутствующей сердечно-сосудистой патологии используются как альтернатива бета-2-агонистам. Основные препараты. Короткого действия: ипратропиума бромид (атровент). Форма выпуска – ДАИ, раствор для небулайзеров. Начало действия - 5-30 мин., длительность - 4-8 часов. Длительного действия: тиотропиума бромид (спирива). Форма выпуска – порошковый ингалятор. Начало действия – 30-60 мин., длительность – 24 и более часов. Не развивается тахифилаксия, не снижается чувствительность к препарату. Побочные эффекты. Местные: сухость во рту, кашель, фарингит, горький вкус, тошнота. Может быть обострение глаукомы при использовании через небулайзер. Системные (редко): тахикардия, задержка мочи, запоры. Устройства доставки ингаляционных препаратов (табл. 7):
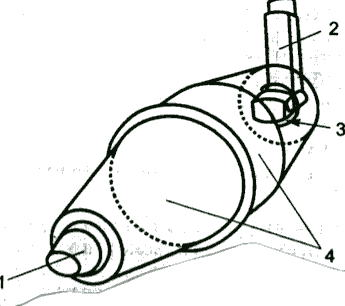 Рис. 2. Спейсер. 1 - мундштук, 2 - ингалятор, 3 - отверстие для ингалятора, 4 - корпус спейсера. 1. Ультразвуковые, использующие энергию пьезокристала; 2. Струйные (компрессорные), энергия струи воздуха: 2.1. Небулайзеры, синхронизированные с дыханием 2.2. Небулайзеры, активируемые вдохом 2.3. Конвекционные небулайзеры Способом доставки ингаляционных препаратов в лёгкие являются дозированные ингаляторы со спейсерами (рис. 2) или без и порошковые ингаляторы (рис. 3). 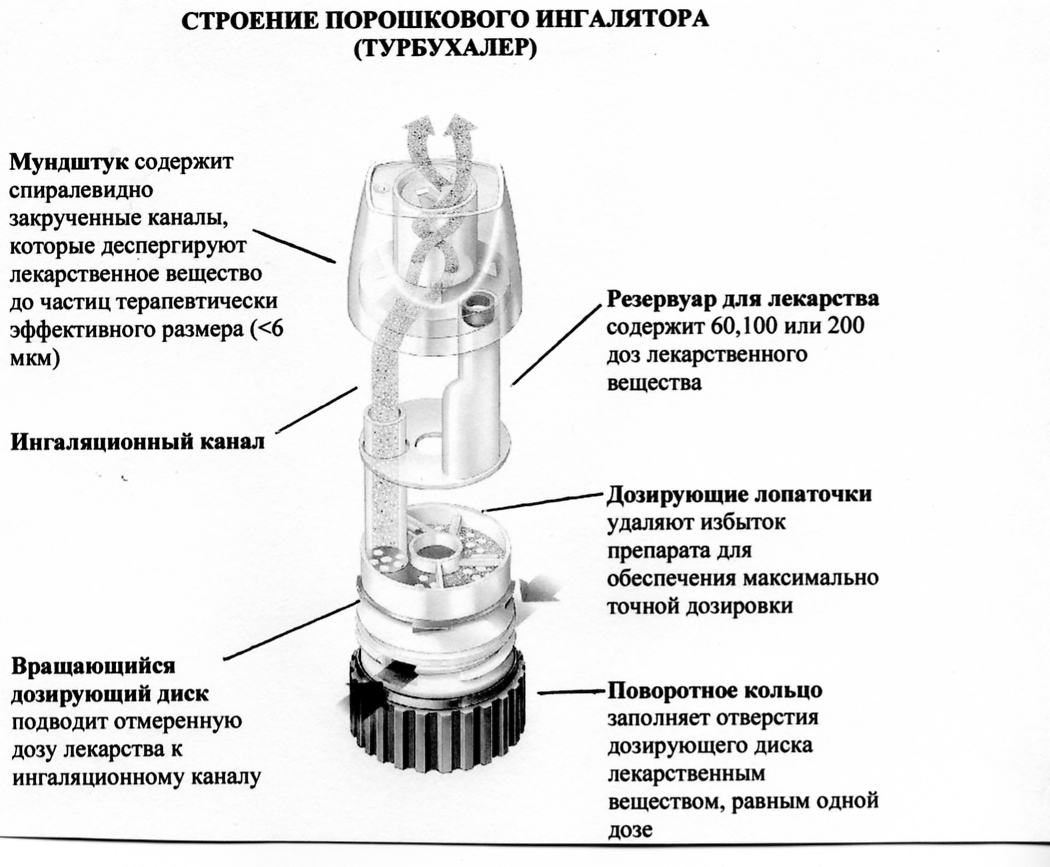 Рис. 3. Строение порошкового ингалятора – турбухалера. Недавно появился современный способ доставки – небулайзер (рис. 4). Преимущества небулайзерной терапии: возможность доставки большой дозы препарата, простота использования (не нужно координировать вдох и высвобождение препарата), можно использовать при тяжёлых состояниях и в раннем возрасте. 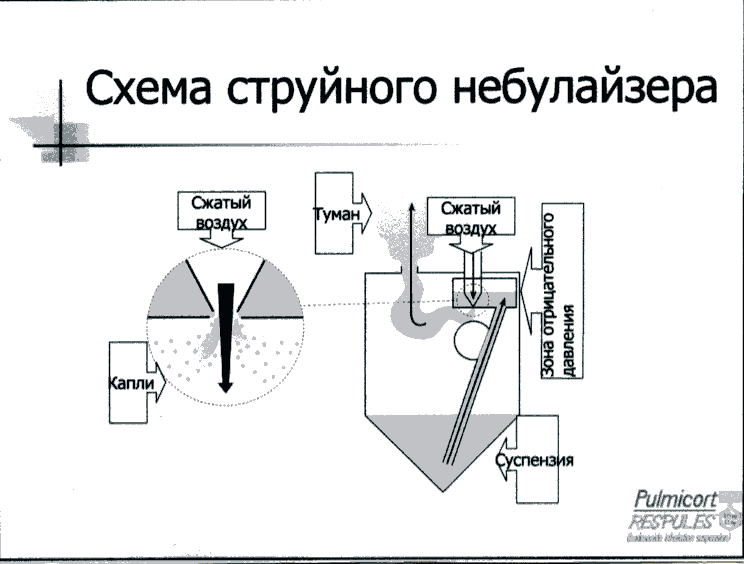 Рис. 4. Схема струйного небулайзера. Таблица 7 |
