|
|
Биохим_15. Учебное пособие Хабаровск 2015 методические указания составили поступаев валерий Васильевич, д м. н., профессор
Белки крови
и тканей,
ферменты,
гормоны,
регуляторные
пептиды


АМИНОКИСЛОТЫ ПИЩИ
МЕТАБОЛИЧЕСКИЙ ФОНД СВОБОДНЫХ АМИНОКИСЛОТ
  
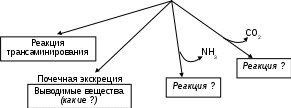
Рис. 24. Основные пути обмена аминокислот
Изучите реакции декарбоксилирования гистидина, 5-окситрип-тофана, ДОФА, глутаминовой кислоты и назовите продукты этих реакций, выясните их роль. Изучите пути инактивации биогенных аминов.
Изучите реакции трансаминирования, выясните участие кофермента в этом процессе.
Изучите реакции дезаминирования аминокислот. Выясните, какая из дикарбоновых аминокислот играет основную роль в реакции непрямого дезаминирования. Напишите уравнение реакции с ее участием.
Ориентировочная карта действия
№
|
Вопросы, подлежащие изучению
|
Последовательность работы
и способ оформления результатов
|
1
|
Определение кислотности желудочного сока:
а) рН;
б) общая кислотность;
в) HCl свободная;
г) HCl связанная
|
1. Проделать определение рН при помощи тест-полосок и кислотности желудочного сока методом титрования 0,1 моль/л раствором NaOH в присутствии 2-х индикаторов.
Ход работы: В колбу прилить 5 мл желудочного сока и по 1-2 капли индикаторов
|
|
|
фенолфталеина и п-диметиламиноазо-
бензола (метилоранжа). Титровать содержимое колбы 0,1 моль/л раствором NaOH и 3 раза отметить объем гидроксида натрия, пошедший на титрование при: переходе цвета жидкости от красного в оранжевый (1-ая точка), затем в лимонно-желтый (2-ая точка) и далее – в розовый цвет (3-я точка).
Примеры расчета.
Общая кислотность рассчитывается по 3-ей точке:
3-я точка (мл) * 1000 = моль/л
5*10
Свободная HCl рассчитывается аналогичным образом по 1-й точке.
Для определения связанной HCl вначале рассчитывают общую HCl по 2-й и 3-й точкам:
(2-я точка (мл) + 3-я точка (мл)) * 1000 =моль/л
2 *5 *10
Тогда:
Связанная HCl = общая HCl – свободная HCl
|
2
|
Определение патологических компонентов желудочного сока
|
Реакция на молочную кислоту (реакция Уффельмана).
Принцип: Реакция основана на способности молочной кислоты образовывать с солями трёхвалентного железа лактат железа (III), при этом раствор окрашивается в жёлто-зелёный цвет.
Ход работы: В 2 пробирки налить по 20 капель 2% раствора фенола и добавить по каплям 1% раствор хлорида железа (III) до появления фиолетового окрашивания. К полученному реактиву добавить по каплям в 1-ю пробирку – желудочный сок, содержащий молочную кислоту, во 2-ю – нормальный желудочный сок. В 1-й пробирке появляется жёлто-зелёное окрашивание; во 2-й окраска исчезает.
Реакция на кровь с бензидином.
Принцип: Реакция основана на окислении бензидина кислородом, образовавшимся при разложении пероксида водорода под действием гемоглобина крови.
Ход работы: В пробирку налить 1 мл желудочного сока, содержащего кровь, добавить 4-5 капель 0,2% раствора бензидина и 5 капель 1% раствора пероксида водорода. Развивается синее окрашивание.
|
3
|
Анализ желудочного сока (задача)
|
3. Провести анализ желудочного сока
(решить задачу): определить рН, типы кислотности и присутствие патологических компонентов.
Сделать вывод по результатам проведенного анализа.
|
Тестовые задания
1. Незаменимыми аминокислотами являются
-
1) треонин;
2) тирозин;
3) глутамат;
|
4) триптофан;
5) цистеин.
|
2. Положительный азотистый баланс наблюдается при
-
1) кратковременном голодании;
2) нормальной беременности;
3) длительном голодании;
|
4) действии стресса;
5) лихорадке.
|
3. Содержание свободной соляной кислоты в нормальном желудоч-
ном соке взрослого человека составляет (ммоль/л)
-
1) 5-10;
|
2) 10-20;
|
3) 20-40;
|
4) 40-60;
|
5) 60-80.
|
Активирование пепсиногена осуществляется под воздействием
1) энтеропептидазы;
2) гастриксина;
3) карбоксипептидазы;
|
4) бикарбонатов;
5) соляной кислоты.
|
Продуктами гниения аминокислот являются
А. Тирозин
Б. Триптофан
В. Лизин
|
индол;
меркаптан;
фенол;
путресцин;
кадаверин.
|
В активной форме глюкуроновая кислота связана с ……..
Наиболее легко подвергается окислительному дезаминированию
-
1) аланин;
2) глутамат;
3) метионин;
|
4) триптофан;
5) аспартат.
|
8. Процесс трансдезаминирования аминокислот состоит из реакций
-
Трансаминирования и дезаминирования
Трансаминирования и декарбоксилирования
Декарбоксилирования и дезаминирования
Амидирования и трансаминирования
Декарбоксилирования и аминирования
|
9. В состав кофермента аминотрансферазы входит витамин
-
1) В2;
|
2) РР;
|
3) В1 ;
|
4) В6 ;
|
5) В12 .
|
10. При декарбоксилировании 5-гидрокситриптофана образуется
биогенный амин
-
1) серотонин;
2) гистамин;
3) ГАМК;
|
4) катехоламин;
5) таурин.
|
Занятие 23. Пути обезвреживание аммиака
Мотивация: Контроль содержания мочевины в крови и моче важен в оценке катаболизма аминокислот, а также функции печени и почек.
Цель занятия: закрепить представления о путях образовании аммиака, механизмах его обезвреживания, значении определения мочевины в крови и моче.
Студент должен:
Знать
|
Уметь
|
Синтез мочевины как основной путь обезвреживания аммиака в печени.
Вспомогательные пути обезвреживания аммиака в тканях: восстановительное аминирование, образование глутамина, аспарагина.
Нормативы содержания мочевины в сыворотке крови и моче
|
Объяснить токсичность аммиака.
Объяснить механизмы обезвреживания аммиака.
Объяснить возможные причины изменения содержание мочевины в крови и моче, и клиническое значение определения этого показателя
|
Вопросы, изученные ранее и необходимые для данного занятия:
|
Вопросы
|
Где изучались
| 1. |
Реакции дезаминирования и декарбоксилирования аминокислот
|
Кафедра биоорганической химии
| 2. |
Структура мочевины
|
Там же
|
Содержание обучения.
Граф логической структуры темы
Механизмы_обобразования_аммиака'>Механизмы
обобразования
аммиака
|
Д   езаминирование езаминирование
|
|
Аминокислот
|
Азотистых
оснований
|
Аминов
|
Токсичность
аммиака
|
↓ α-КГ
|
↑ рН
|
Изменение мембранного потенциала
|
↑ Глн
|
↓ ГАМК
|
Механизмы
обезвреживания
аммиака
|
С интез мочевины интез мочевины
|
Амидирование
глутамата
и аспартата аспартата
|
Восстановительное аминирование
 -кетокислот -кетокислот
|
Образование солей
а ммония ммония
|
Органы
|
Печень
|
Мозг, мышцы
|
Мозг
|
Почки
|
Причины
гиперазотемии
|
Усиление
катаболизма белков
|
Избыток
белка в пище
|
Нарушение
выделительной
функции почек
|
Причины уменьшения выделения мочевины
|
Белковое
голодание
|
Нарушение
синтеза
|
Нарушение
выведения
|
Вопросы и задания для самоподготовки
Изучите механизмы образования аммиака.
Выясните причины токсичности аммиака.
Изучите механизмы обезвреживания аамиака.
Выясните механизмы транспорта аммиака к печени.
Выучите уравнения реакций синтеза мочевины. Обратите внимание на энергетику этого процесса.
Нарисуйте и дополните схему (рис. 25), указав, какая существует взаимосвязь между орнитиновым циклом мочевинообразования и циклом Кребса.
|
|
|
 Скачать 2.47 Mb.
Скачать 2.47 Mb.






 езаминирование
езаминирование аспартата
аспартата