|
|
Биохим_15. Учебное пособие Хабаровск 2015 методические указания составили поступаев валерий Васильевич, д м. н., профессор
КАРБАМОИЛФОСФАТ
+
АСПАРАГИНОВАЯ КИСЛОТА

N-КАРБАМОИЛАСПАРТАТ
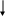
ДИГИДРООРОТОВАЯ КИСЛОТА ОРОТОВАЯ КИСЛОТА ОРОТИДИН-5-ФОСФАТ УМФ УТФ ЦТФ 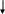 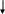 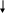  


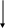 
Рис. 26. Регуляция биосинтеза ЦТФ
Изучите исходные субстраты для синтеза пуринового кольца и принцип его образования.
Выясните механизм образования АМФ и ГМФ из ИМФ и механизмы регуляции этих процессов.
Выясните роль витаминов в биосинтезе нуклеотидов.
Изучите процессы распада пуриновых нуклеотидов в тканях.
Изучите процессы распада пиримидиновых нуклеотидов в тканях.
Нарисуйте схему «Этапы образования мочевой кислоты при распаде пуриновых нуклеотидов» (рис. 27). Впишите название фермента и соединения, которое, является конкурентным ингибитором фермента.
Рассмотрите возможные нарушения в обмене нуклеотидов.
ГМФ
ГУАНОЗИН
Н2О2
Н2О
О2

КСАНТИН МОЧЕВАЯ КИСЛОТА  
Н2О2

О2
Н2О
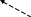
ингибитор ?

ГИПОКСАНТИН
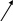
ИНОЗИН
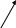
АДЕНОЗИН
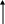
АМФ
Рис. 27. Этапы образования мочевой кислоты при распаде
пуриновых мононуклеотидов
Ориентировочная карта действия
№
|
Вопросы, подлежащие изучению
|
Последовательность работы
и способ оформления результатов
|
1.
|
Количественное определение мочевой кислоты в моче
|
Провести определение содержания мочевой кислоты в моче.
Принцип: Мочевая кислота в щелочной среде восстанавливает фосфорно-вольфрамовый реактив. Количество восстановленного фосфорно-вольфрамового реактива, окрашенного в интенсивный синий цвет, можно определить титрованием раствора К3[Fe(CN)6], который при этом окисляется с образованием бесцветного продукта. Количество К3[Fe(CN)6], израсходованного на окисление эквивалентно количеству мочевой кислоты.
Ход работы: В опытную пробирку внести 2 мл мочи, в стандартную – 2 мл стандартного раствора мочевой кислоты (0,5 мг/мл). Затем в обе пробирки добавить по 1 мл NaOH и по 1 мл фосфорно-вольфрамового реактива – Появляется синее окрашивание. Растворы титровать К3[Fe(CN)6] до обесцвечивания.
Рассчитать концентрацию мочевой кислоты в опытной пробирке по стандартной. Сделать вывод о содержании мочевой кислоты в моче, пользуясь соответствующей терминологией.
|
Тестовые задания
В кишечнике всасываются преимущественно продукты переваривания нуклеопротеинов
1) олигонуклеотиды;
2) мононуклеотиды;
3) нуклеозиды;
|
4) азотистые основания;
5) динуклеотиды.
|
Биосинтез пиримидиновых оснований начинается с образования
1) сукцинил-КоА;
2) инозиновой кислоты;
3) карбамоилфосфата;
|
4) ацетоацетата;
5) ксантиновой кислоты.
|
Мочевая кислота содержит гетероцикл
1) пиридина;
2) пиримидина;
3) тиофена;
|
4) пурина;
5) тиазола.
|
Источником рибозы, необходимой для синтеза мононуклеотидов является
1) гликолиз;
2) гликогенолиз;
3) глюконеогенез;
|
4) цикл трикарбоновых кислот;
5) пентозофосфатный путь.
|
Конечный продукт метаболизма пуриновых нуклеотидов в тканях человека………………………
Включение одноуглеродных фрагментов в синтезируемое пуриновое кольцо происходит с участием коферментной формы витамина
1) фолиевой кислоты;
2) рибофлавина;
3) пиридоксина;
|
4) пантотената;
5) никотинамида.
|
Ингибитором фермента ксантиноксидазы является
1) гипоксантин;
2) ЦМФ;
3) АМФ;
|
4) аллопуринол;
5) карбамоилфосфат.
|
В синтезе нуклеотидов используются аминокислоты
А. Синтез пиримидиновых
нуклеотидов;
Б. Синтез пуриновых
нуклеотидов;
|
глицин;
цистеин;
аспартат;
аланин;
метионин.
|
При декарбоксилировании оротидин-5-монофосфорной кислоты образуется
1) АМФ;
|
2) ЦМФ;
|
3) ГМФ;
|
4) ИМФ;
|
5) УМФ.
|
Гиперурикемия с гипоурикурией свидетельствуют о патологии
-
1) печени;
2) почек;
3) суставов;
|
4) надпочечников;
5) мышц.
|
Занятие 24. Коллоквиум «Обмен белков и аминокислот»
Мотивация: Знание особенностей обмена белков и аминокислот и механизмов регуляции необходимо для понимания их роли в жизнедеятельности организма и формировании патологии белкового и аминокислотного обмена.
Цель занятия: Закрепить представления о путях катаболизма и анаболизма белков и аминокислот, их гормональной регуляции и патологии.
Студент должен:
Знать
|
Уметь
|
Пути биосинтеза заменимых аминокислот (общая схема).
Особенности обмена метионина: участие в реакциях трансметилирования и синтеза цистеина. Роль ТГФК в переносе одноуглеродных групп.
Особенности обмена фенил-аланина и тирозина и наследственные нарушения их обмена.
Роль гормонов в регуляции белкового обмена.
Патологию белкового и аминокислотного обмена
|
Объяснить образование аминокислот из продуктов распада углеводов и жиров. Образование глюкозы из аминокислот.
Объяснить роль метионина как источника метильных и HS-групп.
Объяснить роль фенилаланина и тирозина в образовании тироксина, катехоламинов, меланина. Объяснить механизмы развития изменений при патологии.
Объяснить анаболическое и катаболическое действие гормонов на обмен белков.
Пояснить характер нарушения обмена белков при белковой недостаточности
|
|
Вопросы
|
Где изучались
|
1.
|
Химическая структура аминокислот
и белков
|
Кафедра биоорганической
химии
|
2.
|
Реакции трансметилирования
|
Там же
|
Содержание обучения.
Граф логической структуры темы
     Этапы Этапы
обмена белков
|
П ереваривание ереваривание
Аминокислоты
|
К леточный леточный
метаболизм
Анаболизм Катаболизм
|
Конечные
 продукты продукты
СО2 Н2О
Мочевина
|
  Превращения аминокислот Превращения аминокислот
в тканях
|
Дезаминирование
|
Трансаминирование Декарбоксилирование
Участие в синтезе
Белков Пептидов Азотсодержащих
соединений
|
  Судьба Судьба
безазотистого
остатка
аминокислот
|
Окисление
до СО2 и Н2О
|
Превращение
в глюкозу
и жиры
|
Синтез
заменимых аминокислот
Аминирование
Трансминирование
|
      П П родукты родукты
Обмена
некоторых
аминокислот
|
Фенилаланин
Тирозин
Катехоламины
Тироксин
Меланины
|
М етионин етионин
СН3 Цистеин
С интез интез
Креатина
Адреналина
Холина
|
Триптофан
Серотонин
Витамин РР
|
      Влияние гормонов на обмен белков Влияние гормонов на обмен белков
|
Анаболическое
СТГ Половые Инсулин
стероиды
Тироксин
(физиол. конц.)
|
Катаболическое
Глюкокортико-
стероиды Тироксин
(фармакол. доза)
|
    Проявление Проявление
белковой
недостаточности
|
Гипопротеинемия
Г ипоальбуминемия ипоальбуминемия
Гипоглобулинемия
Развитие
отеков
Снижение
иммунитета
|
Усиление распада
белков
Атрофия мышц,
снижение массы тела
|
Снижение
синтеза белков
Анемия
Иммунодефицит
|
Вопросы и задания для самоподготовки
Изучите особенности обмена глицина и серина. Выясните, для синтеза каких соединений они используются.
Изучите особенности обмена дикарбоновых аминокислот. Выясните, для синтеза каких соединений они используются.
Изучите особенности обмена серосодержащих аминокислот. Выясните, для синтеза каких соединений они используются.
Нарисуйте схему «Участие метионина в реакциях транс-метилирования» (рис. 28), вписав названия образующихся веществ.
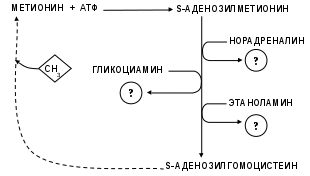
Рис. 28. Участие метионина в реакциях трансметилирования
Изучите особенности обмена фенилаланина и тирозина. Выясните, для синтеза каких соединений они используются.
Дополните и нарисуйте схему превращений фенилаланина и тирозина в тканях (рис. 29), обозначив места возможной блокады в случаях врожденной ферментной недостаточности (фенилкетонурия, альбинизм, алкаптонурия и др.).
Выясните, какие процессы обеспечивают динамическое состояние обмена белков организма.
Изучите влияние гормонов на процессы метаболизма белков.
Выясните возможные нарушения в обмене белков и аминокислот при белковой недостаточности.
Проследите путь синтеза заменимых аминокислот аланина и глутаминовой из глюкозы.
|
|
|
 Скачать 2.47 Mb.
Скачать 2.47 Mb.













 ереваривание
ереваривание леточный
леточный  продукты
продукты


 родукты
родукты  етионин
етионин интез
интез



 ипоальбуминемия
ипоальбуминемия