УМП КОЛИЧ.АНАЛИЗПрактическое руководство. Учебное пособие по количественному химическому анализу Учеб пособие. Уфа Издво угнту, 2005. 111 с
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
Пусть исходные данныеС(Ce4+)=0,1 моль/л; V(Ce4+)=100,00 мл; С(Fe2+)=0,1 моль/л; V(Fe2+)=100,00 мл. ОВ потенциалы редокс-пар, определяются уравнением Нернста: Потенциал исходного раствораИсходный раствор содержит Fe (II), а равновесная концентрация Fe (III) ничтожно мала и неизвестна. Поэтому рассчитать равновесный ОВ потенциал исходного раствора по уравнению Нернста невозможно. Расчет потенциала до точки эквивалентностиПоскольку реакция обратима, при титровании в растворе всегда присутствуют как исходные, так и образовавшиеся при реакции ионы. То есть в любой из моментов титрования раствор содержит две окислительно-восстановительные пары Fe3+/ Fe2+ и Ce4+/ Ce3+. Рассчитать потенциал системы можно было бы по любому из уравнений а) и б). Пока оттитровано не все железо (II), концентрации ионов оставшихся Fe3+ и Fe2+ вычислить очень легко, а концентрации оставшихся непревращенными (вследствие обратимости реакции) ионов Се4+ вычислить гораздо труднее, поэтому удобно пользоваться уравнением б): В любой из моментов титрования, до точки эквивалентности, ОВ-процесс будет описываться сокращенным уравнением: Рассчитаем ОВ потенциал в точке начала скачка (Н.С.), то есть в момент, когда раствор не дотитрован на 0,1%: Рассчитаем равновесные концентрации [Fe2+][Fe3+] 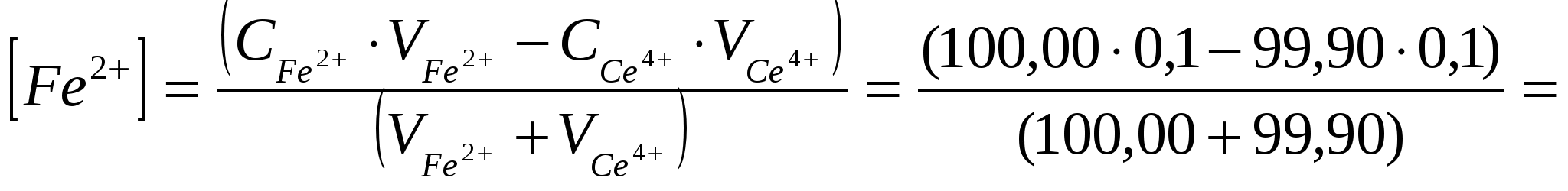 =5·10-5 моль/л, 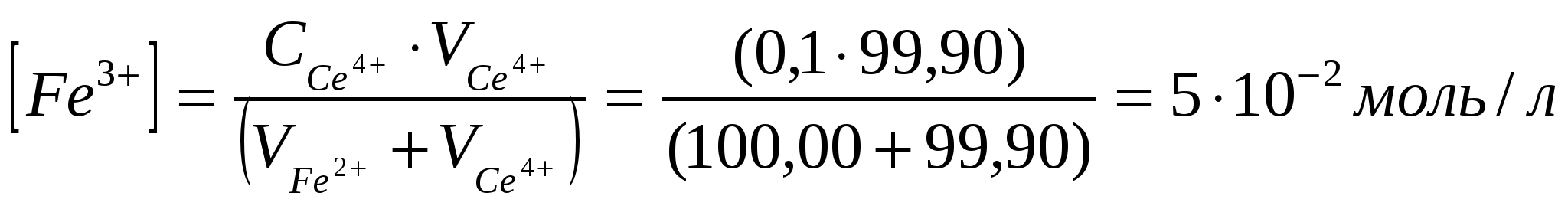 , , Таким образом, в точке Н.С.: Расчет потенциала раствора в точке эквивалентности. В растворе присутствуют Fe (III) и Сe (III) в эквивалентных количествах.Так как концентрации Fe (II) и Се (IV) ничтожны и неизвестны, то потенциал раствора невозможно рассчитать по уравнению Нернста для той и другой редокс-пары. Таким образом, при равновесии тогда а при равновесии  Расчет потенциала раствора после точки эквивалентности (ТЭ). После ТЭ в растворе присутствуют Fe3+; Ce3+; Ce4+, а [Fe2+]-ничтожна и неизвестна.Поэтому потенциал раствора можно рассчитать по уравнению Нернста для пары Ce4+/ Ce3+:В любой из моментов титрования, после ТЭ, ОВ-процесс будет описываться сокращенным уравнением: Рассчитаем ОВ потенциал в точке конец скачка (К.С.), то есть в момент, когда раствор перетитрован на 0,1%: Вычислим равновесные концентрации [Ce4+] и [Ce3+]: 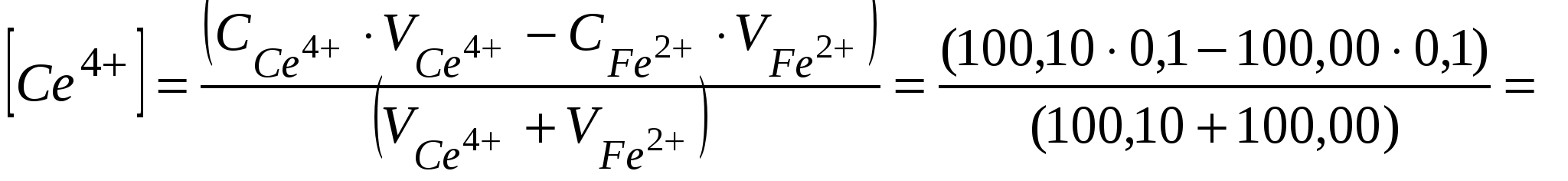 =5·10-5 моль/л; 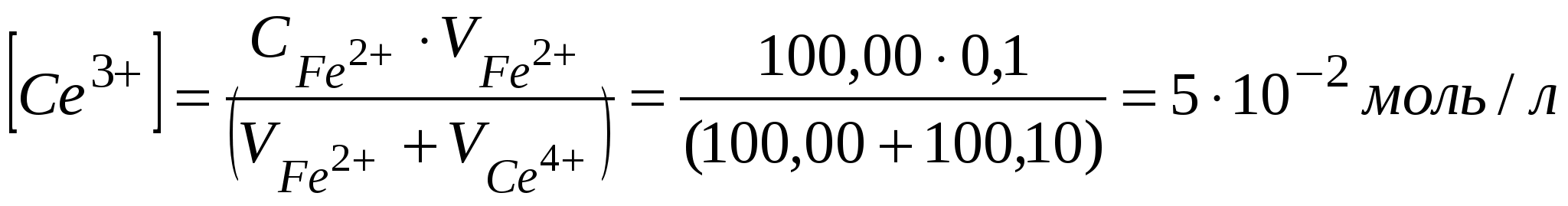 ; ;Cледовательно, в точке К.С.: По полученным формулам рассчитывается потенциал раствора в различные моменты титрования и выбирается ОВ индикатор, значение стандартного ОВ-потенциала которого лежит в области скачка на кривой титрования. В данном случае область скачка лежит в интервале от +0,947 В до +1,263 В. По таблице (приложение) выбираем подходящий индикатор – это фенилантраниловая кислота (φо=1,00 В). Пример 2: Рассчитать область скачка окислительно-восстанови-тельного титрования раствора Fe (II) раствором дихромата калия K2Cr2O7 в кислой среде. Решение: При титровании протекает реакция: для первой пары: 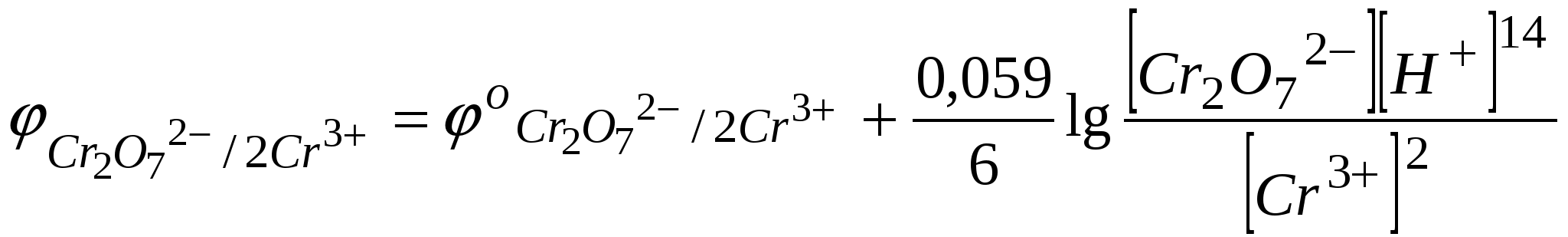 для второй пары: Fe2+-1ē Fe3+; n2=1. Пусть исходные данные: С(Fe2+)=0,05 моль/л; V (Fe2+)=100,00 мл; С( С(Н+)=1 моль/л Расчет потенциала раствора до точки эквивалентности.После прибавления раствора K2Cr2O7 до ТЭ в титруемом кислом растворе присутствуют катионы Fe2+, Fe3+; Cr3+ а ионы Cr2O72- - отсутствуют. Потенциал раствора рассчитывается по уравнению Нернста для редокс-пары исходного раствора:До ТЭ ОВ-процесс будет описываться уравнением: Рассчитаем ОВ-потенциал в точке Н.С.: 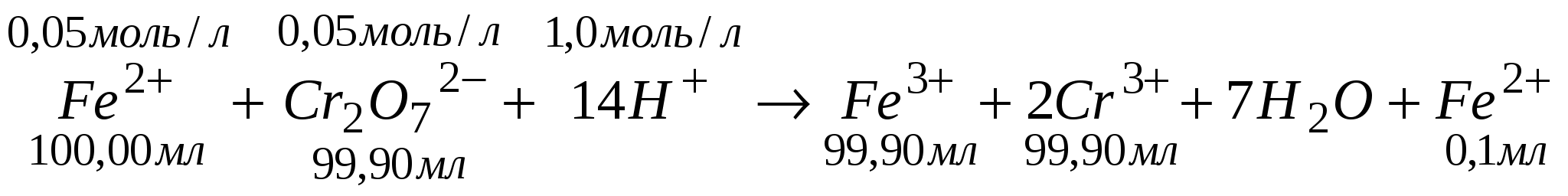 Равновесные концентрации [Fe2+] и [Fe3+] будут:  =2,5·10-5моль/л; 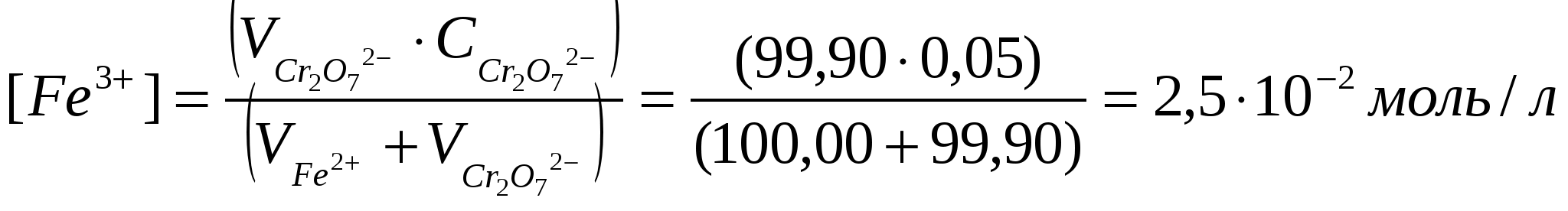 Расчет потенциала раствора в точке эквивалентности |
