Таблица 4
Области перехода важнейших рН-индикаторов
Индикатор
|
Растворитель
|
Концентрация, %
|
Характер индикатора
| Окраска |
Область перехода рН
|
кислотной формы
|
щелочной формы
|
Ализариновый желтый
|
Вода
|
0,1
|
Кисл.
|
Желтая
|
Фиолетовая
|
10,1-12,0
| Тимолфталеин |
90%-ный спирт
|
0,1
|
Кисл.
|
Бесцветная
|
Синяя
|
9,3-10,5
| Фенолфталеин |
60%-ный спирт
|
0,1 и 1,0
|
Кисл.
|
Бесцветная
|
Красная
|
8,0-10,0
| Крезоловый пурпурный |
20%-ный спирт
|
0,05
|
Кисл.
|
Желтая
|
Пурпурная
|
7,4-9,0
| Нейтральный красный |
60%-ный спирт
|
0,1
|
Основн.
|
Красная
|
Желто-коричневая
|
6,8-8,0
| Феноловый красный |
20%-ный спирт
|
0,1
|
Кисл.
|
Желтая
|
Красная
|
6,4-8,0
| Бромтимоловый синий |
20%-ный спирт
|
0,05
|
Кисл.
|
Желтая
|
Синяя
|
6,0-7,6
|
Лакмус (азолитмин)
|
Вода
|
1,0
|
Кисл.
|
Красная
|
Синяя
|
5,0-8,0
| Метиловый красный |
60%-ный спирт
|
0,1 и 0,2
|
Основн.
|
Красная
|
Желтая
|
4,2-6,2
| Метиловый оранжевый |
Вода
|
0,1
|
Основн.
|
Розовая
|
Желтая
|
3,1-4,4
| Бромфениловый синий |
Вода
|
0,1
|
Кисл.
|
Желтая
|
Синяя
|
3,0-4,6
| Тропеолин 00 |
Вода
|
0,01; 0,1 и 1,0
|
Основн.
|
Красная
|
Желтая
|
1,4-3,2
| Кристаллический фиолетовый |
Вода
|
-
|
|
Зеленая
|
Фиолетовая
|
0,0-2,0
|
Таблица 6
Области перехода и φо некоторых ОВ индикаторов
Индикатор
|
φоInd, B
|
Окраска индикатора
|
окисленная форма
|
Восс форма
|
Нитро-о-фенантролин+FeSO4
|
1,25
|
Бледно-голубая → красная
|
2,2'-Дипиридил (комплекс с Fe2+)
|
1,14 (кислая среда)
|
Бледно-голубая → красная
|
Фенилантраниловая кислота
|
1,08 (1 Мр-р H2SO4)
|
Красно-фиолетовая → бесцветная
|
о-Фенантролин+FeSO4 (ферроин)
|
1,06 (1 М р-р H2SO4)
|
Бледно-голубая → красная
|
5,6-Диметил-1,10-фенантролин (комплекс с Fe2+)
|
0,97
|
Желто-зеленая → красная
|
Дифениламин-4-сульфонат бария или натрия
|
0,84 (кислая среда)
|
Красно-фиолетовая → бесцветная
|
Дифениламин
|
0,76 (кислая среда)
|
Фиолетово-синяя → бесцветная
|
N,N' - Дифенилбензидин
|
0,76 (кислая среда)
|
Фиолетовая → бесцветная
|
Индиго-5,5'-дисульфонат натрия
|
0,29 (рН=0)
|
Синяя → желтая
|
2,6-Дибромфенол-индофенолят натрия
|
0,218 (рН=7)
|
Фиолетовая → бесцветная
|
2,6-Дихлорфенол-индо-о-крезолят натрия
|
0,181 (рН=7)
|
Фиолетовая → бесцветная
|
Тионин
|
0,06 (рН=7)
|
Фиолетовая → бесцветная
|
Метиленовый голубой
|
0,011 (рН=7)
|
Синяя → бесцветная
|
Индиго-5,5'; 7,7'- тетрасульфонат калия
|
-0,046 (рН=7)
|
Синяя → бесцветная
|
Индиго-5-сульфоат калия
|
-0,160 (рН=7)
|
Синяя → бесцветная
|
Сафранин T
|
-0,289 (рН=7)
|
Коричневая → бесцветная
|
Нейтральный красный
|
-0,33 (рН=7)
|
Красно-фиолетовая → бесцветная
|
Метилвиологен дихлорид
|
-0,446 (рН=8÷12)
|
Бесцветная → темно-синяя
|
Таблица 7
Константы нестойкости комплексных ионов
Комплекс
|
оС
|
К
|
Комплекс
|
оС
|
К
|
Комплексы с аммиаком
|
[Ag(NH3)2]+
|
30
|
9,3·10-8
|
[Cu(NH3)2]2+
|
30
|
2,24·10-8
|
[Co(NH3)6]2+
|
30
|
7,75·10-6
|
[Cu(NH3)]2+
|
30
|
7,1·10-5
|
[Co(NH3)6]3+
|
30
|
3,1·10-33
|
[Hg(NH3)4]2+
|
22
|
5,3·10-20
|
[Cu(NH3)4]2+
|
30
|
2,14·10-13
|
[Mg(NH3)6]2+
|
22
|
2,1·10-13
|
[Cu(NH3)3]2+
|
30
|
2,89·10-11
|
[Ni(NH3)4]2+
|
30
|
1,12·10-8
|
[Zn(NH3)3]2+
|
30
|
3,5·10-10
|
[Ni(NH3)6]2+
|
30
|
1,86·10-9
|
Бромидные комплексы
|
[AgBr2]-
|
25
|
7,8·10-8
|
[HgBr4]2-
|
25
|
2·10-22
|
[AgBr3]2-
|
25
|
1,3·10-9
|
[PbBr4]2-
|
25
|
1·10-3
|
[CuBr2]-
|
20
|
1,3·10-6
|
[ZnBr3]-
|
25
|
50
|
Йодидные комплексы
|
[AgI4]3-
|
25
|
1,8·10-14
|
[HgI4]2-
|
25
|
1,5·10-30
|
[BiI6]3-
|
20
|
3,1·10-12
|
[PbI4]2-
|
25
|
1,4·10-4
|
Роданидные комплексы
|
[Ag(SCN)2]-
|
25
|
2,7·10-8
|
[Hg(SCN)4]2-
|
25
|
5,9·10-22
|
[Ag(SCN)4]3-
|
25
|
8,3·10-11
|
[Ni (SCN)3]-
|
20
|
1,5·10-2
|
Тиосульфатные комплексы
|
[Ag(S2O3)2]3-
|
25
|
2,5·10-14
|
[Hg(S2O3)2]2-
|
25
|
3,6·10-30
|
[Cu(S2O3)2]3-
|
25
|
6,0·10-13
|
[Hg(S2O3)3]4-
|
25
|
1,3·10-32
|
|
|
|
[Hg(S2O3)4]6-
|
25
|
5,8·10-34
|
Хлоридные комплексы
|
[AgCl2]-
|
25
|
1,76·10-5
|
[CuCl3]2-
|
18
|
5,0·10-6
|
[AgCl4]3-
|
25
|
1,2·10-6
|
[HgCl3]2-
|
25
|
8,5·10-15
|
[BiCl6]3-
|
18
|
3,8·10-7
|
[PbCl4]2-
|
25
|
7,1·10-3
|
[PtCl4]2-
|
25
|
1,8·10-16
|
[HgCl4]2-
|
25
|
8,5·10-16
|
Цианидные комплексы
|
[Ag(CN)2]-
|
18
|
8·10-22
|
[Hg(CN)4]2-
|
25
|
4,0·10-42
|
[Fe(CN)6]4-
|
25
|
1,0·10-24
|
[Ni(CN)4]2-
|
25
|
1,8·10-14
|
[Fe(CN)6]3-
|
25
|
1,0·10-31
|
[Zn(CN)4]2-
|
18
|
1,3·10-17
|
[Cu(CN)4]2-
|
25
|
5·10-28
|
|
|
|
Гидроксокомплексы
|
[Al(OH)4]-
|
25
|
1·10-33
|
[Cu(OH)4]2-
|
25
|
7,6·10-17
|
[Cr(OH)4]-
|
25
|
1,02·10-30
|
[Zn(OH)4]2-
|
25
|
3,6·10-16
|
Таблица 8
Произведение растворимости некоторых
малорастворимых электролитов при 25 оС
Электролит
|
|
Электролит
|
|
Электролит
|
|
AgBr
|
5,3·10-13
|
CaSO4
|
2,5·10-5
|
MnS
|
2,5·10-10
|
Ag2CO3
|
8,2·10-12
|
Ca3(PO4)2
|
1,0·10-29
|
Ni(OH)2
|
6,3·10-18
|
AgCl
|
1,8·10-10
|
CdS
|
1,6·10-28
|
PbBr2
|
9,1·10-6
|
Ag2CrO4
|
1,1·10-12
|
CoCO3
|
1,5·10-10
|
PbCO3
|
7,5·10-14
|
AgI
|
8,3·10-17
|
Co(OH)2
|
2·10-16
|
PbCl2
|
1,56·10-5
|
Ag2S
|
5,3·10-50
|
CrPO4
|
2,4·10-23
|
PbF2
|
2,7·10-8
|
Ag2SO4
|
1,6·10-5
|
CuCO3
|
2,5·10-10
|
PbI2
|
1,1·10-9
|
Ag3PO4
|
1,3·10-20
|
Cu(OH)2
|
1,6·10-19
|
PbS
|
2,5·10-27
|
Al(OH)3
|
5·10-33
|
CuS
|
6,3·10-36
|
PbSO4
|
1,6·10-8
|
AlPO4
|
5,7·10-19
|
Fe(OH)2
|
8·10-16
|
Pb3(PO4)2
|
7,9·10-43
|
BaCO3
|
5,1·10-9
|
Fe(OH)3
|
6,3·10-38
|
Sb2S3
|
1,6·10-93
|
BaCrO4
|
1,2·10-10
|
FePO4
|
1,3·10-22
|
SrCO3
|
1,1·10-10
|
BaSO4
|
11·10-10
|
FeS
|
5·10-18
|
SrCrO4
|
3,6·10-5
|
Ba3(PO4)2
|
6,0·10-39
|
HgS
|
1,6·10-52
|
SrF2
|
2,5·10-9
|
BeCO3
|
1·10-3
|
MgCO3
|
2,1·10-5
|
SrSO4
|
3,2·10-7
|
CaCO3
|
4,8·10-9
|
Mg(OH)2
|
6·10-10
|
ZnCO3
|
1,4·10-14
|
CaF2
|
4,0·10-11
|
Mg3(PO4)2
|
1·10-13
|
Zn(OH)2
|
1·10-17
|
CaHPO4
|
2,7·10-7
|
MnCO3
|
1,8·10-11
|
α-ZnS
|
1,6·10-24
|
Ca(H2PO4)2
|
1·10-3
|
Mn(OH)2
|
1,9·10-13
|
Zn3(PO4)2
|
9,1·10-33
|
Таблица 9
Аналитические и стехиометрические множители (факторы)
Определяют
|
Взвешено
|
Множитель, f
|
Lg f
|
1
|
2
|
3
|
4
|
Ag
|
AgBr
|
0,5745
|
75 925
|
|
AgCl
|
0,7526
|
87 658
|
|
AgI
|
0,4595
|
66 229
|
Al
|
Al(C9H6ON)3 (оксихинолят)
|
0,05872
|
76 876
|
|
Al2O3
|
0,5292
|
72 370
|
|
AlPO4
|
0,2212
|
34 479
|
Ba
|
BaCrO4
|
0,5421
|
73 410
|
|
BaSO4
|
0,5884
|
76 967
|
BaCl2
|
BaSO4
|
0,8923
|
95 049
|
BaCl2·2H2O
|
BaSO4
|
1,0466
|
01 978
|
CO2
|
CaCO3
|
0,4397
|
64 317
|
CO3
|
BaCO3
|
0,3041
|
48 295
|
CaCO3
|
CO2
|
2,274
|
35 683
|
|
CaO
|
1,785
|
25 158
|
Cd
|
Cd(C7H6O2N)2 (антранилат)
|
0,2922
|
46 568
|
|
Сd(C9H6ON)3 (оксихинолят)
|
0,2805
|
44 796
|
Cu
|
Cu(C10H6O2N)2 (хинальдинат)
|
0,1492
|
17 377
|
|
(C13H9N)2HCdI4 (β-нафтохинолин)
|
0,1149
|
06 025
|
Cd
|
CdO
|
0,8754
|
94 220
|
|
Cd2P2O7
|
0,5638
|
75 110
|
Cl
|
AgCl
|
0,2474
|
39 334
|
ClO3
|
AgCl
|
0,5822
|
76 510
|
Co
|
Co2P2O7
|
0,4039
|
60 631
|
Cr
|
BaCrO4
|
0,2053
|
31 233
|
Cu
|
CuO
|
0,7989
|
90 246
|
Cu
|
Cu(C5H5N)2(CNS)2 (..-пиридин-..)
|
0,1880
|
27 439
|
Cu
|
Cu(C9H6ON)2 (оксихинолят)
|
0,1806
|
25 668
|
Cu
|
CuC14H11O2N (купронат)
|
0,2200
|
34 246
|
Mo
|
PbMoO4
|
0,2613
|
41 719
|
Ni
|
NiC8H14N4O4 (диметилглиоксимат)
|
0,2032
|
30 790
|
P
|
Mg2P2O7
|
0,2783
|
44 453
|
P
|
(NH4)3PO4·12MoO3
|
0,01651
|
21 775
|
P
|
P2O5·24MoO3
|
0,01722
|
23 613
|
SO4
|
BaSO4
|
0,4115
|
61 441
|
Sn
|
SnO2
|
0,7877
|
89 634
|
Sr
|
SrC2O4·H2O
|
0,4525
|
65 559
|
Sr
|
SrO
|
0,8456
|
92 716
|
Sr
|
SrSO4
|
0,4770
|
67 854
|
Zn
|
Zn(C7H6O2N)2 (антранилат)
|
0,1936
|
28 698
|
Zn
|
Zn(C9H6ON)2 (оксихинолят)
|
0,1848
|
26 681
|
Zn
|
Zn[Hg(CNS)4]
|
0,1312
|
11 792
|
Zn
|
ZnO
|
0,8034
|
90 493
|
Zn
|
Zn2P2O7
|
0,4291
|
63 257
|
Если g – навеска вещества, взятого для анализа, α – вес высушенного для прокаленного осадка и f – множитель, найденный в данной таблице, то процентное содержание искомого вещества находят по формуле
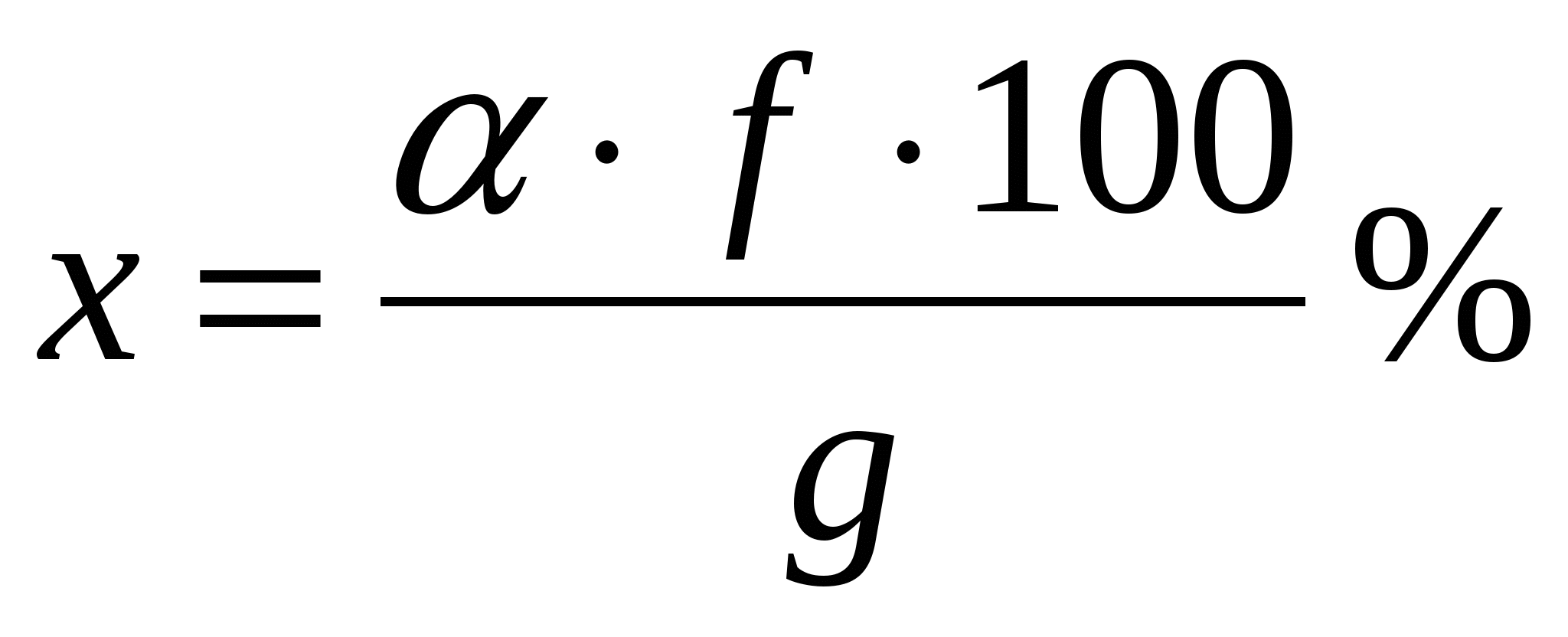 ; ; 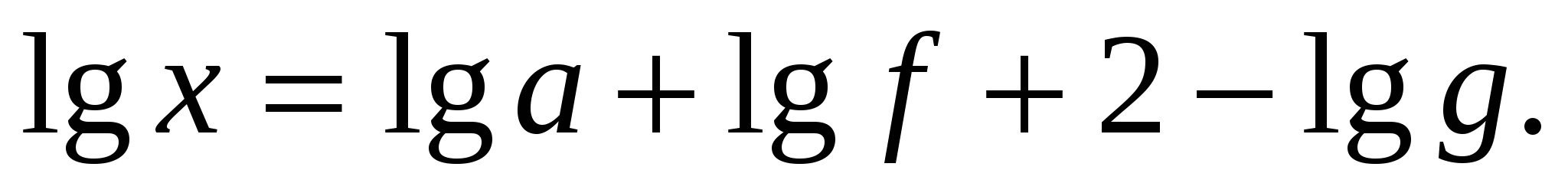
где a и g выражены в одинаковых единицах.
Вычисления надо производить, отбрасывая характеристики логарифмов и оставляя только их мантиссы. Тогда каждый расчет сводится к сложению трех чисел:  . .
БИБЛИОГРАФИЧЕСКИЙ СПИСОК.
Основы аналитической химии. /Под редакцией Золотова Ю.А. – М.: Высшая школа, 1999 – кн.1.2.
Аналитическая химия. Гравиметрический и титрометрический методы анализа. Том 1 – Васильев В.П. – М.: Высшая школа, 1989.
Основы аналитической химии. Количественный анализ. Крешков А.Н. Том 2.-М.: Химия. 1986.
Количественный анализ. Алексеев В.Н./Под редакцией док. Хим. наук Агасяна П.К. – М.: Химия, 1972.
Теоретические основы аналитической химии. Янсон Э.Ю. – М.: Высшая школа, 1987.
Химический анализ. Лайтинен Г.А., Харрис В.Е. – М.: Химия, 1979.
Сборник вопросов и задач по аналитической химии./Под ред. Проф. Васильева В.П. – М.: Высшая школа, 1976.
Справочник по аналитической химии. Лурье Ю.Ю. – М.: Химия, 1979.
Задачник по количественному анализу. /Под редакцией Мусакина А.П. – Л.: Химия, 1972.
Задачник по количественному анализу. Толстоусов В.Н., Эфрос С.М. – Л.: Химия, 1986.
Аналитическая химия. Кн. 1 и 2. Количественный анализ. Физико-химические методы анализа. Харитонов Ю.Я. – М.: Высшая школа, 2001.
Основы аналитической химии. Практическое руководство. Фадеева В.И. /Под редакцией Золотова Ю.А. – М.: Всшая школа, 2001.
Основы аналитической химии 1. Скут Д., Уэст Д. – М.: Мир, 1979.
СОДЕРЖАНИЕ
Введение__________________________________________________1
Метод кислотно-основного титрования.___________________________6
Расчеты в методе кислотно-основного титрования._________________7
Лабораторные работы. Метод кислотно-основного титрования._______8
Задачи и примеры решений.____________________________________20
Методы редоксиметрии (перманганатометрия и иодометрия).________30
Метод перманганатометрии.____________________________________34
Лабораторные работы. Метод перманганатометрии.________________36
Задачи и примеры решений._____________________________________45
Варианты домашних заданий.___________________________________72
Метод комплексонометрии._____________________________________73
Лабораторные работы. Метод комплексонометрии._________________76
Задачи и примеры решений._____________________________________80
Варианты домашних заданий.___________________________________86
Метод гравиметрии.____________________________________________87
Лабораторная работа. Метод гравиметрии.________________________88
Задачи и примеры решений._____________________________________91
Приложение__________________________________________________97
Библиографический список____________________________________110
|
 Скачать 1.33 Mb.
Скачать 1.33 Mb.