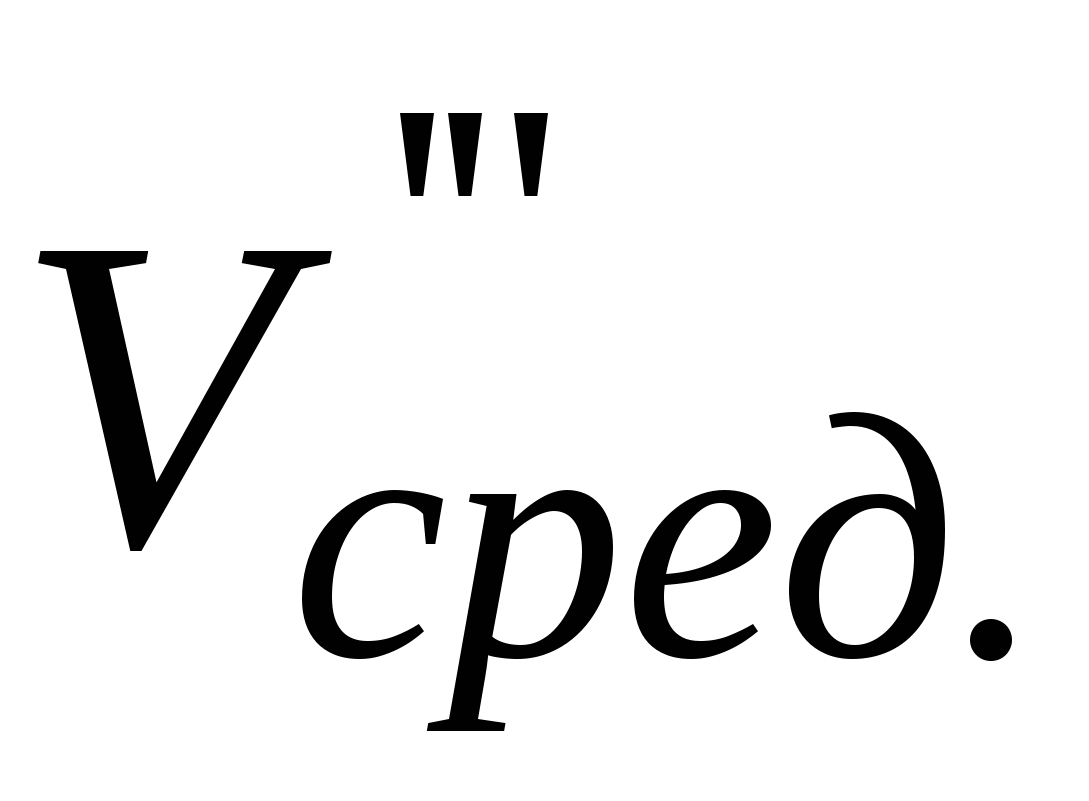3. МЕТОД КОМПЛЕКСОНОМЕТРИИ
В объемном анализе для определения различных катионов с зарядами больше одного применяют органические реактивы – комплексоны – аминополикарбоновые кислоты и их соли. Чаще всего применяется комплексон III – двухзамещенная натриевая соль этилендиаминтетрауксусной кислоты (имеет другое название – трилон Б).
По названию рабочего раствора метод анализа называется трилонометрией. Структурная формула трилона Б
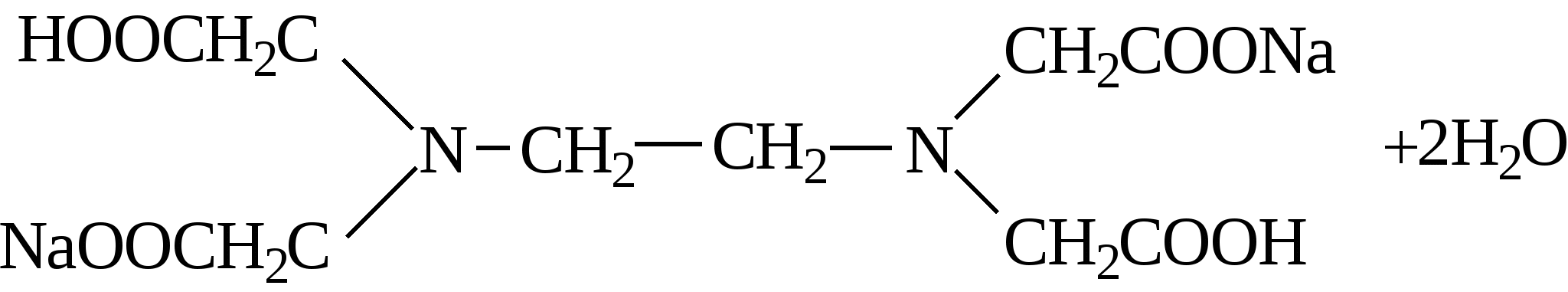
(сокращенная запись: Na2[H2Tr] или Na2[H2Edta]).
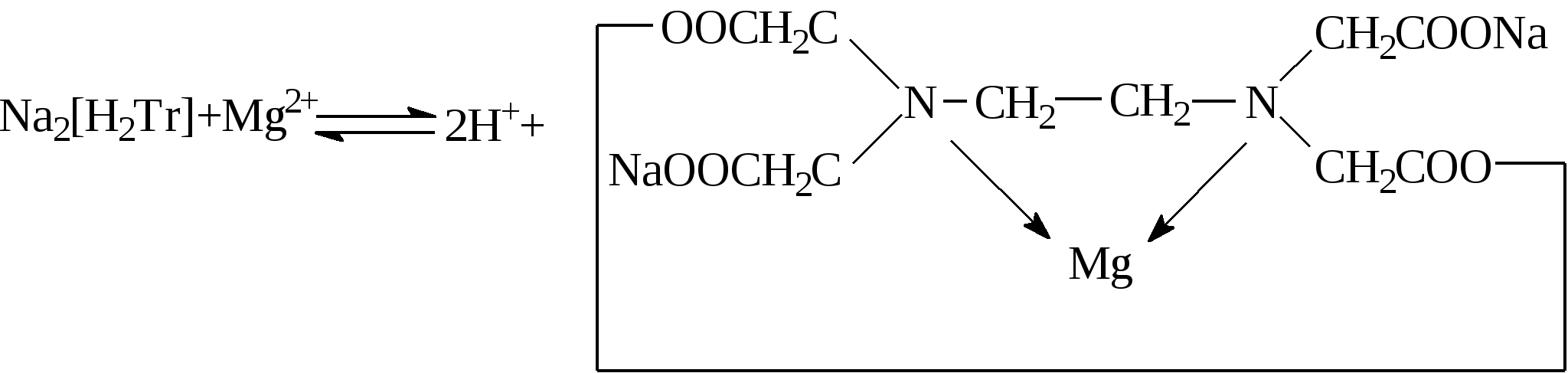
Трилон Б образует с катионами металлов Меn+ (п≥2) растворимые в воде прочные комплексные (клешневидные) соединения. Ион металла замещает ионы водорода двух карбоксильных групп и связывается координационной связью с двумя атомами азота (по донорно-акцепторному механизму). Например, с ионом магния идет обратимая реакция
Комплекс трилона Б с ионом металла устойчив только в щелочной среде, поэтому и проводят реакцию в щелочной среде. В зависимости от определяемого иона металла и применяемого индикатора щелочную среду следует создавать одним из реактивов: а) аммонийной буферной смесью (NH4OH+NH4Cl, pH=8÷9); б) раствором аммиака NH4OH (pH=10÷11); в) раствором сильной щелочи (рН>11).
Трехвалентные катионы взаимодействуют с трилоном Б по реакции
Al3+ + Na2[H2Tr]= Na[AlTr]+ 2H+ + Na+
Так как реакции ионов металлов с трилоном Б сопровождаются замещением двух ионов водорода, то формулы эквивалентов ионов металлов, независимо от их зарядов, и трилона Б записываются так:
½·Меп+ и 1/2·(Na2[H2Tr]), (z=2).
Комплексы разных металлов с трилоном Б различно устойчивы. Количественно эта устойчивость характеризуется величинами констант нестойкости или силовыми показателями; рКнест.=-lg Кнест.
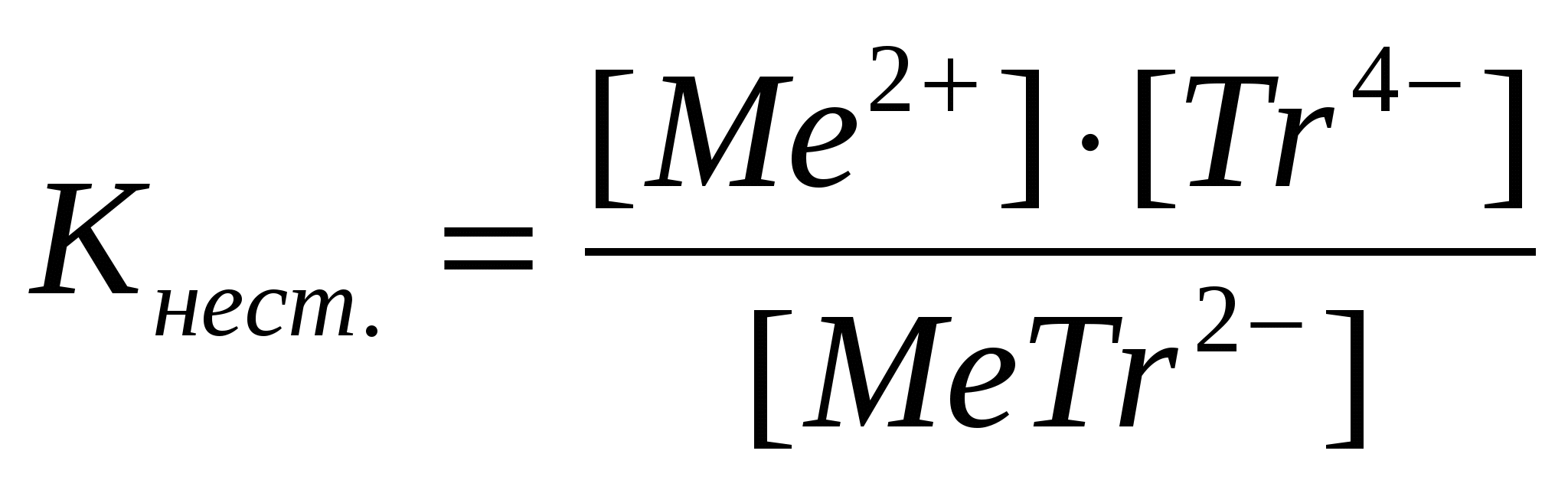
Значения рКнест. для некоторых катионов
Mo2+ - 8,7 Zn2+ - 16,50 Co2+ - 16,31
Ca2+ - 10,7 Al3+ - 16,13 Cu2+ - 18,80
Ni2+ - 18,50 Ге3+ - 25,10 Ba2+ - 7,76
Чем больше силовые показатели констант нестойкости, тем прочнее соответствующие комплексы.
Металлиндикаторы
Это органические многоосновные кислоты, различные ионы которых имеют разные окраски.
Так как ионы металлов с металлиндикаторами также образуют комплексные соединения, то в каждом конкретном определении применяется тот индикатор, у которого: а) комплекс с катионом менее прочный, чем комплекс этого катиона с трилоном Б; б) окраска самого индикатора отличается от окраски его комплекса.
Чаще всего применяются два индикатора: хромоген черный (эриохром черный Т) и мурексид. В водных растворах они неустойчивы, поэтому готовят их твердые растворы в NaCl или KCl (к 1 г индикатора добавляют 200 г соли и тщательно перемешивают).
Хромоген черный – трехосновная кислота (условное обозначение H3Ind), трехцветный индикатор, диссоциирует в зависимости от рН раствора следующим образом:
OH- OH- OH-
H3Ind ==== H2Ind- ==== HInd2- ==== Ind3-
H+ красный Н+ синий Н+ желтооранжевый
рН>6 рН=6,3÷11 рН>11,5
При взаимодействии с катионами образует комплексное соединение, имеющее другую окраску, например:
HInd2- + Mg2+ ==== [MgInd]- + H+
синяя винно-красная
В процессе титрования рабочий раствор трилона Б реагирует сначала со свободными ионами
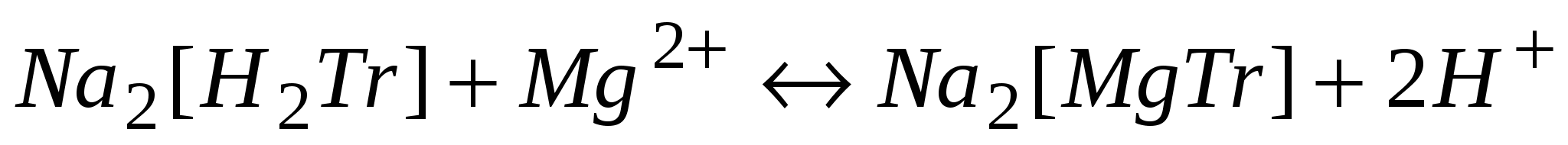
ионы водорода образуют молекулы воды:
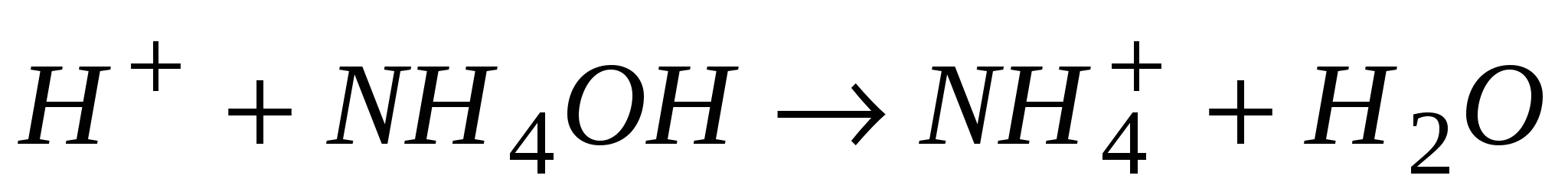
Эти реакции идут с большой скоростью. В конце титрования происходит процессы разложения комплекса катиона с индикатором и образования комплекса катиона с трилоном Б:
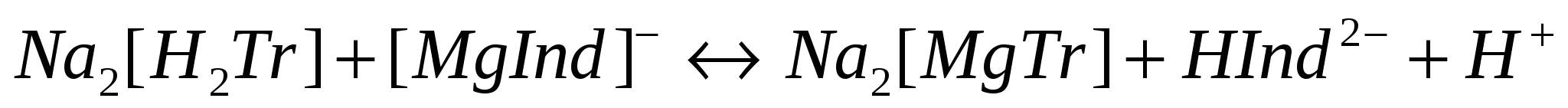
синий
Эта реакция идет с меньшей скоростью, поэтому около точки эквивалентности нужно титровать медленно, тщательно перемешивать титруемый раствор после прибавления каждой капли трилона Б.
В эквивалентной точке происходит резкий переход окраски раствора от винно-красной до синей. Таким путем можно определить катион (n≥2), комплекс которого с хромогеном черным менее прочный, чем комплекс с трилоном Б (Mg2+, Cd2+, Zn2+, Pb2+).
Мурексид – пяти-основная органическая кислота (H5Ind), многоцветный индикатор (окраска меняется при изменении рН раствора):
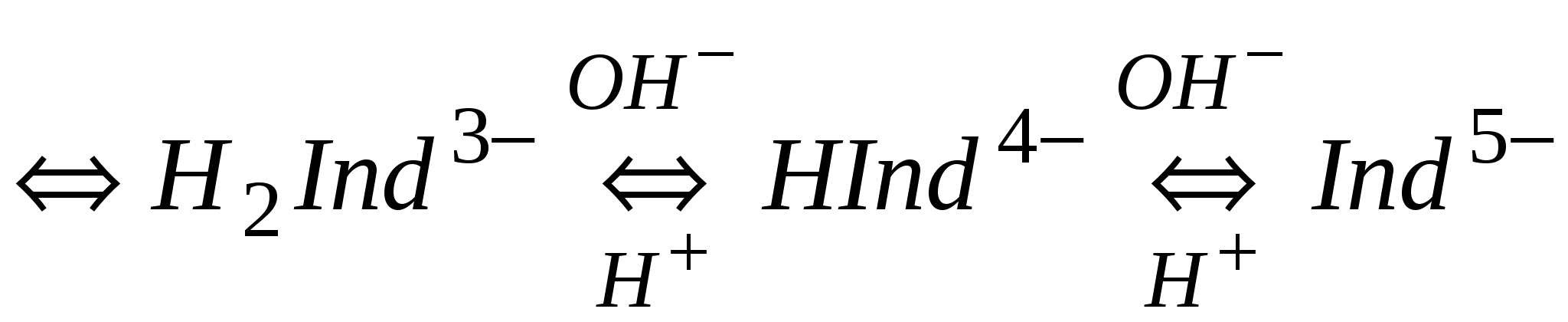
красно-фиолетовая фиолетовая сиреневая
рН=9-10 рН=10-11 рН>11
Катион Са2+ с мурексидом в сильно-щелочной среде (1 н. раствор NaOH, рН>11) образует комплекс красного цвета:
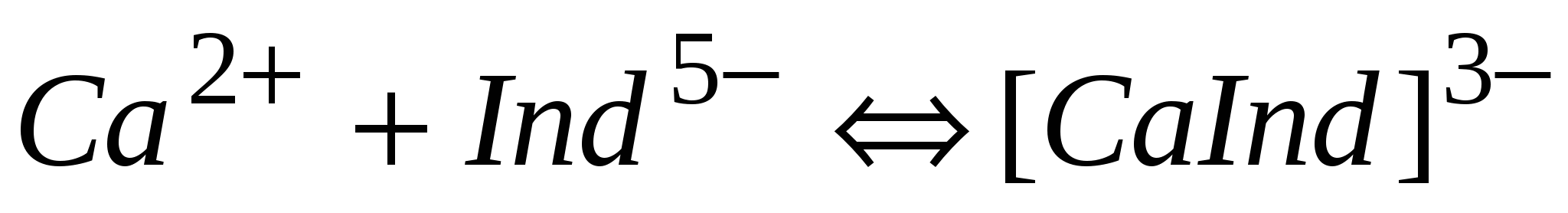
красный
В конце титрования этот комплекс переходит в более прочный бесцветный комплекс катиона с трилоном Б, освобождается ион Ind5- и окраска раствора становится сиреневой:
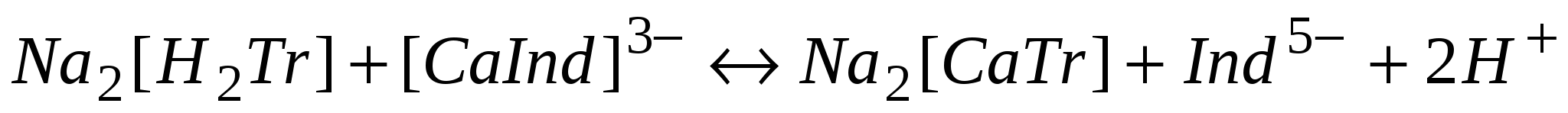
сиреневая
Ион никеля в аммиачном растворе (рН-10-11) с мурксидом образует комплекс желтого цвета:

Ион никеля имеет свою окраску, поэтому перед титрованием нужно раствор соли разбавить водой. В эквивалентной точке происходит реакция:
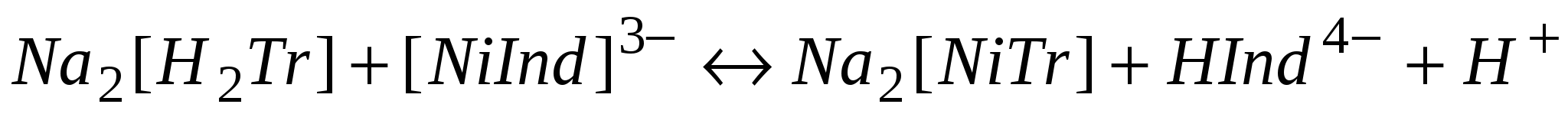
желтый фиолетовый
Цвет меняется от желтого к фиолетовому.
Катион Со2+ в растворе аммиачного буфера (рН=9-10) с мурексидом образует комплекс желтого цвета:

красно-фиолетовый желтый
В точке эквивалентности происходит реакция:
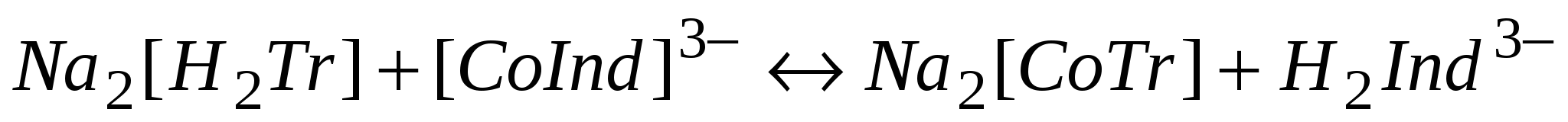
красно-фиолетовый
Цвет меняется от желтого к почти малиновому.
3.1. Лабораторные работы (Метод комплексонометрии).
Лабораторная работа № 1
Приготовление рабочего раствора трилона Б 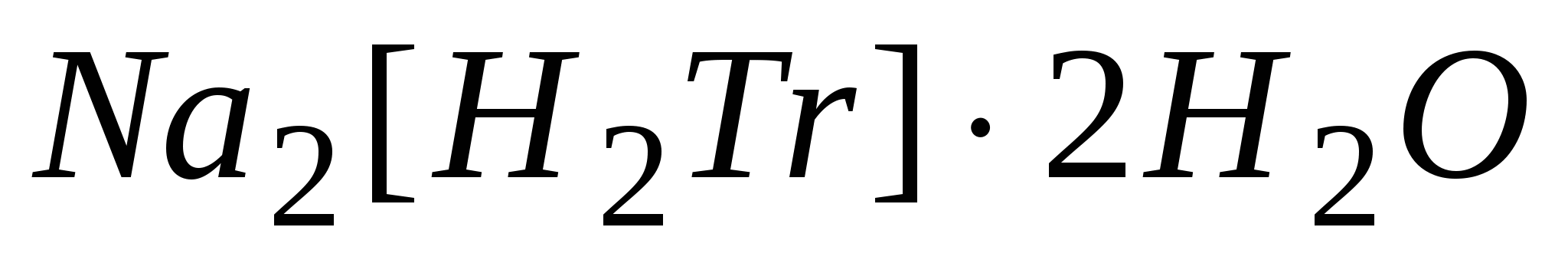 или Na2C10H14O8N2 или Na2C10H14O8N2
Молярная масса трилона Б равна 336,2 г/моль, молярная масса эквивалента М(1/2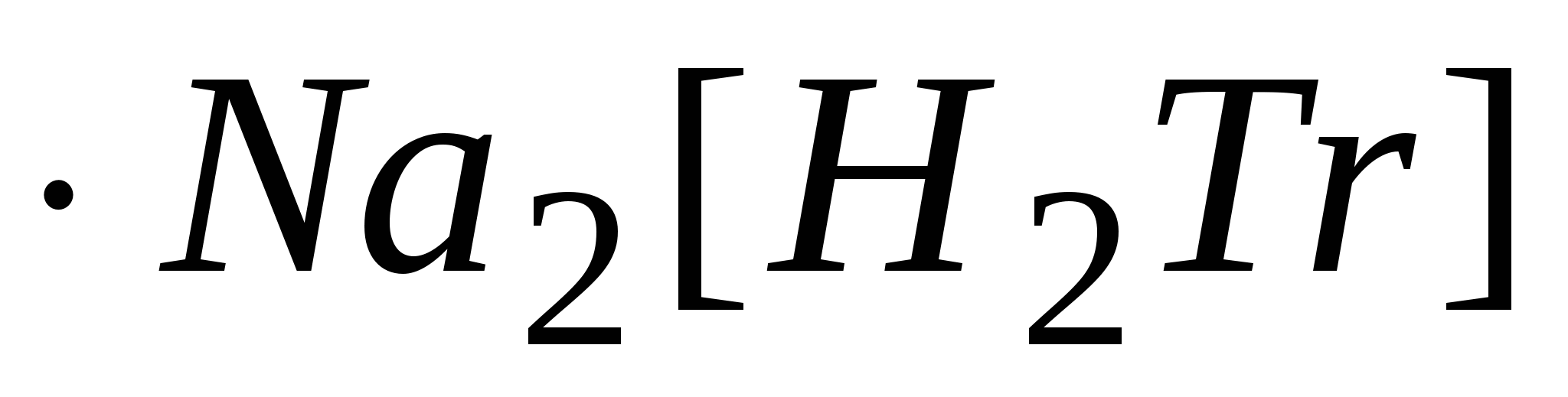 )=336,2/2=168,1 г/моль. Эта соль легко получается в химически чистом виде, хорошо растворима в воде, бесцветные растворы её устойчивы при хранении (содержит около 0,3% влаги). Обычно готовят 0,05 н. раствор трилона Б и устанавливают точную нормальность по раствору соли цинка или по раствору соли магния MgSO4. Раствор соли MgSO4 точной концентрации, равной 0,05 н. готовят из фиксанала. Ампула фиксанала содержит навеску , при растворении которой в мерной колбе на два литра получается 0,05 н. раствор соли. Затем аликвоту раствора MgSO4 титруют раствором трилона Б в присутствии аммиачного буфера и индикатора хромогена черного от вишнево-красной окраски до синей. По нормальности и по объемам пипетки и по бюретке рассчитывают точную нормальность рабочего раствора трилона Б. )=336,2/2=168,1 г/моль. Эта соль легко получается в химически чистом виде, хорошо растворима в воде, бесцветные растворы её устойчивы при хранении (содержит около 0,3% влаги). Обычно готовят 0,05 н. раствор трилона Б и устанавливают точную нормальность по раствору соли цинка или по раствору соли магния MgSO4. Раствор соли MgSO4 точной концентрации, равной 0,05 н. готовят из фиксанала. Ампула фиксанала содержит навеску , при растворении которой в мерной колбе на два литра получается 0,05 н. раствор соли. Затем аликвоту раствора MgSO4 титруют раствором трилона Б в присутствии аммиачного буфера и индикатора хромогена черного от вишнево-красной окраски до синей. По нормальности и по объемам пипетки и по бюретке рассчитывают точную нормальность рабочего раствора трилона Б.
Лабораторная работа №2
Определение общей жесткости воды
Заполнить бюретку раствором трилона Б известной нормальности.
В две колбы для титрования на 250 мл отмесить пипеткой на 50,00 мл (V пип.) водопроводной воды, колбу для титрования ополоснуть дистиллированной водой, а пипетку ополоснуть только водопроводной водой.
В каждую колбу мензуркой отмерить по 15 мл аммиачнойбуферной смеси, а затем ложечкой положить хромоген черный до винно-красной окраски.
Каждую колбу оттитровать трилоном Б до получения чисто синей окраски от одной капли трилона Б (в конце титровать медленно, перемешивая каждую каплю).
Записать объемы по бюретке (V1 и V2), рассчитать среднее значение (V cpед).
Рассчитать общую жесткость воды (ж.в.) по формуле:
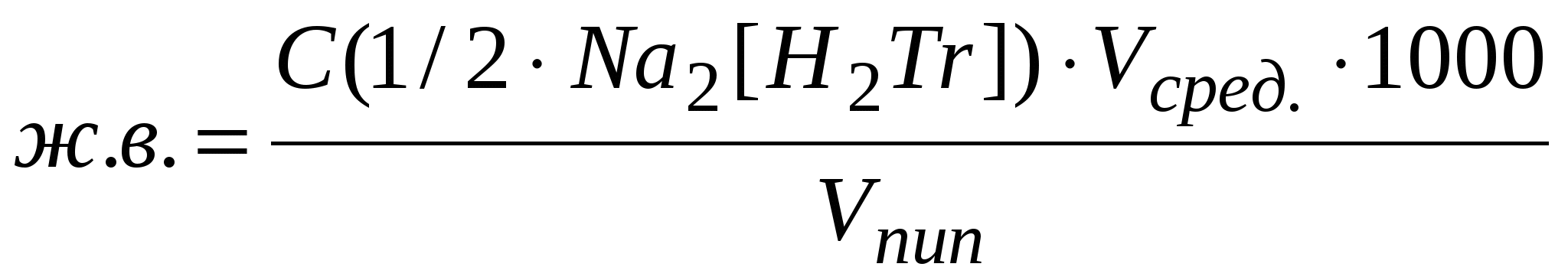 , (мг-экв/л) , (мг-экв/л)
Лабораторная работа №3
Определение миллиграммового содержания ионов кальция и магния при совместном присутствии
Заполнить бюретку раствором трилона Б известной концентрации.
В мерную колбу на 100,00 мл получить неизвестный объем раствора смеси солей кальция и магния, довести до метки дистиллированной водой, перемешать.
В две колбы для титрования: а) пипеткой отмерить аликвоты исследуемого раствора (V пип.); б) мензуркой прилить приблизительно по 10 мл аммиачной буферной смеси; в) насыпать ложечкой индикатор хромоген черный до винно-красной окраски.
Оттитровать каждую колбу трилоном Б до перехода окраски от винно-красной в чисто синюю (каждый раз заполнять бюретку до нуля)
Записать объемы трилона Б (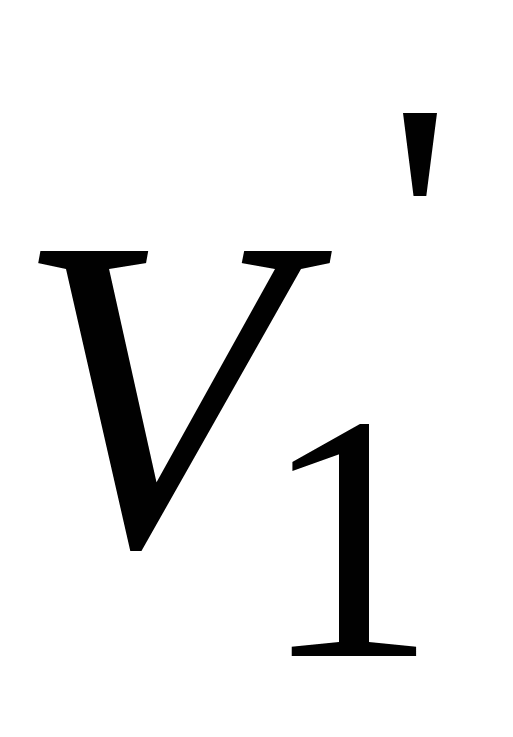 и и 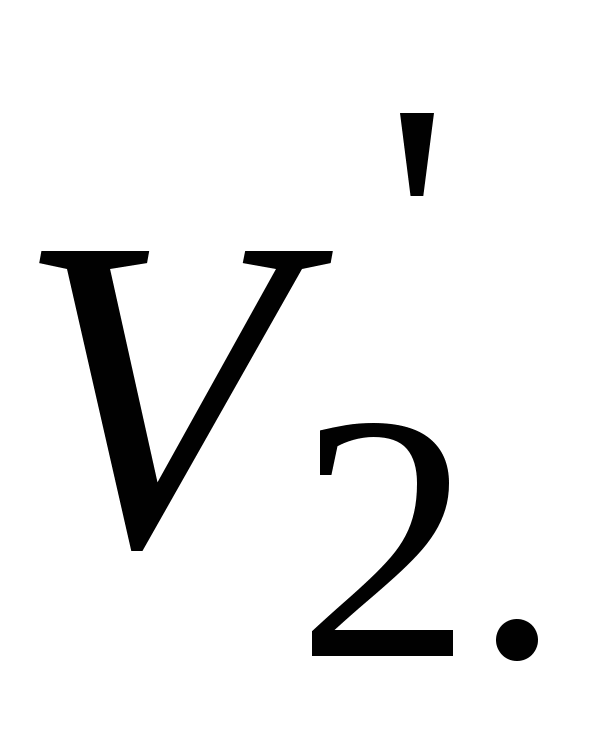 ) и рассчитать средний объем ( ) и рассчитать средний объем (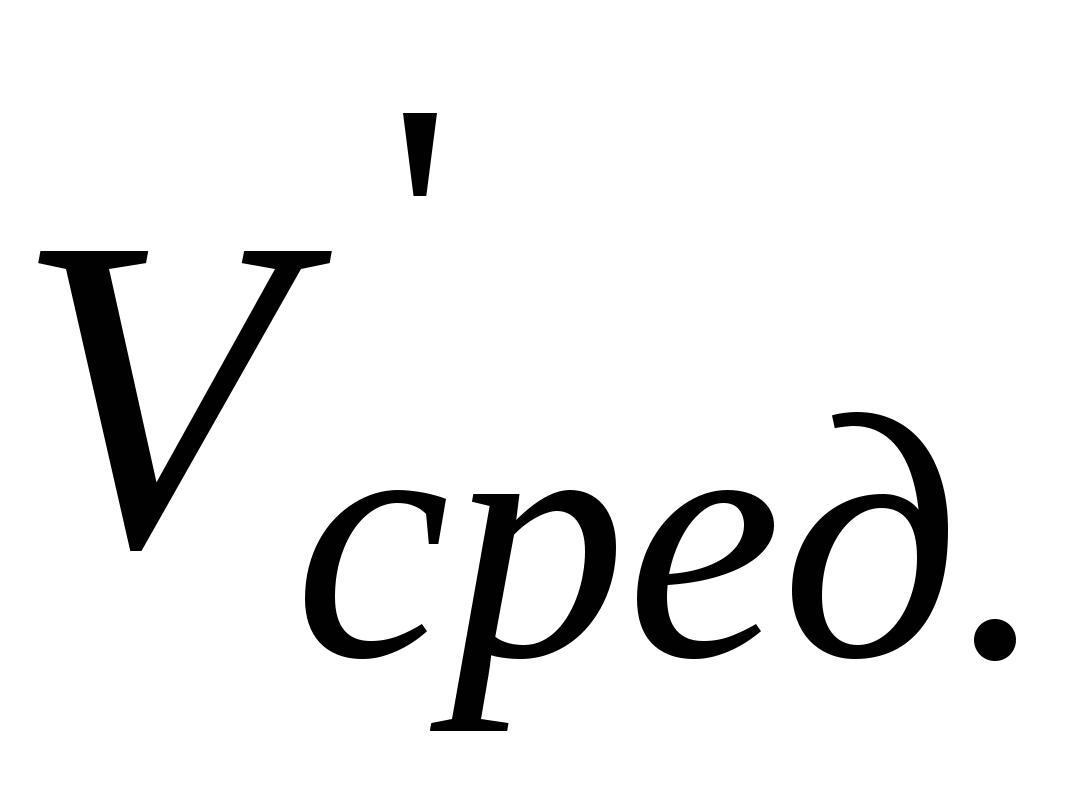 ). ). 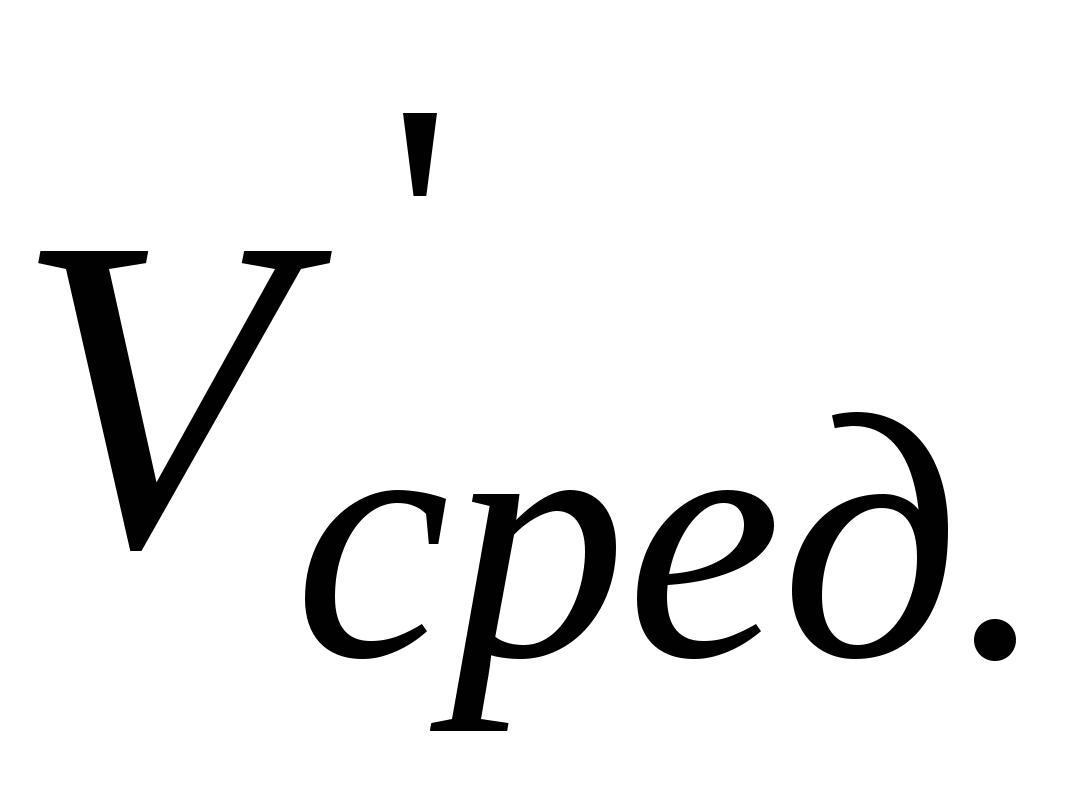 - объем трилона Б, пошедший на титрование ионов кальция и магния вместе. - объем трилона Б, пошедший на титрование ионов кальция и магния вместе.
Снова той же пипеткой отмерить в две колбы для титрования аликвоты исследуемого раствора, в каждую колбу прилить мензуркой по 10 мл 1 М раствора NaOH и ложечкой насыпать индикатор мурексид до малинового цвета.
Оттитровать каждую колбу (от нулевой отметки на бюретке) раствором трилона Б до получения сиреневой окраски.
Записать объемы по бюретке (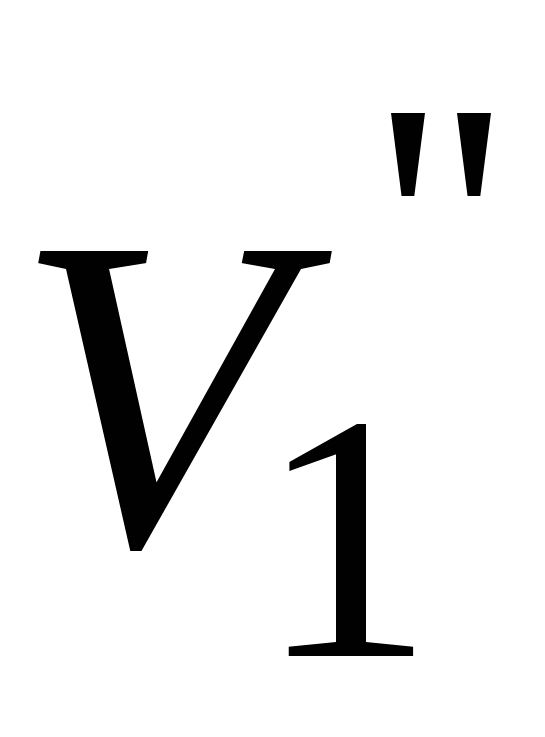 и и 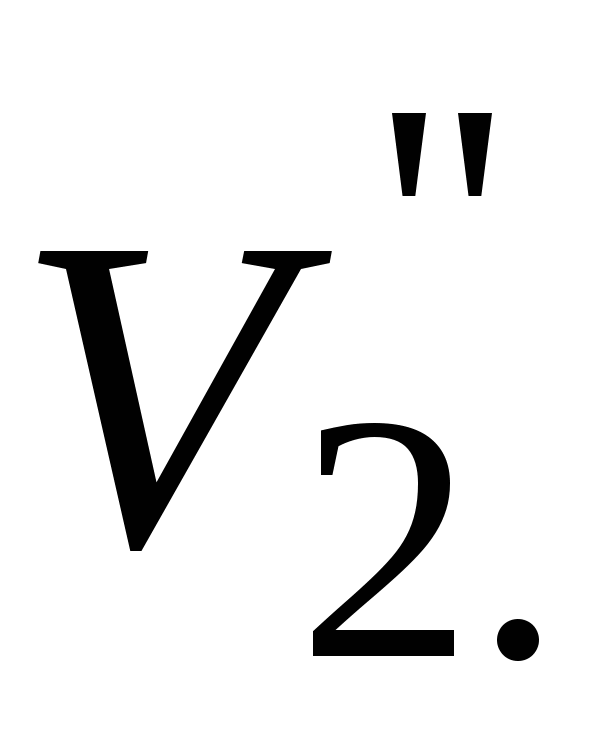 ), рассчитать среднее значение ( ), рассчитать среднее значение (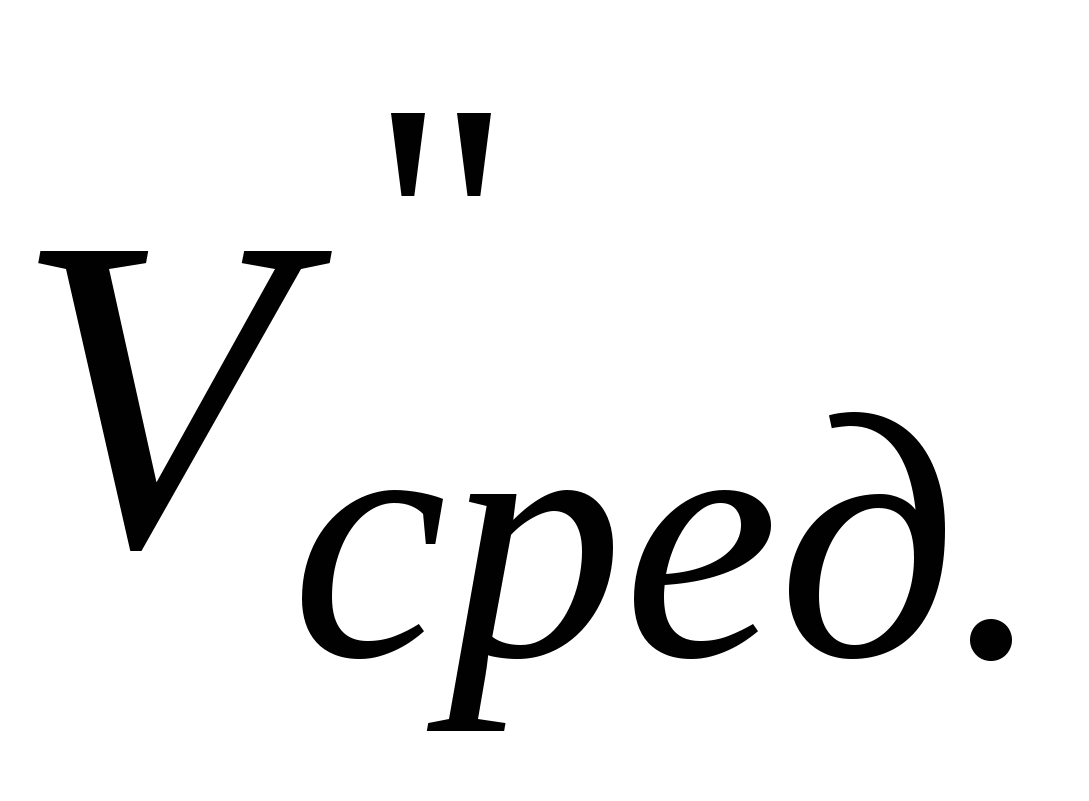 ). ). 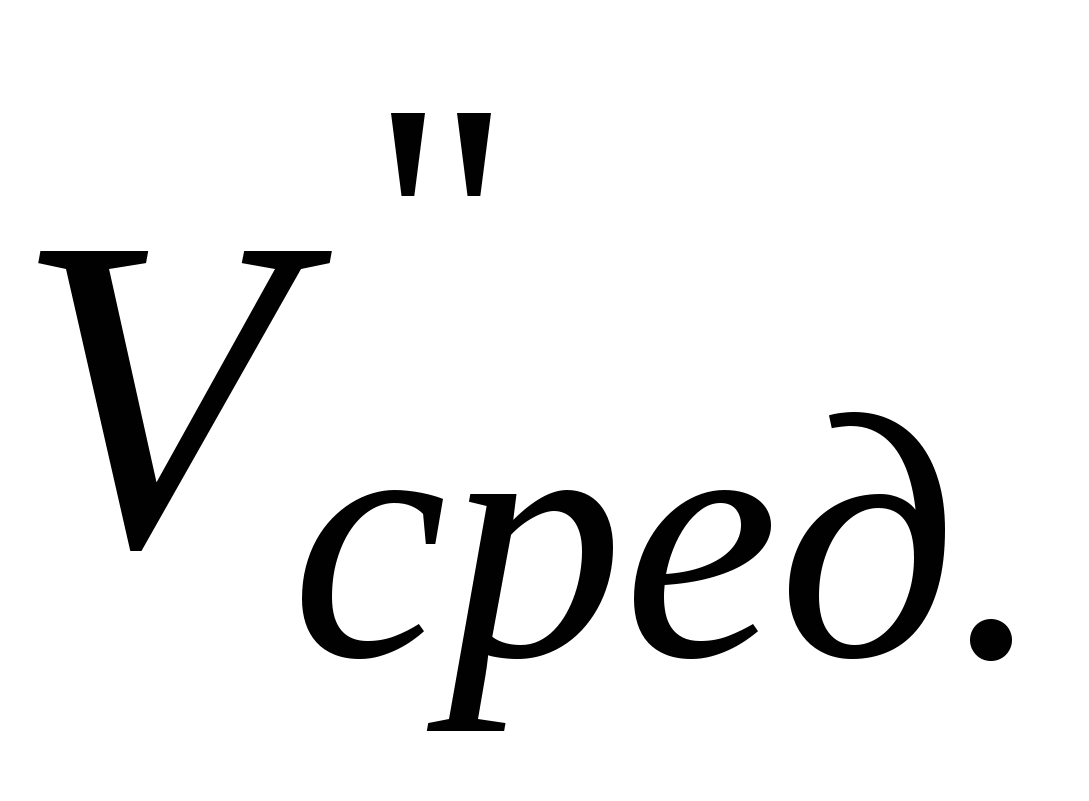 - объем трилона Б, пошедшего на титрование иона кальция. - объем трилона Б, пошедшего на титрование иона кальция.
Рассчитать объем трилона Б, пошедшего на титрование иона магния:
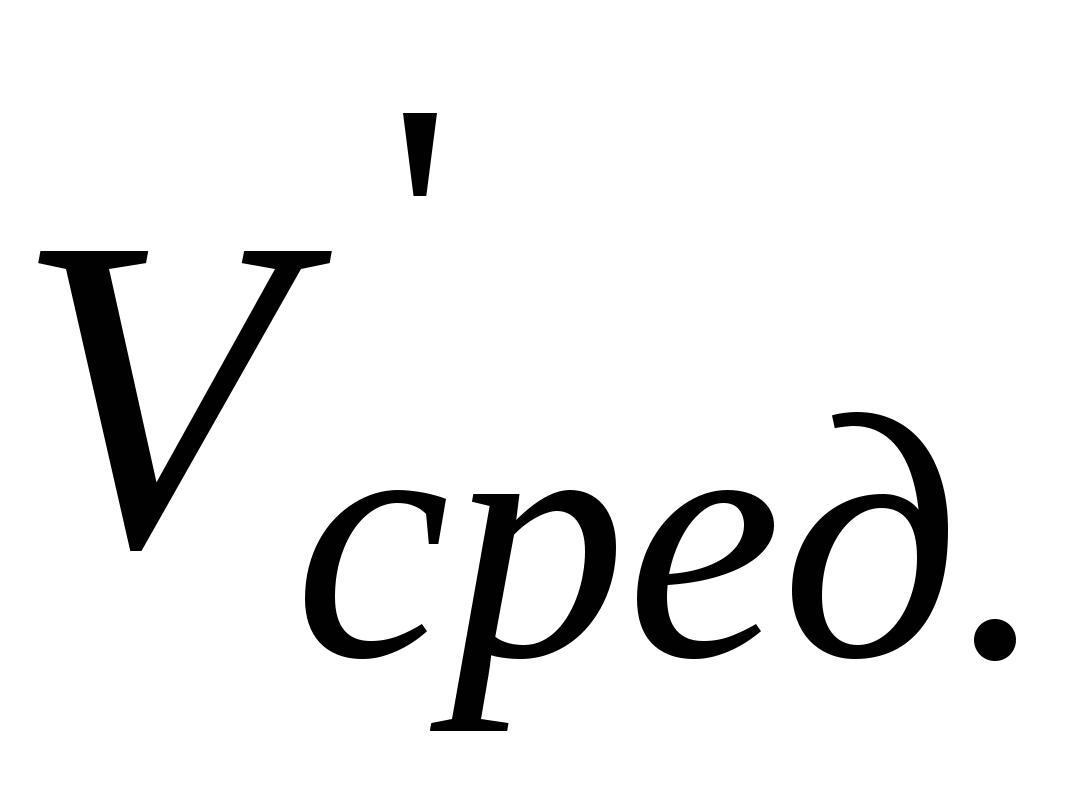 - -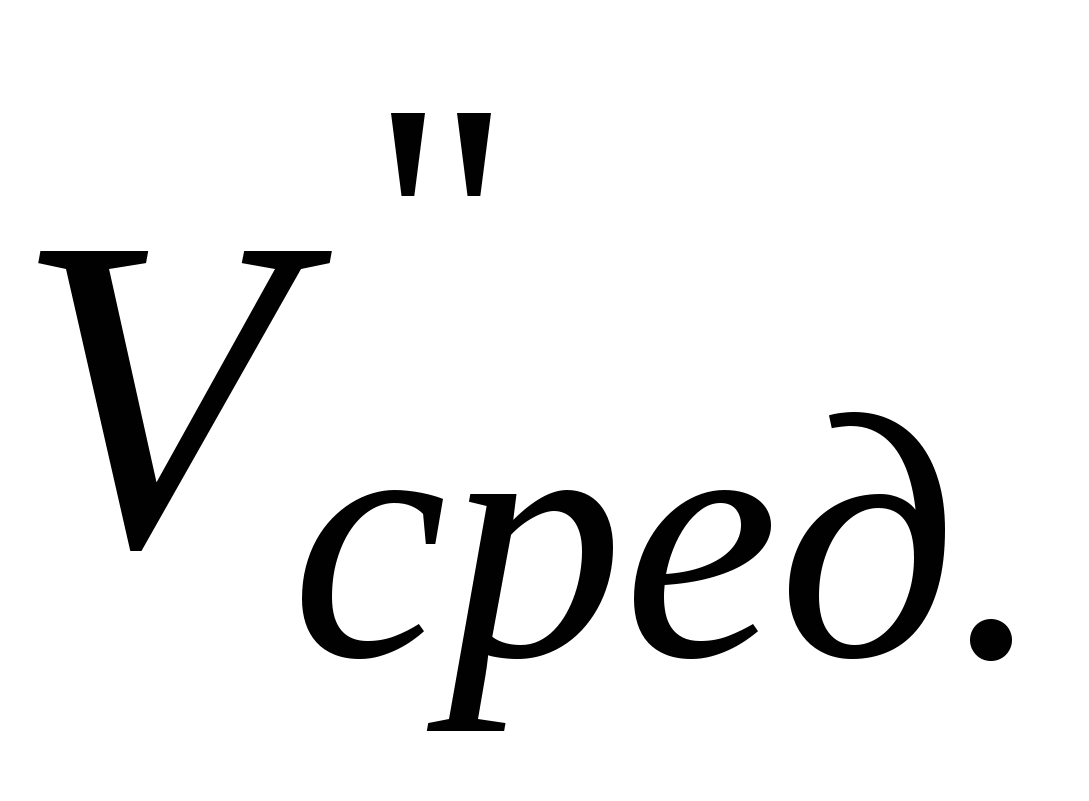 = =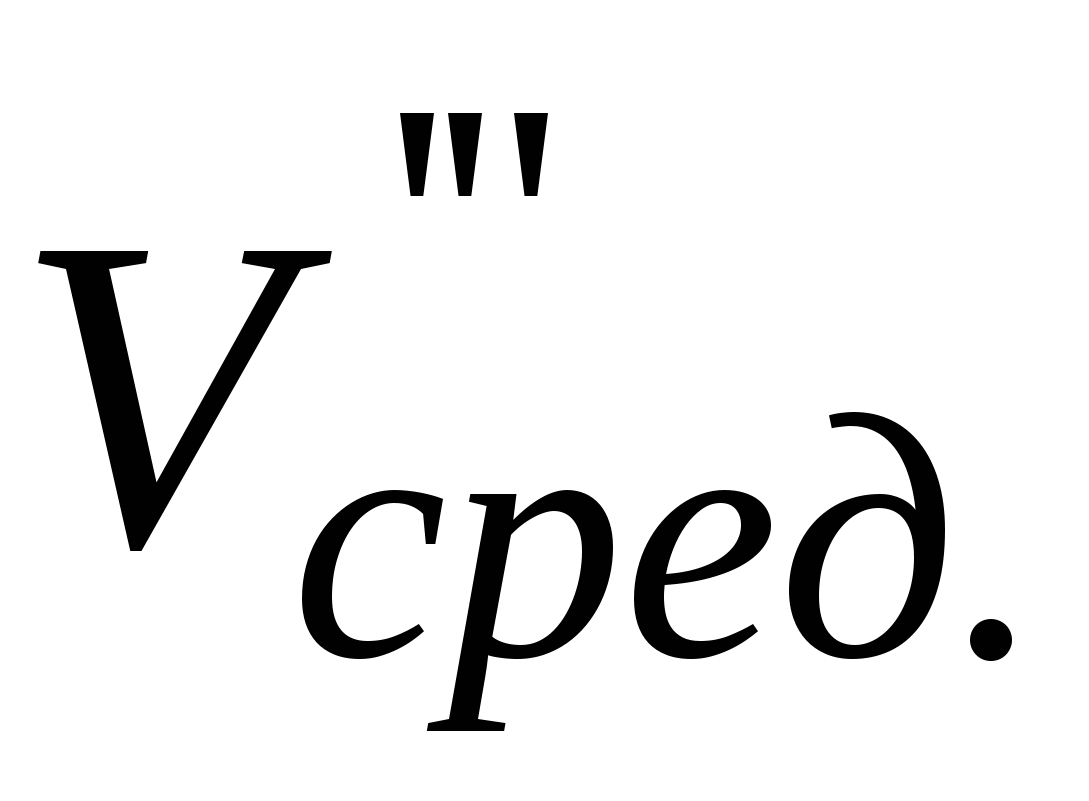
Рассчитать массу Mg2+ (мг) в объеме мерной колбы:
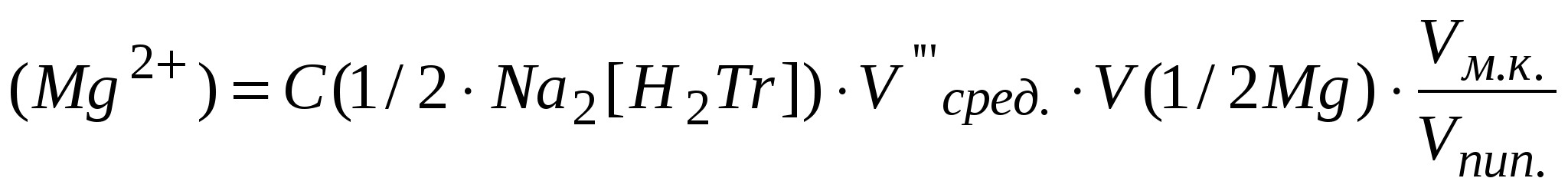 , мг , мг
Рассчитать массу Са2+ (мг) в объеме мерной колбы (Vм.к.):
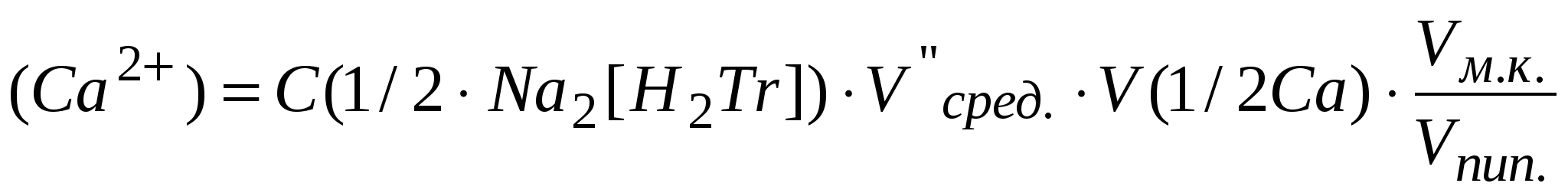 , мг , мг
Получить правильные ответы у преподавателя и рассчитать относительную ошибку определения для Са2+ и Mg2+ отдельно. Составить подробный отчет.
Лабораторная работа №4
Определение миллиграммового содержания иона кобальта в неизвестном
объеме
Заполнить бюретку раствором трилона Б известной нормальности.
В мерную колбу на 100,00 мл получить контрольный объем соли кобальта (V м.к.), довести до метки дистиллированной водой, перемешать.
В две колбы для титрования: а) пипеткой отмерить аликвоты исследуемого раствора (V пип.); б) прилить цилиндром по 60 мл дистиллированной воды (для ослабления собственной розовой окраски соли кобальта); в) мензуркой прилить по 20 мл аммиачной буферной смеси; г) ложечкой добавить индикатор мурексид до желтого цвета.
Оттитровать растворы в каждой колбе трилоном Б так, чтобы окраска индикатора изменилась от желтой до малиновой (около точки эквивалентности титровать медленно).
Записать объемы по бюретке (V1 и V2) и найти среднее арифметическое:
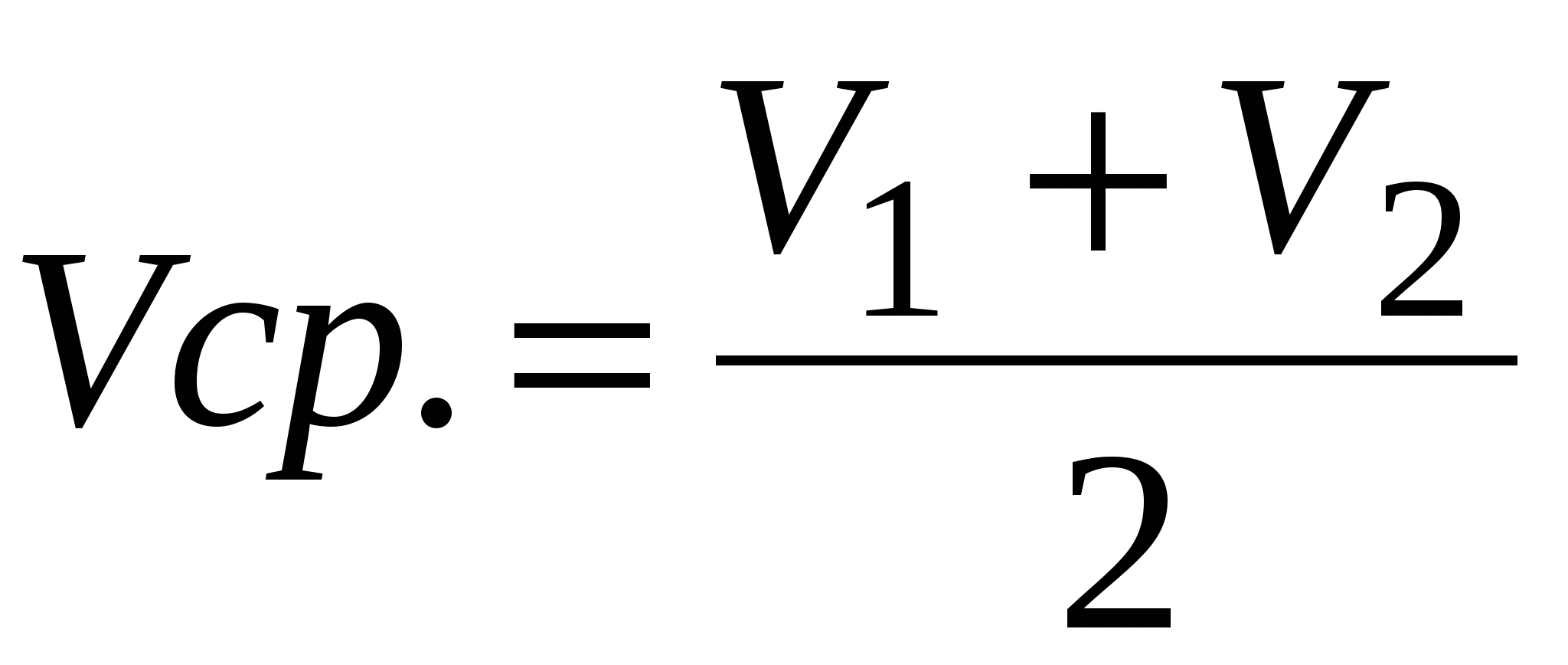
Рассчитать массу иона кобальта в мг в объеме мерной колбы:
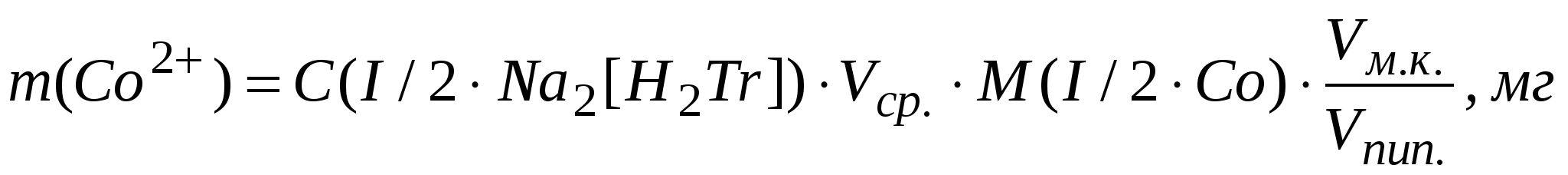
Рассчитать относительную ошибку определения.
Составить отчет.
Лабораторная работа № 5
Определение миллиграммового содержания
Ni2+ в неизвестном объеме
Заполнить бюретку раствором трилона Б известной концентрации.
В мерную колбу на 100,00 мл получить контрольный объем соли никеля (Vм.к.), довести до метки дистиллированной водой, перемешать.
В две колбы для титрования: а) пипеткой отмерить аликвоты исследуемого раствора (Vпип.); б) прилить цилиндром по 60÷70 мл дистиллированной воды для ослабления собственной зеленой окраски соли никеля; в) отмерить мензуркой по 10 мл 10%-ного раствора аммиака; г) насыпать ложечкой индикатор мурексид. Цвет раствора в колбе – желтый.
Оттитровать каждую колбу трилоном Б от желтой окраски до фиолетовой.
Записать объемы по бюретке V1 и V2 и рассчитать средний объем Vср..
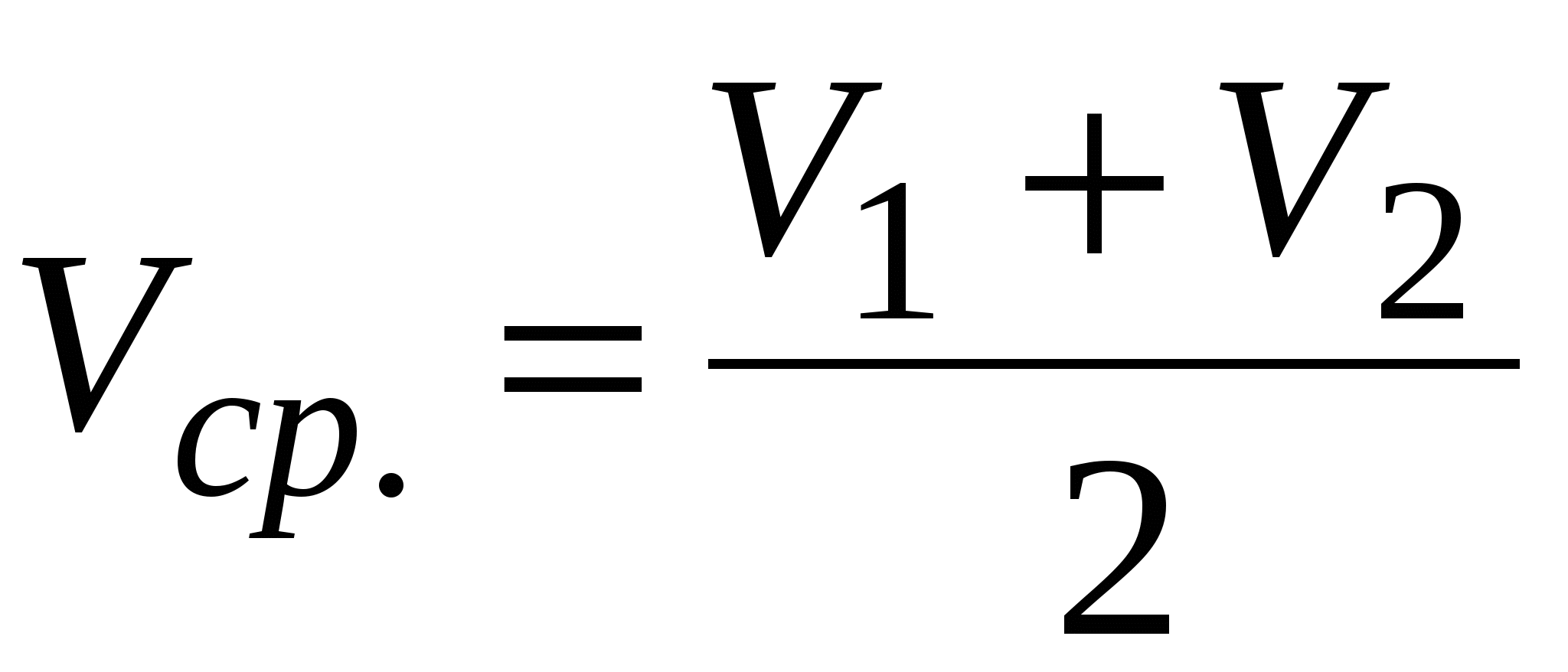
Рассчитать массу никеля (Ni2+) (мг) в объеме мерной колбы:
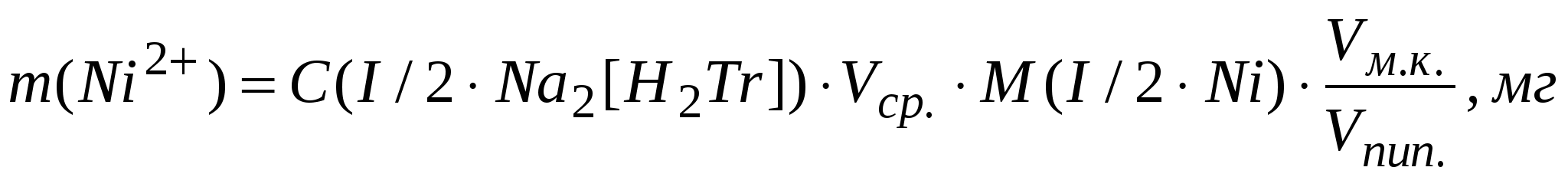
Получить правильный ответ у преподавателя и рассчитать относительную ошибку определения. Составить отчет.
Техника безопасности
Раствор аммиака не вдыхать полной грудью, помнить, что аммиак – нервный яд. Приливать раствор аммиака под вытяжным шкафом. В случае отравления пить слабый раствор уксусной кислоты или лимонный сок. Вызвать рвоту. Принять растительное масло или яичный белок.
3.2. Задачи и примеры решений.
Определение результатов,
комплексонометрических определений
Расчёты результатов этих анализов не отличаются от применяемых во всех объёмных методах. Фактор эквивалентности – Z – для всех ионов металлов в этом методе равен двум.
Пример: Для трилонометрического определения кальция и магния 2,0850 г минерала после определенной обработки растворили в колбе на 250,00 мл. Из этого раствора в две колбы для титрования взяли две аликвоты 25,00 мл и 100,00 мл. На титрование первой пошло 11,20мл 0,05240 н раствора трилона Б. На титрование второй (после отделения кальция) израсходовали 21,65 мл трилона Б. Сколько процентов кальция и магния в образце?
Решение: Эквивалентные массы кальция и магния равны 20,04 и 12,15 г/моль соответственно.
Найдем количество магния и %.
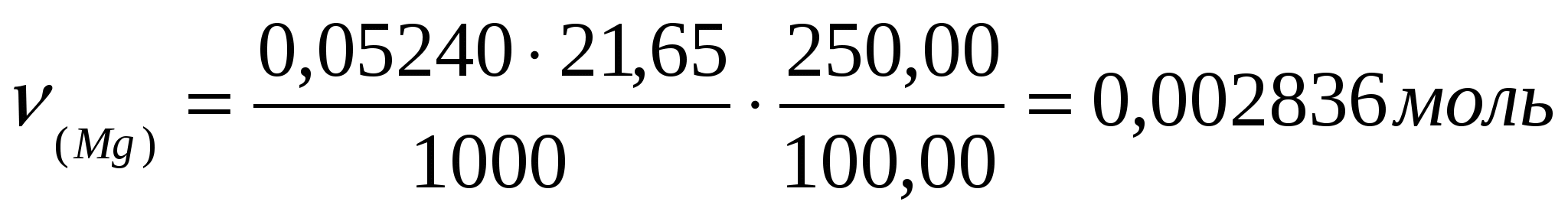 ; ;
 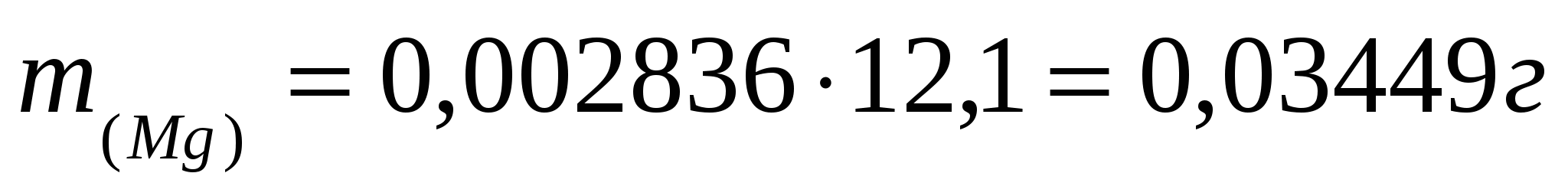 ; ;
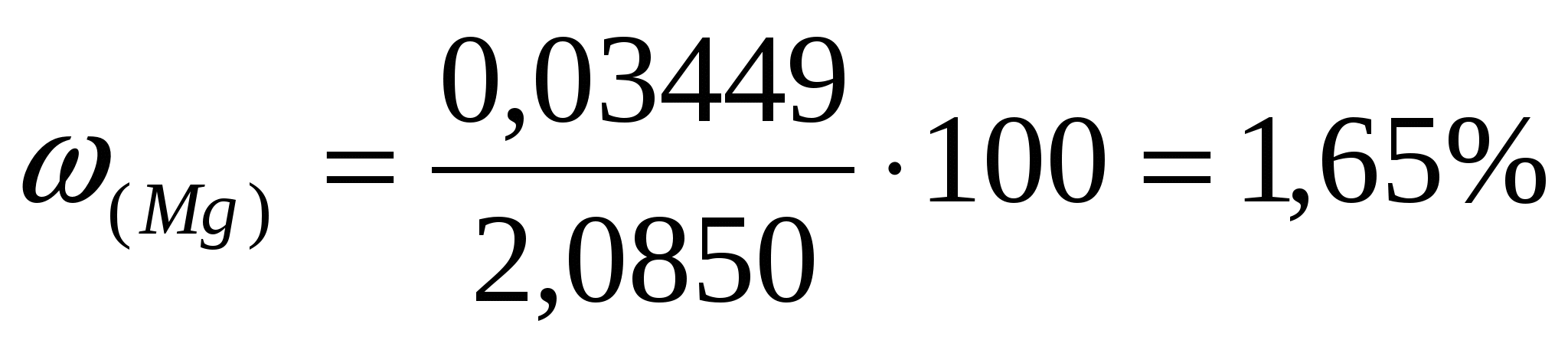 . .
Найдём количество кальция и магния:
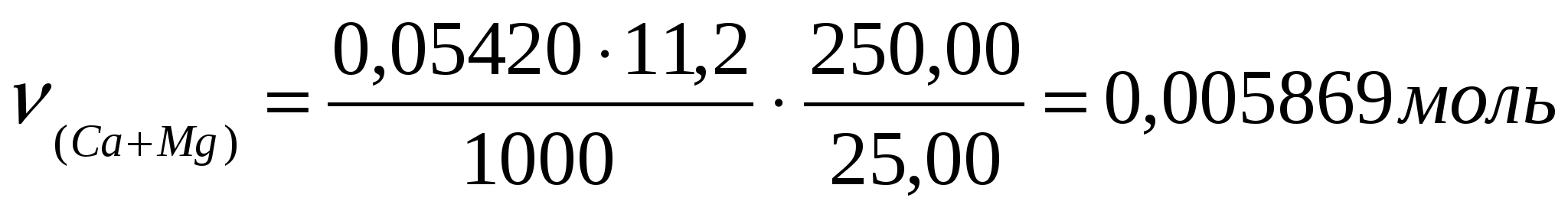 ; ;
Найдём количество кальция и ω%.
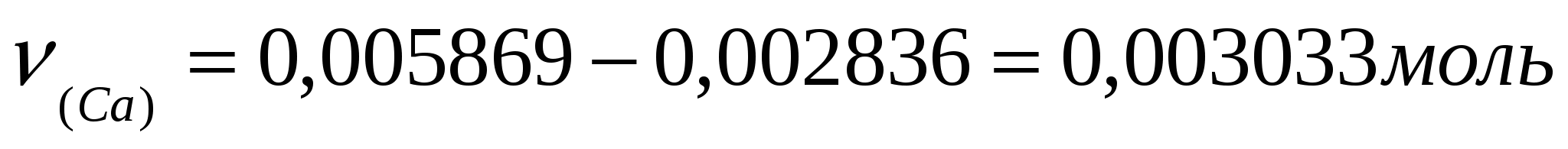 ; ;
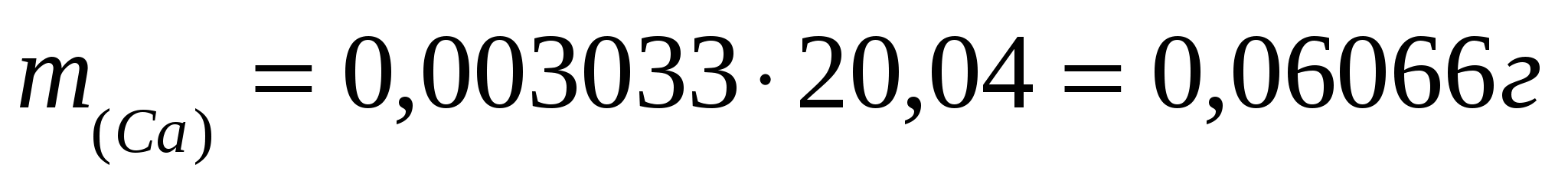 ; ;
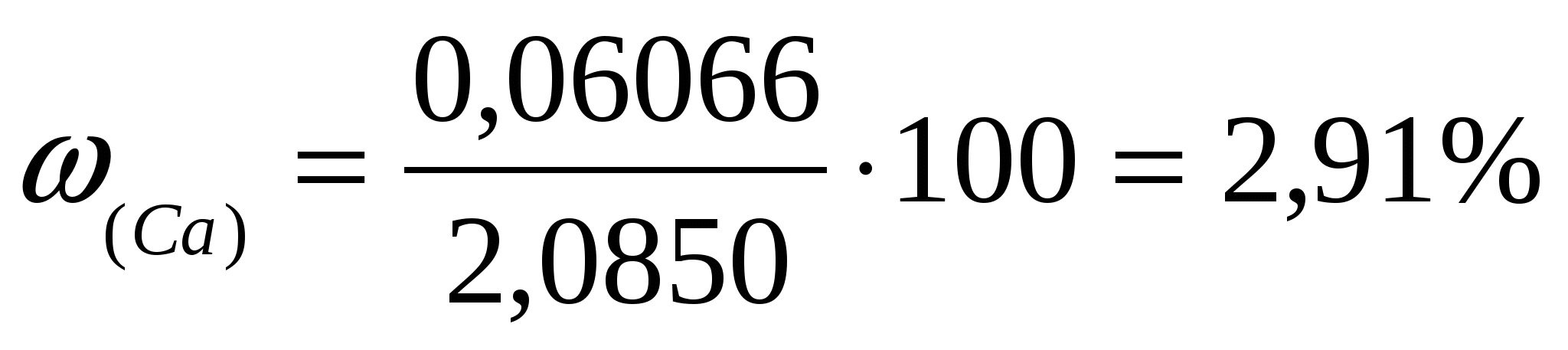 . .
Ответ: 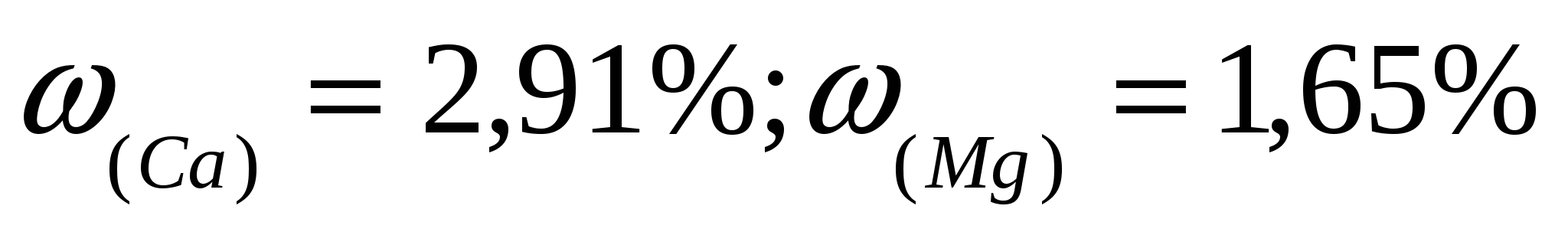 . .
Анализируемый объект содержит K2CO3, Na2CO3 и SiO2. Навеску 0,1250 г обработали соляной кислотой, отфильтровали и промыли, фильтрат выпарили и получили 0,1282 г смеси KCl и NaCl. На титрование смеси хлоридов потребовалось 19,70 мл 0,1003 М раствора AgNO3. Рассчитать массовую долю каждого из компонентов в анализируемом объекте.
Навеску 2,1500 г образца технического бромфенола (C6H5OBr) подвергли омылению в спиртовом растворе KOH , в результате чего выделилось эквивалентное количество KBr. Полученный раствор нейтрализовали, довели объём до 200,00 мл , затем отобрали 20,00 мл и на его титрование в присутствии роданидного комплекса железа (Ш) (индикатор) затратили 22,86 мл 0,05100 н. раствора Hg2(NO3)2. На титрование индикатора в «холостой пробе» затратили 0,52 мл того же стандартного раствора. Вычислить массовую долю бромфенола в образце.
Навеску 1,8230 г кристаллогидрата нитрата алюминия растворили и разбавили водой в мерной колбе вместимостью 100,00 мл. К аликвоте 10,00 мл этого раствора добавили избыток комплексона магния. Среднее значение объёма 0,02503 М раствора комплексона Ш, пошедшего на титрование выделившихся ионов магния, составило 18,55 мл. Вычислить массовую долю нитрата алюминия в кристаллогидрате.
Для определения свободного цианида калия отобрали 2,00 мл электролита золочения и добавили к нему 10,00 мл 0,0102 M раствора NiSo4 и аммонийный буферный раствор. При этом цианид-ионы были связаны в виде комплекса [Ni(CN)4]2-. На титрование остатка сульфата никеля затрачено 4,46 мл 0,0105 М раствора комплексона Ш. Вычислить массовую концентрацию цианида калия в электролите.
1,00 л сточной воды, содержащей никель, выпарили досуха и после отделения мешающих примесей получили осадок диметилглиоксимата никеля. Промытый осадок растворили, добавили 10,00 мл 0,0100 М раствора комплексона III, на титрование избытка которого затратили 3,05 мл 0,0100 М раствора соли магния. Вычислить массовую концентрацию никеля (мг/л) в сточной воде.
Какую массу силиката, содержащего около 20% Al2O3, следует взять для анализа, чтобы после сплавления, соответствующей обработки пробы и добавления избытка Na2[Mg ЭДТА] алюминий был оттитрован 10,00 мл 0,1 М ЭДТА?
Рассчитайте массу смеси, содержащей 45,00 % KBr, 48,00% NaBr и 7,00% индифферентных примесей, чтобы при меркуриметрическом титровании её было израсходовано 21,25 мл 0,04966 н. Hg(NO3)2 (f экв=1/2).
Какая масса ртути содержалось в 250,0 мл раствора, если после прибавления к 50,00 мл его 25,00 мл 0,01000 М ЭДТА избыток последнего оттитровали 10,50 мл 0,01000 М MgSO4?
Раствор солей кальция и магния разбавили водой до 100,00 мл. На титрование 20,00 мл аликвоты с эриохром черным Т израсходовали 18,45 мл 0,01020 М ЭДТА, а на титрование такой же аликвоты с мурексидом затратили 8,22 мл ЭДТА. Какая масса Ca и Mg содержалась в исходном растворе?
Какая масса KCN содержалась в 500,0 мл раствора, если на титрование 20,00 мл его до появления неисчезающей мути затрачено 20,05 мл 0,1215 М AgNO3? Учесть образование в точке эквивалентности комплекса [Ag(CN)2]-, в соответствии с этим принять для молярной массы эквивалента M (2KCN).
На титрование 20,00 мл раствора NiCl2 израсходовано 21,22 мл 0,02065 М ЭДТА. Определить концентрацию (г/л) раствора соли никеля.
Определить концентрацию (г/л) раствора Bi(NO3)3, если на титрование 20,00 мл его израсходовано 17,26 мл 0,06905 М ЭДТА.
На титрование 20,00 мл раствора Hg(NO3)2 после добавления избытка Na2[Mg ЭДТА] и протекания реакции замещения
[MgЭДТА]2-+Hg2+=[HgЭДТА]2-+Mg2+
затрачено 19,85 мл 0,05 М ЭДТА (К=1,055). Вычислить концентрацию (г/л) исследуемого раствора Hg(NO3)2.
На титрование 25,00 мл раствора Ba(NO3)2 в присутствии Na2[MgЭДТА] затратили 18,05 мл 0,1 М ЭДТА (К=0,9878). Вычислить концентрацию (г/л) раствора Ba(NO3)2
Какая масса натрия содержалась во взятой пробе раствора, если после осаждения его в виде NaZn(UO2)3(CH3COO)9ּ6H2O полученный осадок отделили, растворили и оттитровали цинк 20,85 мл 0,01 М ЭДТА (к=0,9194)?
При определении железа в сточной воде объемом 200,00 мл его окислили до трехвалентного, осадили аммиаком, отделили от раствора и после растворения в HCl оттитровали 5,14 мл 0,005 М ЭДТА (К=1,101). Найти общую концентрацию (мг/л) железа в воде.
Стандартный раствор хлорида магния приготовили растворением 0,1065 г чистого оксида магния в соляной кислоте, раствор разбавили и довели водой до 250,00 мл в мерной колбе. Пробу приготовленного раствора объёмом 20,00 мл использовали для стандартизации раствора ЭДТА и титровали при рН 10,0. На титрование израсходовали 19,75 мл раствора ЭДТА. Вычислить концентрацию (моль/л) раствора ЭДТА.
К 10,00 мл раствора NiCl2 добавили дистиллированную воду, аммиачный буферный раствор и 20,00 мл 0,01085 М раствора ЭДТА. Избыток ЭДТА оттитровали 0,01292 М MgCl2, на титрование израсходовали 5,47 мл. Рассчитать исходную концентрацию (г/л) раствора NiCl2.
При анализе пробы производственных сточных вод объёмом 100,00 мл сульфат-ионы осадили раствором хлорида бария, осадок сульфата бария отфильтровали, промыли и растворили в 30,00 мл 0,025 М ЭДТА (K=1,001). Избыток ЭДТА оттитровали 15,00 мл 0,025 М хлорида магния (К=0,9987). Определить концентрацию SO42—ионов (мг/л).
Для определения содержания сульфат-ионов в воде минерального источника к 150,00 мл её прибавили 25,00 мл 0,1115 М BaCl2. Не фильтруя осадок BaSO4, добавили к смеси аммонийный буфер, содержащий комплексонат магния, и оттитровали 14,00 мл 0,01242 М ЭДТА. Вычислить концентрацию сульфат-ионов (мг/л).
При определении карбонатной жесткости на титрование 200,0 мл воды израсходовано 10,25 мл 0,1 М HCl (К=0,9845). При определении общей жесткости на 100,00 мл той же воды израсходовано 15,12 мл 0,05 М ЭДТА (К=0,8918). Вычислить карбонатную, общую и постоянную жесткость воды (ммоль/л), принимая молярную массу эквивалента Мe2+ равной М(1/2 Мe2+).
Вычислить массовую долю (%) брома в техническом бромиде натрия, если на титрование раствора, полученного из навески массой 0,5569 г его, израсходовано 21,20 мл 0,2500 н. Hg(NO3)2. Сравнить с теоретическим.
Для определения хлоридов навеску кальцинированной соды массой 1,652 г растворили в воде и объём довели до 100,00 мл. На титрование пробы 20,00 мл полученного раствора после нейтрализации азотной кислотой затратили 18,38 мл 0,01 н. Hg(NO3)2 (fэкв=1/2) (К=1,075). Вычислить массовую долю (%) хлоридов в пересчёте на NaCl в исследуемом образце.
Из навески BaCl2 2H2O массой 1,099 г приготовили 100,00 мл раствора, к 20,00 мл которого добавили Na2[Mg ЭДТА]. На титрование образовавшейся смеси затрачено 17,65 мл 0,05085 М ЭДТА. Вычислить массовую долю (%) BaCl2 в образце, полагая, что при титровании бария в присутствии магния n(Ba)=n(ЭДТА). Сравнить рассчитанное значение с теоретическим для BaCl22H2O.
Для определения суммы лантаноидов в фосфоросодержащем материале взяли навеску массой 0,2043 г. После растворения её и отделения мешающих ионов раствор оттитровали из микробюретки 1,82 мл 0,01078 М ЭДТА с ксиленоловым оранжевым. Рассчитать массовую долю (%) суммы лантаноидов в пробе в пересчёте на лантан.
Какая массовая доля (%) свинца в тройном сплаве Pb-Na-K, если навеску его массой 2,8850 г растворили и раствор разбавили до 250,00 мл, а затем 25,00 мл этого раствора оттитровали 12,28 мл 0,1 М ЭДТА (К=1,086) с ксиленоловым оранжевым?
Растворением навески Hg(NO3)2nH2O массой 0,7634 г приготовили 250,00 мл раствора, к 25,00 мл которого прибавили 50,00 мл 0,01007 М ЭДТА. На титрование избытка ЭДТА израсходовали 23,83 мл 0,01178 М ZnSO4. Вычислить массовую долю (%) Hg(NO3)2 в образце, определить число молекул воды в кристаллогидрате.
Навеску удобрения массой 2,5030 г обработали минеральной кислотой и объём полученного раствора довели до 250,00 мл, осадок отфильтровали; 50,00 мл фильтрата поместили в мерную колбу вместимостью 100,00 мл, туда же добавили 25,00 мл 0,1 Bi(NO3)3 (K=0,9789) и довели раствор до метки. В результате взаимодействия ортофосфорной кислоты с Bi(NO3)3 образовался осадок BiPO4 в соответствии с реакцией
Bi(NO3)3+H3PO4=BiPO4+3HNO3,
который вновь отделили фильтрованием. В 50,00 мл фильтрата оттитровали избыток ионов Bi3+ 15,00 мл 0,05 М ЭДТА (К=1,001) в присутствии пирокатехинового фиолетового. Определить массовую долю (%) P2O5 в удобрении.
Вычислить массовую долю (%) CaCO3 и MgCO3 в известняке, если после растворения 1,000 г его получили 100,00 мл раствора, на титрование 20,00 мл которого для определения суммы Ca и Mg затратили 19,25 мл 0,5140 М ЭДТА, а на титрование Ca в отдельной пробе (20,00 мл) израсходовали 6,25 мл того же раствора ЭДТА
В процессе анализа каолина навеску его массой 0,5108 г сплавили с Na2CO3 и Na2B4O7, сплав растворили в разбавленной HCl и объём раствора довели до 250,00 мл. Пробу 100,0 мл раствора нейтрализовали, добавили уротропин, отфильтровали выпавшую в осадок кремниевую кислоту, промыли теплым раствором уротропина; фильтрат и промывные воды оттитровали 10,16 мл 0,005040 М ЭДТА с индигокармином в присутствии 20%-ного KOH. Вычислить массовую долю (%) CaO в каолине.
Раствор, полученный из навески феррита состава Fe2O3-BaO массой 0,3822 г, пропустили для отделения железа через колонку с анионитом. Полученный раствор нейтрализовали до рН 10,0, ввели 25,00 мл 0,025 М ЭДТА (К=1,096) с индикатором эриохром черным Т, затрачивая 20,92 мл. Вычислить массовые доли (%) оксидов в феррите.
Раствор, приготовленный из навески феррита состава Fe2O3-NiO-CoO массой 0,6018 г, пропустили через сильноосновный анионит и применили для разделения элементов следующие элементы: в 9 М HCl на анионите удерживаются соединения железа и кобальта, а в 4 М HCl происходит вымывание кобальта, а в 1 М HCl - вымывание железа. В результате разделения получены растворы ионов, которые были оттитрованы комплексонометрически. При этом на титрование никеля было затрачено 19,53 мл 0,05 М ЭДТА (К=1,102), на титрование кобальта - 4,81 мл 0,01 М ЭДТА (К=0,9906). Определить массовые доли (%) оксидов в феррите.
Вычислить объем пробы, который надо взять на анализ из раствора, содержащего 0,67 г/л свободного комплексона III и некоторое количество его комплексов с железом, если на титрование этой пробы в присутствии кcиленолового оранжевого при рН 1,0 будет затрачено 20,00 мл 0,01 М Bi(NO3)3.
Навеску медицинского препарата, содержащего хинингидрохлорид массой 0,5200 г, после растворения разбавили водой до 50,00 мл. Из пробы 20,00 мл раствора в ацетоно-бензольной среде осадили Cu(C20H24N2O2)Cl2(CH3COCH3)x. Осадок отфильтровали, растворили в аммиаке и оттитровали медь 0,05000 М ЭДТА в присутствии мурексида, израсходовав 10,75 мл. Вычислить массовую долю (%) хинина С20H24N2O2 (М=324,42 г/моль) в медицинском препарате.
Для определения содержания кофеина C8H10N4O2 (К=194,19 г/моль) в медицинском препарате навеску массой 0,4882 г растворили и довели объем до 50,00 мл. После отделения соответствующих компонентов отобрали пробу 20,00 мл, добавили 25,00 мл 0,02000 М K[biI4] и таким путем осадили кофеин по реакции 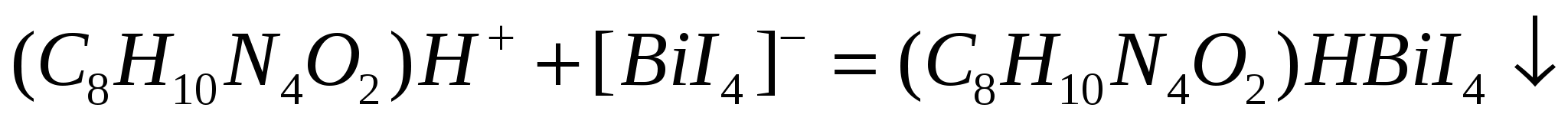
Осадок отфильтровали, фильтрат разбавили до 40,00 мл и в 20,00 мл его оттитровали избыток висмута 19,85 мл 0,01000 М ЭДТА до исчезновения желтой окраски K[BiI4]. Рассчитайте массовую долю (%) кофеина в препарате.
В процессе отмывки теплоэнергетического оборудования с помощью комплексонов получают растворы, содержащие комплексонаты железа и меди.
Пробу 50,00 мл такого раствора обработали концентрированной HNO3 при нагревании для разрушения комплексонатов металлов и комплексона, остаток разбавили в мерной колбе до объема 100,00 мл. В 25,00 мл разбавленного раствора железо осадили аммиаком, осадок гидроксида отделили, растворили в соляной кислоте и оттитровали ЭДТА с сульфосалициловой кислотой. Аммиачный фильтрат после отделения гидроксида железа собрали и оттитровали раствором ЭДТА с индикатором ПАР для определения содержания меди.
Результаты титрования железа и меди приведены в таблице.
Вариант
|
Титрование железа
|
Титрование меди
|
(ЭДТА), мл
|
С (ЭДТА), моль/л
|
(ЭДТА), мл
|
С (ЭДТА), моль/л
|
1
|
12,18
|
0,01021
|
16,11
|
0,01021
|
2
|
10,92
|
0,01095
|
14,15
|
0,01095
|
3
|
11,62
|
0,02516
|
15,81
|
0,02516
|
4
|
15,41
|
0,02498
|
19,14
|
0,02498
|
5
|
12,62
|
0,01203
|
16,17
|
0,05013
|
6
|
10,35
|
0,01142
|
15,26
|
0,05212
|
Вычислить концентрацию (г/л) железа и меди в исследуемом растворе.
Из навески карбонатной породы 0,5126 г после определенной обработки получили 250,00 мл раствора. На титрование 50,00 мл этого раствора пошло 20,42 мл 0,1012 н. раствора трилона Б. На титрование 100,00 мл того же раствора после отделения кальция расходуется 19,62мл того же трилона Б. Определить процентное содержание CaO и MgO в образце.
Из навески 2,0250 г доломита после обработки получили 500,00 мл раствора. На титрование 25,00 мл этого раствора расходуется 20,20 мл 0,1025 н. Раствора трилона Б. На 100,00 мл этого же раствора после отделения Ca2+ расходуется 38,50 мл того же рабочего раствора. Сколько процентов CaO и MgO в образце.
Определить концентрацию (г/л) раствора Bi(NO3)3 , если на титрование 20,00 мл его израсходовано 17,26 мл 0,06905 М трилона Б.
Навеску 2,885 г сплава Pb-Na-K растворили в 250,0 мл. 25,00 мл этого раствора оттитровали 12,28 мл 0,1086 М раствором трилона Б с ксиленоловым оранжевым. Сколько процентов свинца в сплаве?
|
 Скачать 1.33 Mb.
Скачать 1.33 Mb.

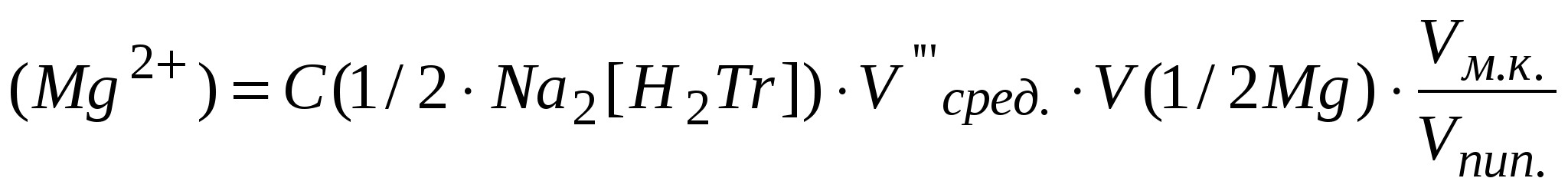 , мг
, мг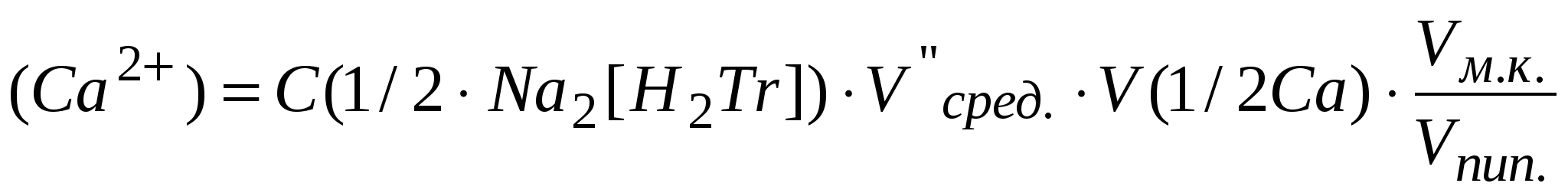 , мг
, мг
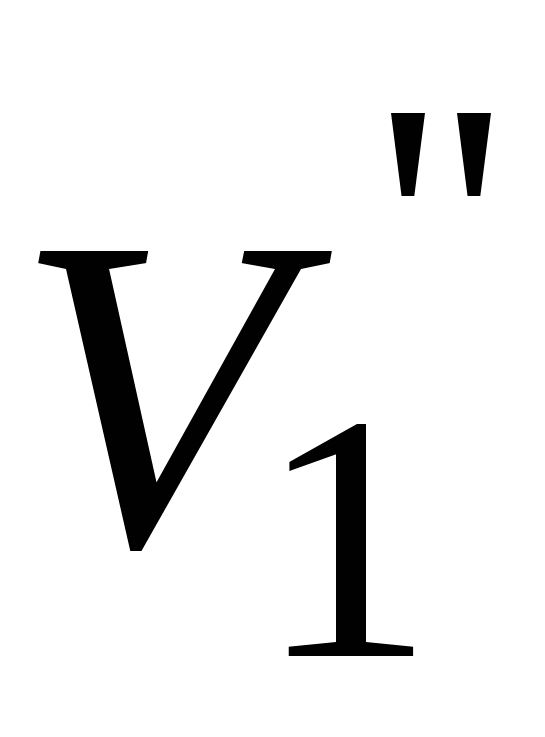 и
и 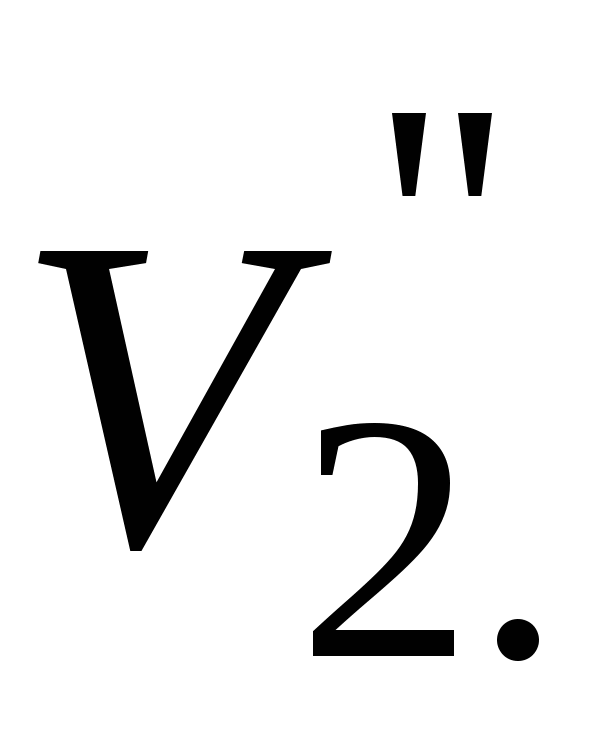 ), рассчитать среднее значение (
), рассчитать среднее значение (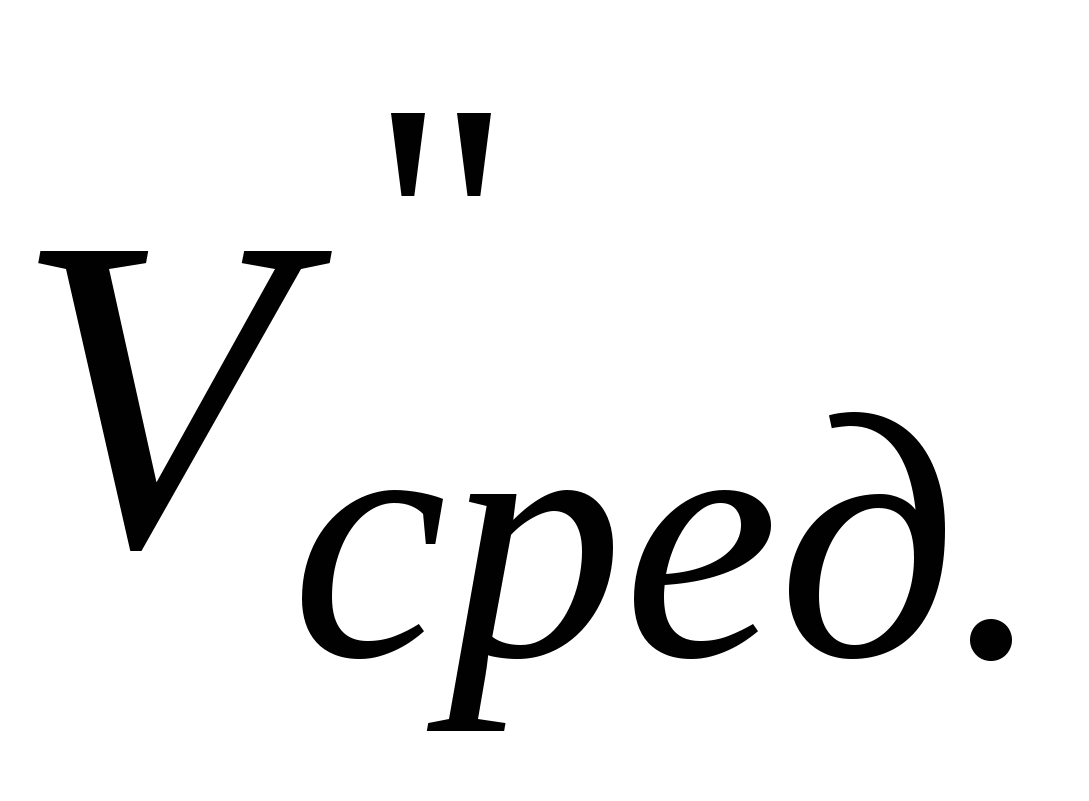 ).
).