В растворе в ТЭ присутствуют катионы Fe3+; Cr3+ и ионы водорода, а концентрации [Fe2+] и [Cr2O72-] ничтожны и неизвестны.
При равновесии 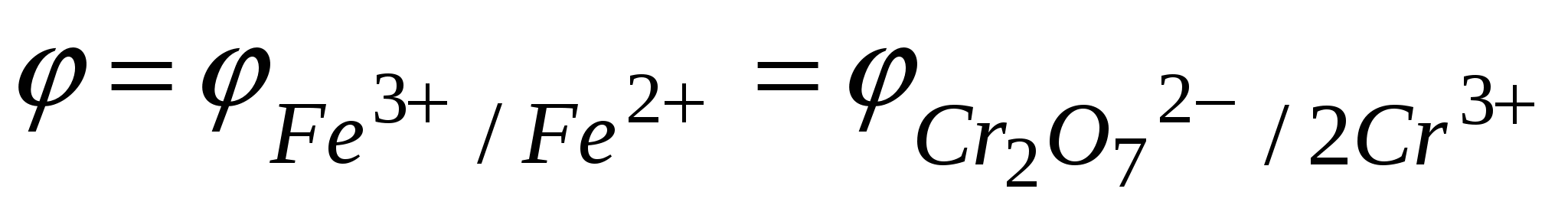 , ,
тогда 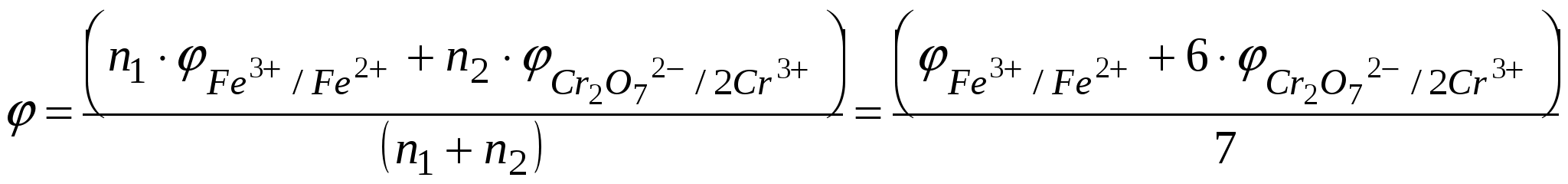 ; ;
из уравнения реакции: 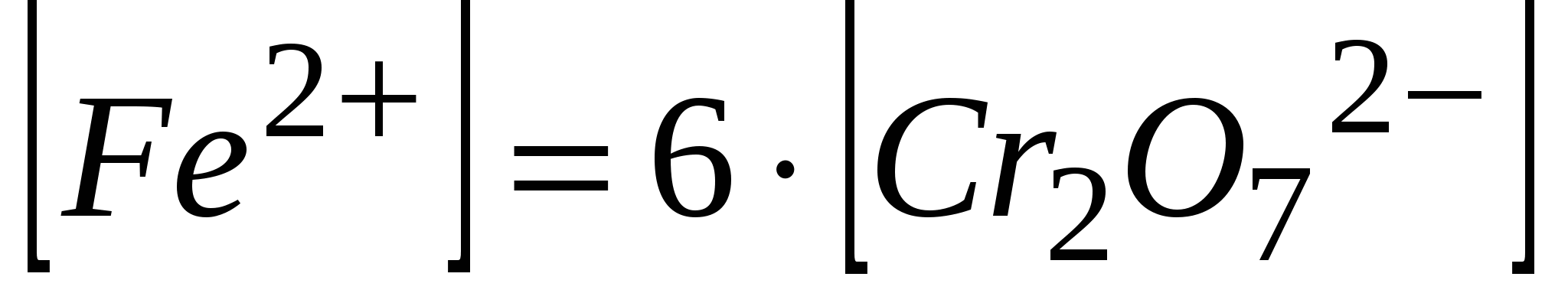 ; ; 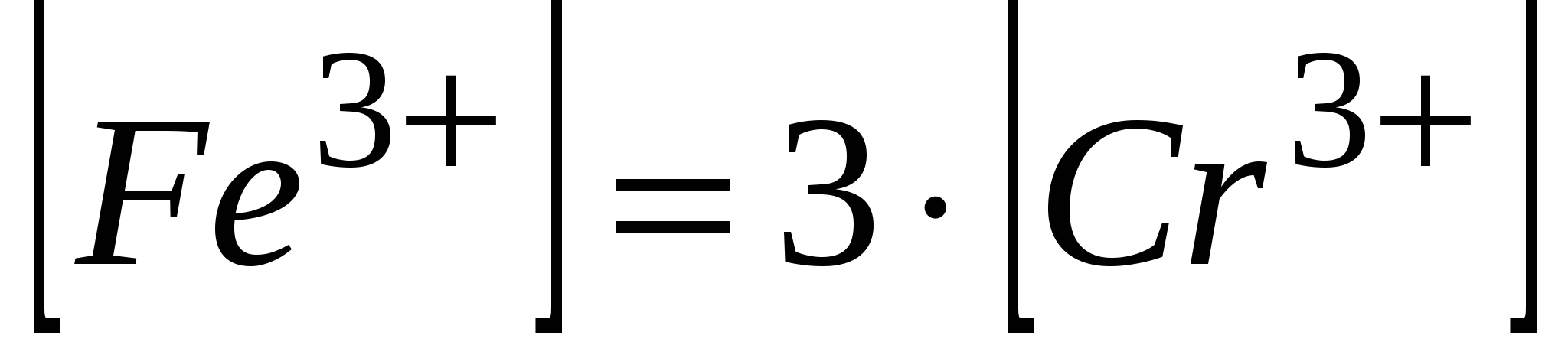 ; ;
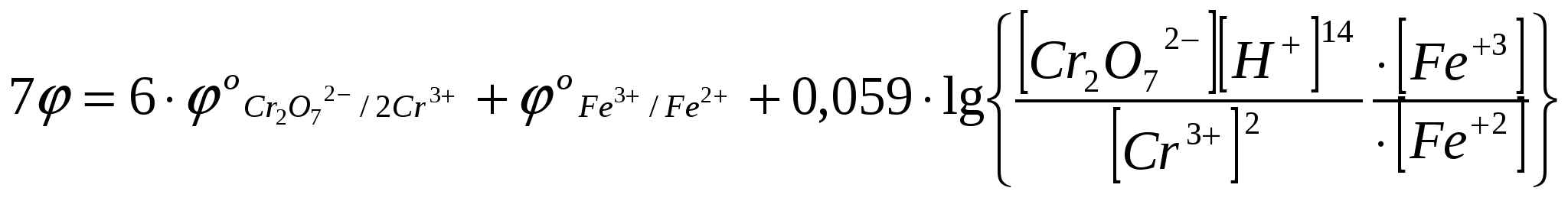
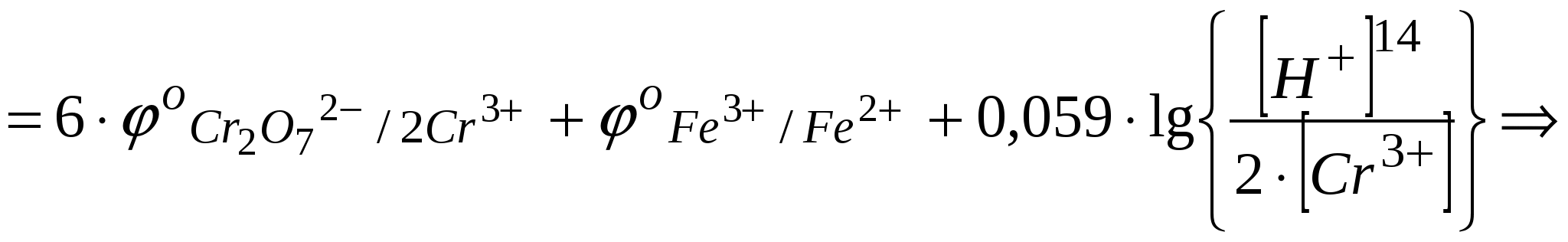

Найдем [Н+] и [Cr3+] в ТЭ:
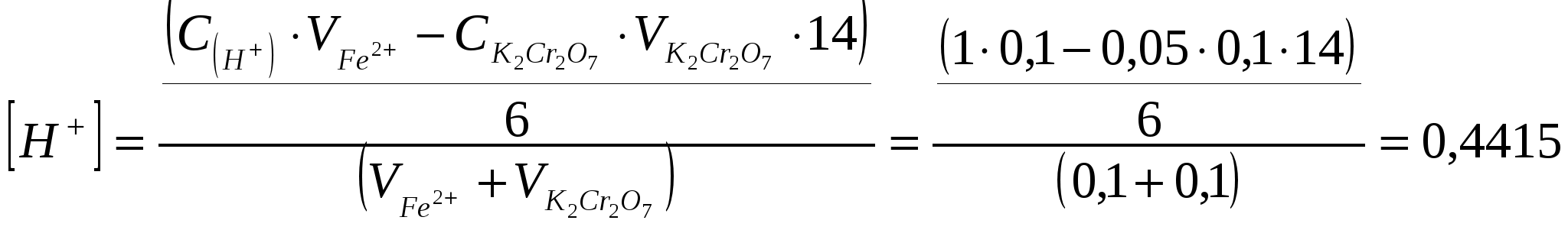 моль/л; моль/л;
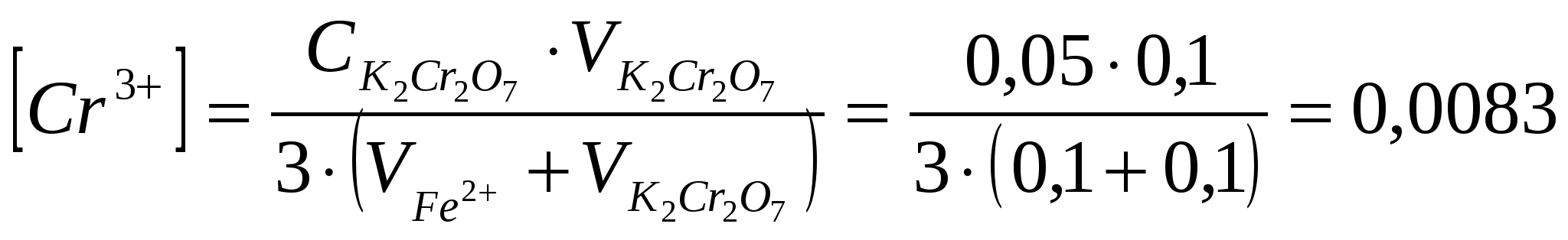 моль/л моль/л
Таким образом,  . .
Расчет потенциала раствора после точке эквивалентности
П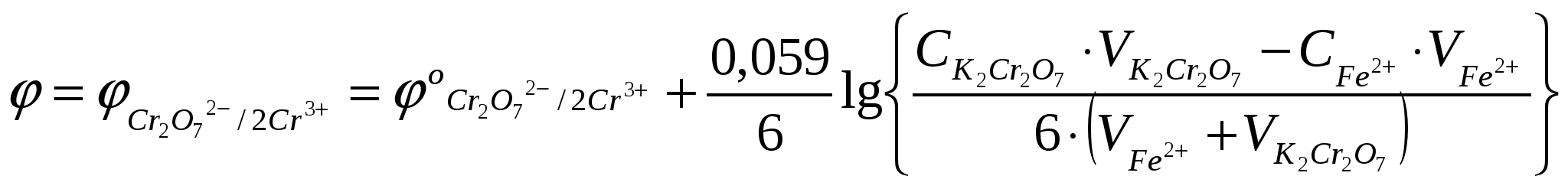 осле ТЭ в растворе присутствуют ионы Fe3+; Cr2O72- и Cr3+, а также ионы водорода, а [Fe2+] – ничтожна и неизвестна. Поэтому раствора считаем по формуле: осле ТЭ в растворе присутствуют ионы Fe3+; Cr2O72- и Cr3+, а также ионы водорода, а [Fe2+] – ничтожна и неизвестна. Поэтому раствора считаем по формуле:
В любой из моментов титрования, после Т.Э., ОВ-процесс будет описываться сокращенным уравнением:

Рассчитаем ОВ-потенциал в точке К.С.:
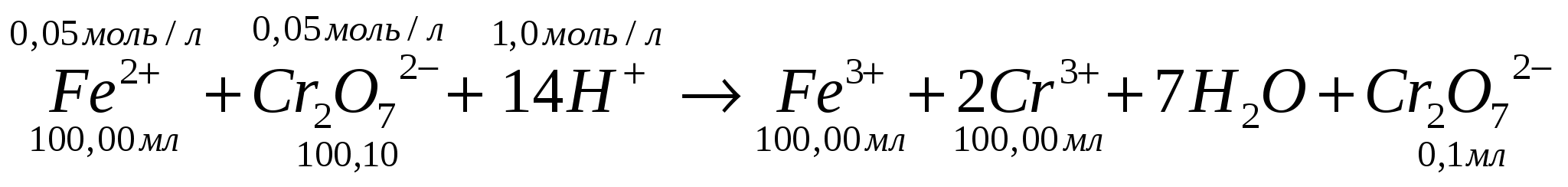
Вычислим равновесные концентрации [Cr3+] и [Cr2O72-]:
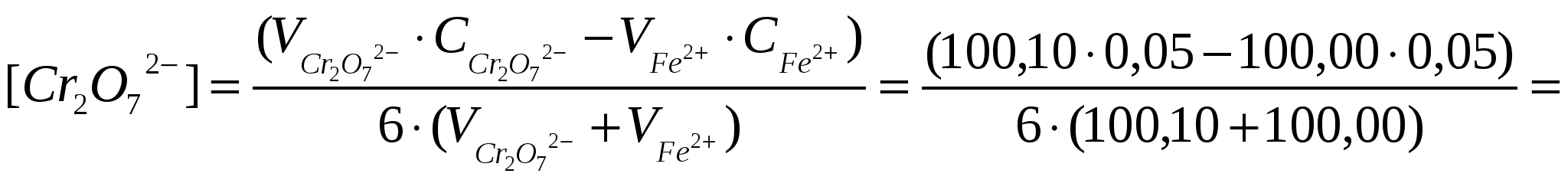
=4,16·10-6 моль/л;
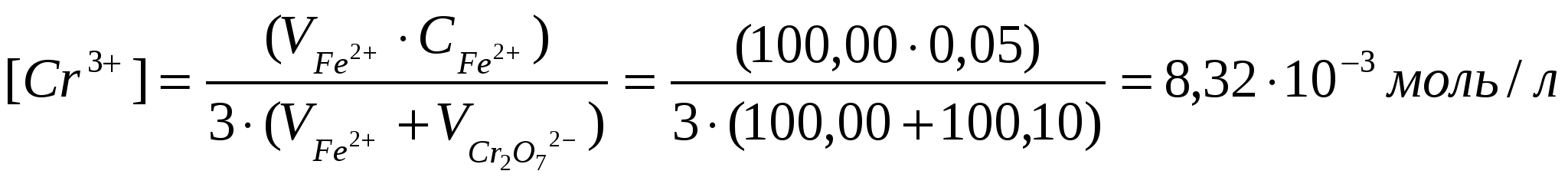 ; ;
Следовательно, в точке К.С.:
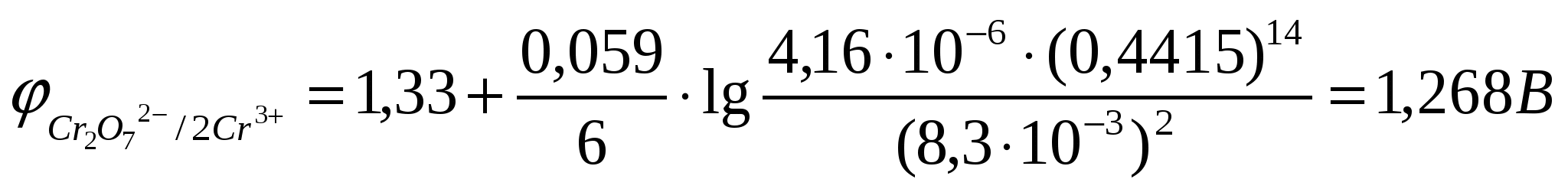
Скачок на кривой титрования лежит в пределах изменения потенциала от +0,947 В до +1,268 В. Следовательно, в качестве индикаторов можно применять фенилантраниловую кислоту (φо=1,00 В), ферроин (φо=1,06 В).
0,1М FeSO4 0,02М раствором KMnO4 при рН = 1.
0,1М FeSO4 0,02М раствором KMnO4 при рН = 3.
0,05М HAsO2 0,02М раствором KMnO4 при рН = 2.
0,02М Na2S2O3 0,01М раствором I2.
0,1М FeSO4 0,1М раствором Ce(SO4)2.
0,05М FeSO4 0,01М раствором KClO3 при [Н+] = 0,1 моль/л.
0,1М FeSO4 0,02М раствором KBrO3 при [Н+] = 1,0 моль/л.
0,05М H2SO3 0,02М раствором KMnO4 при pH = 1.
0,05М H2SO3 0,02М раствором KMnO4 при [H+] = 1,0 моль/л.
0,05М FeSO4 0,01М раствором K2Cr2O7 при [Н+] = 0,1 моль/л.
0,05М HNO2 0,02М раствором KMnO4 при [Н+] = 0,1 моль/л.
0,05М HNO2 0,02М раствором KClO3 при [Н+] = 0,1 моль/л.
0,06М SnCl2 0,02М раствором KBrO4 при pH = 1.
0,01M H2SO3 0,01M раствором I2 при рН = 0,0.
0,03М HAsO2 0,01М раствором KIO3 при [Н+] = 3,0 моль/л.
0,03М HAsO2 0,01М раствором NaClO3 при pH = 0,0.
0,03М SbCl3 0,05М раствором KBrO3 при pH= 1.
0,02М H2SO3 0,05М раствором I2 при pH= 2.
0,1М FeSO4 0,05М раствором NH4VO3 при [Н+] = 1,0 моль/л.
0,05М SnCl2 0,05М раствором NH4VO3 при [Н+] = 0,1 моль/л.
VIII. Расчеты по результатам прямого титрования
Пример: При иодометрическом определении содержания анальгина в препарате приготовили 25,00 мл раствора, содержащего массу растворенного препарата анальгина, равную mнавески= 0,2015 г. На титрование этого раствора израсходовано V=12,00 мл раствора иода с Т(I2/анальгин) = 0,01667 г/мл. Определите массу анальгина в исходной навеске и массовую долю ω анальгина в препарате.
Решение: Титриметрический фактор пересчета или титр по определяемому веществу – это масса определяемого вещества (анальгина), реагирующая с 1 мл титранта, тогда общая масса анальгина равна:
mанальгин= Т(I2/анальгин) · V = 0,01667 · 12,00 = 0,2000 г.
Массовая доля анальгина:
ωанальгин = (mанальгин/mнавески)·100 = (0,2000/0,2015)·100 = 99,26%
Рассчитать массу иода в анализируемом растворе, если на его титрование затрачено 19,30 мл 0,1120М Na2S2O3.
Ответ: 274,3 мг
При титровании 25,00 мл раствора иода израсходовано 22,15 мл раствора Na2S2O3 c молярностью 0,1313М. Рассчитать молярную и массовую концентрации раствора иода.
Ответ: С(I) = 0,1163 моль/л; Т(I) = 14,76 г/л.
На титрование 50,00 мл раствора щавелевой кислоты расходуется 21,16 мл раствора КОН с Т(КОН) = 0,01220 г/мл. 20,00 мл того же раствора кислоты оттитровано 19,34 мл раствора KMnO4. Вычислить титр раствора перманганата по кислороду.
Ответ: 0,000761 г/мл
Рассчитать массу Mn2+ в растворе, если на его титрование до MnO2 в слабощелочной среде затрачено 21,20 мл рабочего раствора KMnO4, нормальная концентрация которого при использовании в кислой среде 0,1010 моль/л.
Ответ: 35,29 мг
Навеску 0,2213 г железной руды перевели в раствор, восстановили железо до Fe2+ и оттитровали 16,90 мл 0,1120 раствора KMnO4. Вычислить массовую долю железа в руде.
Ответ: 1,75%
Для определения содержания серы в стали ее навеску 4,00 г выжигали в трубчатой печи в токе кислорода. Выделяющийся SO2 поглощали водным раствором крахмала и сразу титровали раствором иода. При этом затрачено 1,60 мл раствора иода с титром 0,00660 г/мл. Вычислить массовую долю серы в стали.
Ответ: 0,33%
На титрование Fe2+ в растворе, полученом из 0,2115 г руды, содержащей железо, пошло 21,56 мл раствора KMnO4 с титром по кислороду 0,000835 г/мл. Вычислить массовую долю Fe2O3 в руде.
Ответ 85,0%
При анализе пробы хлорной извести навеска 3,60 г её растерта с водой и разбавлена до 250,0 мл в мерной колбе. На титрование 25,00 мл этого раствора пошло 36,5 мл 0,0260М раствора As2O3. Рассчитать массовую долю активного хлора в пробе хлорной извести.
Ответ 37,4%
При сожжении навески 0,220 г угля сера переведена в SO2, который поглотили раствором крахмала и оттитровали 18,5 мл раствора иода. Концентрация иода установлена с помощью 0,0110М раствора Na2S2O3, причем V(Na2S2O3)/V(I2) = 1,01.
Ответ: 0,81%
С целью идентификации оксида железа неизвестного состава его навеску 0,1000 г перевели в раствор, восстановили до Fe2+ и оттитровали 14,50 мл 0,0894н раствора K2Cr2O7. Из оксидов FeO, Fe2O3 и Fe3O4 выбрать подходящую формулу.
Ответ: Fe3O4
При кислотно-основном титровании навески 1,200г вещества, состоящего из смеси Н2С2О4·2Н2О, КНС2О4·Н2О и индифирентных примесей, израсходовано 18,90 мл 0,500М раствора NaOH. На титрование другой навески 0,400 г того же вещества затрачено 21,55 мл 0,25н раствора KMnO4. Вычислить массовую долю основных компонентов вещества.
Ответ: ω(Н2С2О4·2Н2О) = 14,4%; ω(КНС2О4·Н2О) = 81,7%
На титрование 20,00 мл Н2С2О4 (Т(Н2С2О4·2Н2О) = 0,006900 г/мл) израсходовали 25,00 мл раствора KMnO4. Рассчитать нормальность и титр раствора KMnO4.
Ответ: 0,08656н; 0,002768 г/мл.
На титрование 25,00 мл раствора FeSO4 в H2SO4 израсходовали 31,25 мл 0,1000н K2Cr2O7. Сколько воды нужно добавить к 200,00 мл раствора соли железа, чтобы сделать раствор точно 0,05000н.
Ответ: 300,0 мл
Рассчитать навеску Н2С2О4·2Н2О, которую следует взять в мерную колбу емкостью 500,00 мл, чтобы на титрование 25,00 мл этого раствора израсходовать 30,25 мл раствора, содержащего 1,5800 г/мл KMnO4.
Ответ: 19,06 г.
Вычислить нормальность I2, если на титрование 0,3002 г As2O3 израсходовано 40 мл этого раствора.
Ответ: 0,1517н
Вычислить процентное содержание Н2С2О4 в техническом препарате щавелевой кислоты, если 0,2003 г ее оттитровали 29,30 мл раствора KMnO4, 1,00 мл которого эквивалентен 0,006023 г Fe?
Ответ: 99,45%
Из 1,4500 г технического Na2SO3 приготовили 200,00 мл раствора. На титрование 20,00 мл раствора израсходовали 16,20 мл раствора I2, титр которого по As2O3 равен 0,002473 г/мл. Определить процентное содержание Na2SO3 в образце.
Ответ: 35,30%
Чему равен титр раствора I2 по As2O3, если 1,00 мл его эквивалентен 0,03000 г Na2S2O3?
Ответ: 0,009385 г/мл
Какую навеску руды, содержащей около 60% Fe2O3, взяли для анализа, если после соответствующей обработки на титрование полученной соли железа (II) израсходовали 20,00 мл 0,1н KMnO4?
Ответ: 0,27 г
Рассчитать навеску вещества (г), содержащего 0,3% серы, чтобы на титрование полученного из нее H2S потребовалось 10,00 мл 0,05000н I2.
Ответ: 2,672 г
Навеску образца 0,1000 г. содержащего 99,98% Fe растворили в H2SO4 без доступа воздуха и оттитровали 0,1000н KMnO4. Сколько миллилитров KMnO4 израсходовали на титрование?
Ответ: 17,90 мл.
Вычислить процентное содержание железа в руде. Если после растворения 0,7100 г руды и восстановления железа до Fe2+ на титрование израсходовали 48,06 мл KMnO4 (1,00 мл KMnO4 эквивалентен 0,0067 г Н2С2О4). Сколько граммов KMnO4 содержится в 1 мл раствора?
Ответ: 37,80 г.
Железо в навеске 0,5000 г руды восстановили до Fe2+ и оттитровали 35,15 мл раствора K2Cr2O7, 15,000 мл которого по окисляющей способности эквивалентны 25,00 мл KMnO4, а 1,00 мл KMnO4 эквивалентен 0,004750 г Fe. Рассчитать процентное содержание Fe2O3 в образце руды.
Ответ: 79,57%
Определить процентное содержание Sn в бронзе, если на титрование раствора, полученного из 0,9122 г бронзы, израсходовано 15,73 мл 0,03523н I2.
Ответ: 3,605%
После растворения навески 0,1000 г неизвестного оксида железа и восстановления металла до Fe2+ на титрование израсходовано 12,61 мл 0,09930н K2Cr2O7. Определить, какую формулу имел анализируемый оксид: FeO, Fe2O3 или Fe3O4?
Ответ: Fe2O3
Навеску 0,2250 г пробы, состоящей только из Fe и Fe2O3, растворили, восстановили железо до Fe2+ и оттитровали 37,50 мл 0,09910н KMnO4. Вычислить процентное содержание Fe и Fe2O3 в пробе.
Ответ: Fe – 74,20%; Fe2O3 – 25,80%
Навеску 1,7950 г руды перевели в раствор, восстановили железо до Fe2+ и довели до 250,00 мл. На титрование 20,00 мл раствора израсходовали 18,65 мл K2Cr2O7 с титром 0, 002857 г/мл. Вычислить процентное содержание Fe в образце.
Ответ: 42, 27%
Для определения титра раствора арсенита натрия взяли 0,3125 г образца стали, содержащего 1,05% марганца. Последний соответствующей обработкой переведен в MnO4-, который затем оттитровали 22,50 мл раствора Na3AsO3. Рассчитать титр Na3AsO3 по марганцу.
Ответ: 0,0001458 г/мл
На 50,00 мл раствора H2C2O4 при титровании расходуется 21,16 мл раствора КОН (Т = 0,01234 г/мл). С другой стороны, на 20,00 мл того же раствора H2C2O4 требуется 19,67 мл раствора KMnO4. Определить титр KMnO4 по кислороду.
Ответ: 0,0007570 г/мл
Какой объем 0,1н раствора KMnO4 достаточен для окисления: а) 0,2 г Na2C2O4; б) Fe2+ из навески 0,40 г руды, содержащей около 50% железа?
Ответ: а) 29,8 мл; б) 35,7 мл
Рассчитать нормальность и количество KI в растворе, если при титровании 20,00 мл этого раствора 0,02000М раствором KIO3 (в присутствии H2SO4) пошло 21,10 мл раствора KIO3 (при титровании получается ион I+ (ICl)).
Ответ: 0,0844н; 142 мг
Навеску 0,2133 г руды растворили в соляной кислоте; содержащееся в пробе железо восстановили до Fe2+ и затем оттитровали 0,1117н раствором KMnO4, которого потребовалось 17,20 мл. Найти процентное содержание железа в руде.
Ответ: 50,4%
Какую навеску руды, содержащей около 70 % Fe2O3, надо взять для анализа, чтобы после соответствующей ее обработки, при титровании Fe2+ шло 20 – 30 мл 0,1 н раствора KMnO4?
Ответ: 230 – 240 мг
После ряда операций из навески стали в 1,021 г содержащийся в ней марганец был переведен в раствор в виде MnO4-, на титрование которого пошло 12,40 мл 0,03000н раствора смеси Na3AsO3 и NaNO2. Найти процентное содержание марганца в стали.
Ответ: 0,40%
Определить процентное содержание Na2SO3 в техническом сульфите натрия, если на навеску ее в количестве 0,1450 г израсходовано при титровании 20,2 мл 0,1н раствора I2.
Ответ 87,76%
Из технического сульфита натрия массой 0,5600 г приготовили 200,00 мл раствора. На титрование 20,00 мл этого раствора израсходовали 16,20 мл раствора иода, имеющего Т(I2/As2O3) = 0,002473 г/мл. Определить массовую долю (%) Na2SO3 в образце.
Ответ: 91,15%
На титрование 20,00 мл FeSO4 в сернокислой среде израсходовали 22,50 мл 0,1000н K2Cr2O7 (fэкв.=1/6). Cколько воды нужно добавить к 200,00 мл раствора сульфата железа, чтобы сделать раствор точно 0,05000н (fэкв.=1)?
Ответ: 250,00 мл
Мышьяк (III) встречается в природе в виде минерала клаудетита. На титрование 0,210 г неочищенного минерала израсходовано 29,3 мл 0,0520н раствора иода. Рассчитайте содержание As2O3 в образце (%).
Ответ: 35,9%
На титрование 20.00 мл раствора Na2C2O4 с С(Na2C2O4) = 0,025 моль/л. затрачено 22,50 мл раствора KMnO4. Рассчитайте молярную, нормальную концентрации и титр KMnO4.
Ответ: 0,0089 моль/л; 0,0444н; 0,001403 г/мл.
До какого объема следует разбавить 10,000 мл раствора KBrO3 с молярной концентрацией 0,1000 моль/л, чтобы получить раствор с Т(BrO3-/As3+) = 0,000375 г/мл.
Ответ: до 600 мл.
IX. Расчеты по результатам обратного и заместительного (косвенного) титрования
Пример: Навеску руды, содержащей MnO2, массой 0,4050 г обработали 50,00 мл 0,1000н раствора Н2С2О4 (f = ½) в присутствии H2SO4. На титрование избытка щавелевой кислоты израсходовали 21,42 мл раствора перманганата с Т(KMnO4/Fe) = 0,005836 г/мл. Вычислить массовую долю (%) марганца в руде.
Решение: Определение выполнено по методу обратного титрования, поэтому:
ωMn = 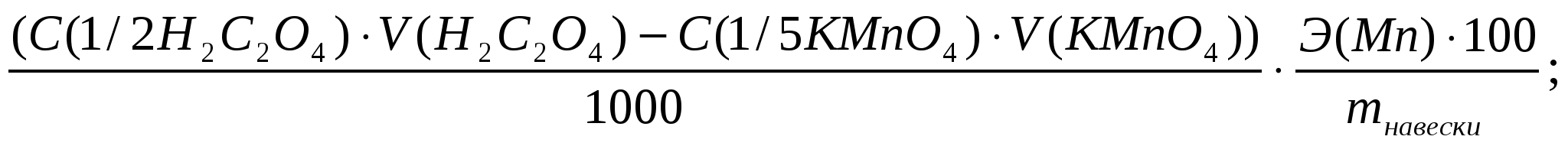
В условии задачи отсутствует С(1/5KMnO4), но дана величина Т(KMnO4/Fe). Выразим концентрацию KMnO4 через данный титр:
С(1/5KMnO4) = 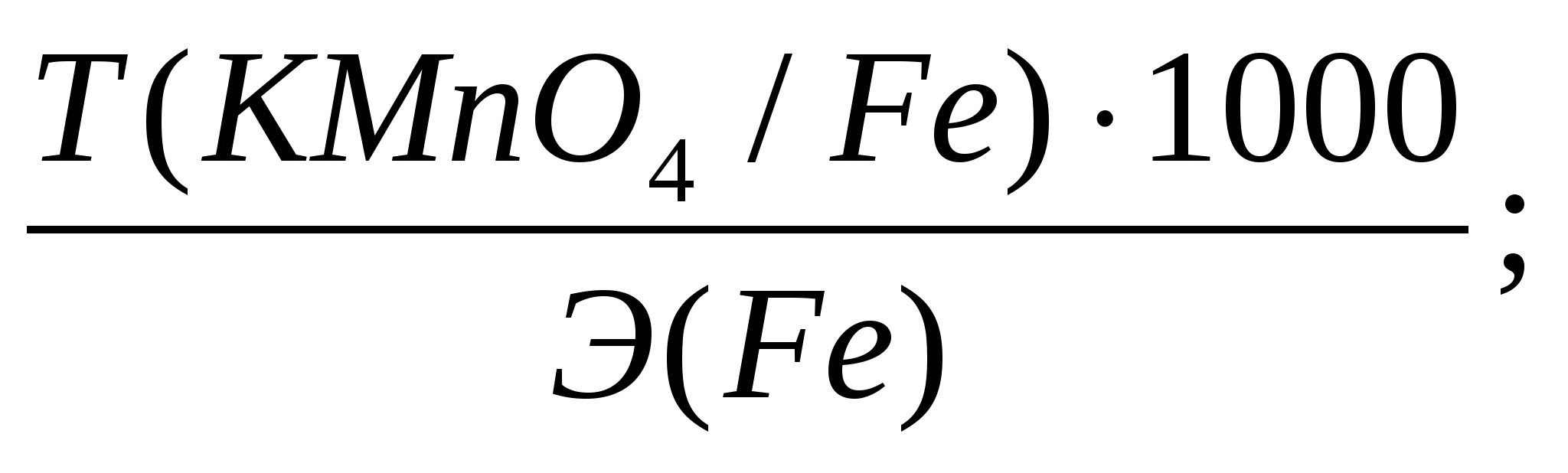 fэкв(Fe)= 1 fэкв(Fe)= 1
Восстановление MnO2 происходит по схеме:
MnO2(тв) + 4Н+ + 2е → Mn2+ + 2H2O
Cледовательно: fэкв(Mn) = ½ ;
Таким образом: Э(Mn) = M(Mn)/2 = 54,938/2 = 27,469 г
Подставляем численные значения в первоначальное уравнение и находим содержание марганца в руде:
ω(Mn) = 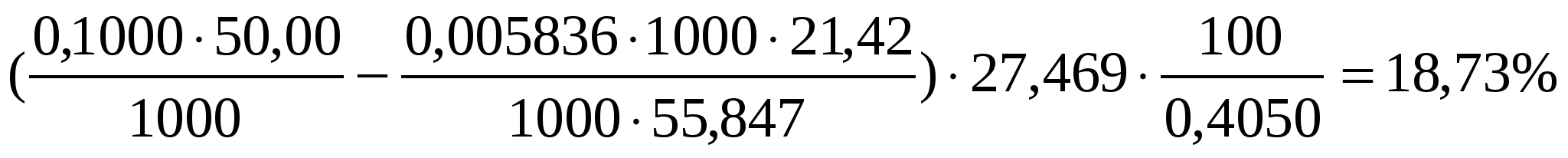
Пример: Из V=50,00 мл анализируемого раствора Н2О2 отобрали аликвотную часть 10,00 мл, прибавили к ней серную кислоту и избыток (по сравнению с ожидаемым стехиометрически) раствора иодида калия. Выделившийся иод оттитровали стандартным раствором тиосульфата натрия объемом 8,00 мл с молярной концентрацией 0,05 моль/л. Рассчитайте концентрацию, титр и массу пероксида водорода в анализируемом растворе.
Решение: При введении иодид-ионов в кислый раствор пероксида водорода выделяется молекулярный иод:
Н2О2 + 2I- + 2H+ → I20 + 2H2O
В количестве, эквивалентном вступившему в реакцию пероксиду водорода. Далее образовавшийся иод реагирует с эквивалентным количеством титранта – тиосульфатом натрия с образованием тетратионата натрия:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Таким образом, эквивалентные количества прореагировавших пероксида водорода, иода и тиосульфата натрия одинаковы:
n(1/2Н2О2) = n(1/2I2) = n(Na2S2O3)
Поскольку в данном случае fэкв для пероксида водорода равен ½, а для тиосульфат-иона – единице (два тиосульфат-иона отдают два электрона, т.е. каждый тиосульфат ион теряет один электрон), то:
С(1/2Н2О2)·V(Н2О2) = С(Na2S2O3)·V(Na2S2O3)
Отсюда концентрация пероксида водорода:
С(1/2Н2О2) = С(Na2S2O3)·V(Na2S2O3)/ V(Н2О2) = 0,05000·8,00/10,00 = 0,0400 моль/л
Титр пероксида водорода:
Т(Н2О2) = С(1/2Н2О2)·Э(Н2О2)/1000 =0,04000·17,0073/1000 = 0,006803 г/мл
Масса пероксида водорода в анализируемом растворе объемом 50 мл:
m(Н2О2) = T(Н2О2)·50,00 =0,006803·50,00 = 0,34015 г
К 25 мл хлорной воды прилит избыток раствора KI и H2SO4, выделившийся при этом иод оттитрован 0,1100н раствором тиосульфата натрия, которого пошло 20,10 мл. Определить содержание хлора (г) в хлорной воде.
Ответ: 3,14 г/мл
К 25 мл сероводородной воды прибавлено 50 мл раствора I2, после чего не вошедший в реакцию иод оттитрован 0,0204н раствором тиосульфата натрия, которого израсходовалось 11,00 мл. Определить содержание сероводорода (г) в сероводородной воде.
Ответ: 0,5150 г/л
К 25 мл бихромата калия прибавлен избыток раствора KI и H2SO4, выделившийся при этом иод оттитрован 0,1 н раствором тиосульфата натрия, которого пошло 30,00 мл. Определить содержание (г) K2Cr2O7 в 1 л раствора бихромата калия.
Ответ: 5,88 г/л
Навеска белильной извести в количестве 0,2607 г растворена в воде и обработана раствором иодида калия в кислой среде. На титрование выделившегося при этом иода израсходовано 25,95 мл тиосульфата натрия, титр которого 0,02487 г/мл. Определить содержание (%) активного хлора в белильной извести.
Ответ: 35,4%
Навеска белильной извести 6,7168 г растворена в мерной колбе емкостью 500,00 мл и 25,00 мл этого раствора обработаны раствором KI и HCl. Выделившийся иод оттитровали 0,04941н раствором тиосульфата натрия, которого израсходовали 35,50 мл. Определить содержание активного хлора в белильной извести.
Ответ: 18,5%
Навеска 2,000 г руды, содержащей MnO2, обработана избытком смеси Н2С2О4 и H2SO4. Щавелевой кислоты было взято 25,00 мл и на титрование не вошедшего в реакцию избытка ее израсходовано 20,00 мл 0,02000н раствора KMnO4. Найти процентное содержание марганца в руде, если известно, что на 25,00 мл раствора Н2С2О4 расходуется 45,00 мл раствора KMnO4.
Ответ: 6,87%
Сколько граммов кальция содержится в 250,00 мл раствора СаСl2, если после прибавления к 25,00 мл его 40,00 мл 0,1000н раствора (NH4)2C2О4 и после отделения образовавшегося осадка СаC2О4 на титрование остатка, не вошедшего в реакцию (NH4)2C2О4, израсходовано 15,00 мл 0.02000н раствора KMnO4?
Ответ: 0,7415 г.
Для установления титра арсенита натрия взято 0,3182 г стандартного образца стали, содержащего 0,84% марганца. На титрование полученной марганцевой кислоты (при растворении стали MnSO4 окисляется в HMnO4) израсходовано 22,27 мл раствора арсенита. Чему равен Т(Na3AsO3/Mn)?
Ответ: 0,000120 г/мл
Навеска 0,2000 г руды, содержащей MnO2, обработана избытком концентрированной HCl. Образовавшийся при реакции хлор был отогнан и поглощен раствором KI. Выделившийся при этом иод был оттитрован 0,05200н раствором тиосульфата натрия, которого израсходовано 42,50 мл. Сколько процентов MnO2 содержит руда?
Ответ: 48,03%
Для определения свинца в руде взята навеска руды 5,000 г. После растворения ее в кислоте ион Pb2+ осажден в виде PbCrO4, осадок отфильтровали, промыли и растворили в смеси HCl и KI. Выделенный иод оттитровали 0,050н раствором тиосульфата натрия, которого израсходовали 42,00 мл. Сколько процентов свинца содержит руда? (fэкв(Pb2+)= 1/3).
Ответ: 2,90%
При иодометрическом определении сульфатов ионы SO42- замещаются эквивалентным количеством CrO42-, которые далее определяют иодометрически. Сколько было Na2SO4 в растворе, если на титрование иода, выделенного из KI эквивалентным SO42- количеством ионов CrO42-, затрачено 30,40 мл 0,01980н раствора тиосульфата натрия?
Ответ: 0,02851 г.
Сколько граммов HCl содержится в 250,00 мл раствора соляной кислоты, если на титрование иода, выделенного из смеси KIO3+KI 25,00 мл этого раствора, затрачено 24,00 мл 0,02100н раствора тиосульфата натрия?
Ответ: 0,1838 г.
Навеску 0,1500 г известняка растворили в HCl, затем Са2+ осадили в виде СаС2О4; промытый осадок растворили в разбавленной H2SO4 и оттитровали 18,85 мл раствора KMnO4 с титром по СаСО3 0,00600 г/мл. Рассчитать массовую долю (%) СаСО3 в известняке.
Ответ: 75,4%
Рассчитать массовую долю (%) меди в руде по следующим данным: из 1,200 г руды после ряда операций медь переведена в раствор в виде Сu2+; при добавлении к этому раствору иодида калия выделился иод, на титрование которого пошло 13,80 мл тиосульфата натрия, с титром по меди 0,006500 г/мл.
Ответ: 7,47%
При анализе навески 0,2505 г доломита выделен осадок СаС2О4, на титрование которого (после растворения в серной кислоте) пошло 20,10 М раствора KMnO4 с титром по железу 0,01200 г/мл. Определить массовую долю (%) СаСО3 в доломите.
Ответ: 86,3%
При сожжении навески 0,220 г угля сера переведена в SO2, который поглотили раствором крахмала и сразу оттитровали 18,5 мл раствора иода. Концентрация иода установлена с помощью 0,0110н раствора тиосульфата натрия, причем V(Na2S2O3)/V(I2)=1,01. Вычислить массовую долю (%) серы в угле.
Ответ: 0,81%
В дымящей серной кислоте (олеум), состоящей из H2SО4, SO3 и SO2, определяем массовые доли этих компонентов. Из 2,000 г кислоты приготовили 500,00 мл раствора. На титрование 50,00 мл этого раствора пошло 21,20 мл 0,2000М раствора NaOH (при этом H2SO3 → NaHSO3). При титровании 100,00 мл того же раствора затрачено 1,85 мл 0,0505М раствора иода. Вычислить процентное содержание H2SО4, SO3 и SO2 в олеуме.
Ответ: 80,95%; 18,3%; 0,75%
Плотность раствора KClO3 составляет 1,02 г/см3. К 2,50 мл этого раствора прибавлено 25,00 мл 0,120М раствора FeSO4, на титрование остатка FeSO4 пошло 4,95 мл 0,110н раствора KMnO4. Вычислить массовую долю (%) KClO3 в растворе.
Ответ 1,97%
Вычислить массовую долю (%) хрома в стали. Навеску стали 1,065 г растворили и перевели Cr в CrO42-. К раствору добавили 25,00 мл раствора соли Мора ((NH4)2•FeSO4•6H2O) и избыток Fe2+ оттитровали 8,50 мл раствора KMnO4 c титром по хрому 0,000490 г/мл. Установлено, что на титрование 25,00 мл соли Мора идет 24,20 мл KMnO4.
Ответ: 0,72%
Навеску 2,12 г стандартного образца стали с массовой долей хрома 1,47% растворили, перевели хром в CrO42-, добавили 25,00 мл рабочего раствора FeSO4, на титрование избытка последнего затратили 4,20 мл рабочего раствора KMnO4. Другим анализом установлено, что на 25, 00 мл р-ра FeSO4 расходуется 24,5 KMnO4. Вычислить по этим данным Т(KMnO4/Cr); C(1/5KMnO4); T(FeSO4).
Ответ: 0,08857 г/мл; 0,08680н; 0,01319 г/мл
Бихромат калия, в количестве 0,1224 выделил из раствора KI такое количество иода, на которое затрачено 24,50 мл раствора тиосульфата натрия. Определить нормальность раствора тиосульфата натрия и титр тиосульфата натрия по иоду (T(Na2S2O3/I2)).
Ответ: 0,1020н; 0,01428 г/мл
Из навески 10,00 г сульфида натрия, содержащего примесь тиосульфата натрия, приготовили 500,0 мл раствора, который анализировали двумя способами:
Для определения суммарного содержания Na2S•9H2O и Na2S2O3•5H2O 25,00 мл этого раствора прилили к 50,00 мл 0,1035н раствору иода, а избыток иода оттитровали 13,05 мл 0,1005н раствором Na2S2O3;
Для определения Na2S2O3•5H2O отобрали 50,00 мл исходного раствора и осадили сульфид в виде ZnS. На титрование фильтрата пошло 11,50 мл 0,0100н раствора иода. Вычислить массовую долю (%) определяемых компонентов в образце.
Ответ: Na2S2O3•5H2O – 2,9%
Na2S•9H2O – 60,2%
Навеска 0,1602 г известняка была растворена в HCl, после чего Са2+ осадили в виде СаС2О4, осадок промыли и растворили в разбавленной H2SO4 и оттитровали 20,75 мл раствора KMnO4, титр которого по СаСО3 равен 0,00602 г/мл. Найти процентное содержание СаСО3 в известняке.
Ответ: 78,4%
Рассчитать процентное содержание меди в руде: из 0,5100 г руды медь была переведена в раствор в виде Cu2+, при добавлении к этому раствору иодида калия выделился иод, на титрование которго пошло 14,10 мл раствора Na2S2O3 с Т(Na2S2O3/Cu) = 0,006500 г/мл.
Ответ: 17,98%
При анализе навески 0,2435 г доломита Са2+ выделен в виде СаС2О4, на титрование которого пошло 42,20 мл раствора KMnO4 (Т(KMnO4/Fe) = 0,005139 г/мл). Сколько процентов СаСО3 содержится в доломите?
Ответ: 79,80%
К кислому раствору KI прибавили 20,00 мл 0,1133н KMnO4 (fэкв=1/5), выделившийся иод оттитровали 25,90 мл раствора Na2S2O3. Рассчитать молярную концентрацию эквивалента раствора Na2S2O3.
Ответ: 0,08749 моль/л
Рассчитать массовую долю (%) меди в руде, если из навески руды массой 0,6215 г медь перевели в раствор в виде Cu2+, добавили к этому раствору KI и на титрование выделившегося I2 израсходовали 18,23 мл раствора тиосульфата натрия с Т(Na2S2O3/Сu) = 0,0060800 г/мл.
Ответ: 18,21 мл
Из технического сульфита натрия массой 0,5600 г приготовили 200,00 мл раствора. На титрование 20,00 мл раствора израсходовали 16,20 мл раствора иода, имеющего Т(I2/As2O3) = 0,002473 г/мл. Определить массовую долю (%) Na2SO3 в образце.
91,15%
На титрование I2, выделенного из 20,00 мл раствора HCl избытком смеси KIO3 и KI, израсходовали 18,25 мл 0,01965н Na2S2O3 (fэкв = 1). Написать уравнение реакции между HCl и иодат-иодидным раствором и вычислить, какая масса HCl содержалась в 200,00 мл анализируемого раствора.
Ответ: 0,1308 г
Раствор Н2О2 приготовили разбавлением 25,00 мл 3%-ой перекиси водорода до 250,00 мл. Сколько миллилитров полученного раствора следует взять, чтобы на его титрование после обработки HCl и KI израсходовать 25,00 мл 0,1500М Na2S2O3?
Ответ: 21,26 мл
Из навески известняка массой 0,1862 г, растворенной в HCl, ионы Са2+ осадили в виде СаС2О4•Н2О. Промытый осадок растворили в разбавленной серной кислоте и образовавщуюся Н2С2О4 оттитровали 22,15 мл раствора перманганата калия с титром по СаСО3 равным 0,005820 г/мл. Рассчитать массовую долю (%) СаСО3 в известняке.
Ответ: 69,23%
После растворения навески стали массой 1,2430 г хром окислили до Cr2O72-. К раствору прибавили 35,00 мл раствора соли Мора и избыток Fe2+ оттитровали 16,12 мл раствора KMnO4. Рассчитать массовую долю (%) хрома в стали, если Т(KMnO4) = 0,001510 г/мл, а 25,00 мл раствора соли Мора эквивалентны 24,10 мл раствора KMnO4.
Ответ: 1.17%
Для определения содержания формальдегида НСОН навеску технического препарата массой 0,2879 г растворили в воде, добавили NaOH и 50,00 мл 0,1004н раствора I2 (fэкв(I2)= ½):

После подкисления раствора на титрование избытка иода пошло 15,20 мл раствора Na2S2O3 с Т(Na2S2O3) = 0,01600 г/мл. Вычислить массовую долю (%) формальдегида в препарате.
Ответ: 18,16%
Для определения хрома (III) в присутствии ионов CrO42- к 20,00 мл раствора прибавили 50,00 мл 0,1032н раствора NaBrO (fэкв= ½) и некоторое количество концентрированного раствора NaOH, а избыток гипобромита оттитровали 21,45 мо 0,1014н раствора Н2О2 (fэкв= ½). Какая была концентрация Cr3+ (г/л) в анализируемом растворе?
Ответ: 2, 5868 г/л
К подкисленному раствору Н2О2 прибавили избыточное количество KI и несколько капель соли молибдена в качестве катализатора. Выделившийся I2 оттитровали 22,40 мл 0,1010н Na2S2O3 (fэкв= 1) Какая масса Н2О2 содержалась в растворе?
Ответ: 0,03848 г
Рассчитать массу образца, содержащего около 65% MnO2, чтобы после взаимодействия с 50,00 мл 0,1000 Н2С2О4 (fэкв= ½) избыток ее оттитровывался 25,00 мл раствора KMnO4, 1,00 мл которого эквивалентен 1,05 мл раствора H2C2O4.
Ответ: 0,1588 г
Навеску технического FeCl3 массой 4,208 г растворили в мерной колбе V = 250,00 мл. К 20,00 мл полученного раствора добавили KI и кислоту, выделившийся иод оттитровали 22,10 мл 0,09230н Na2S2O3 (fэкв= 1) Вычислить массовую долю (%) FeCl3 в образце.
Ответ: 98,28%
Для перманганатометрического определения пероксида магния MgO2 приготовили 10,00 мл раствора, в котором была растворена навеска анализируемого образца массой 0,2045 г. На титрование приготовленного раствора израсходовано 19,75 мл стандартного раствора KMnO4 с Т(KMnO4/MgO2), равным 0,002816 г/мл. Рассчитайте массу и массовую долю (%) MgO2 в образце.
Ответ: 0,0556 г; 27,2%
Для определения меди (II) приготовили 100,00 мл анализируемого раствора, отобрали аликвотную часть 15,00 мл, прибавили разбавленную серную кислоту и раствор иодида калия в избытке, выделившийся при реакции иод оттитровали раствором тиосульфата натрия, которого пошло 6,00 мл с концентрацией 0,05000 моль/л. рассчитать молярную концентрацию, титр и массу меди (II) в анализируемом растворе.
Ответ: 0,02000 моль/л; 0,001271 г/моль; 0,1271 г
Хром, содержащийся в 1,87 г хромита FeO•Cr2O3, окислили до состояния +6 сплавлением с перекисью натрия. Сплав обработали водой и прокипятили для разрушения избытка перекиси. После подкисления к раствору прибавили 50,00 мл 0,1600н раствора Fe2+. На титрование избытка Fe2+ израсходовали 2,97 мл 0,05000н раствора K2Cr2O7.
а) Каково процентное содержание хромита в образце?
б) Каково процентное содержание хрома в образце?
Ответ: а) 15,7%; б) 7,28
|
 Скачать 1.33 Mb.
Скачать 1.33 Mb.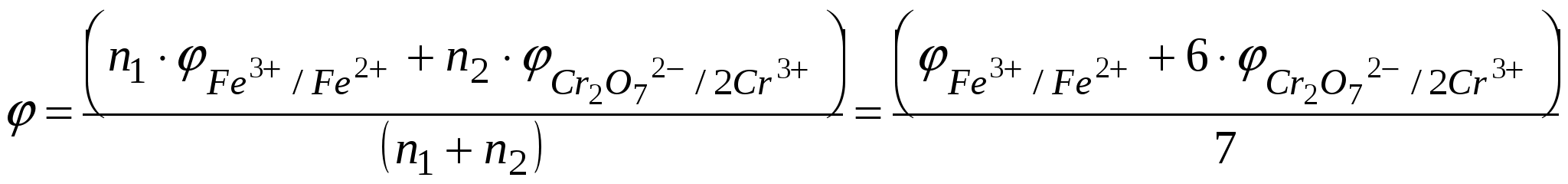 ;
;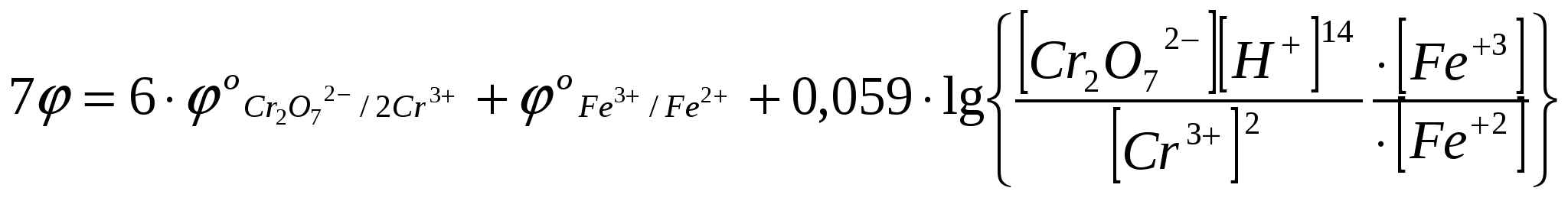
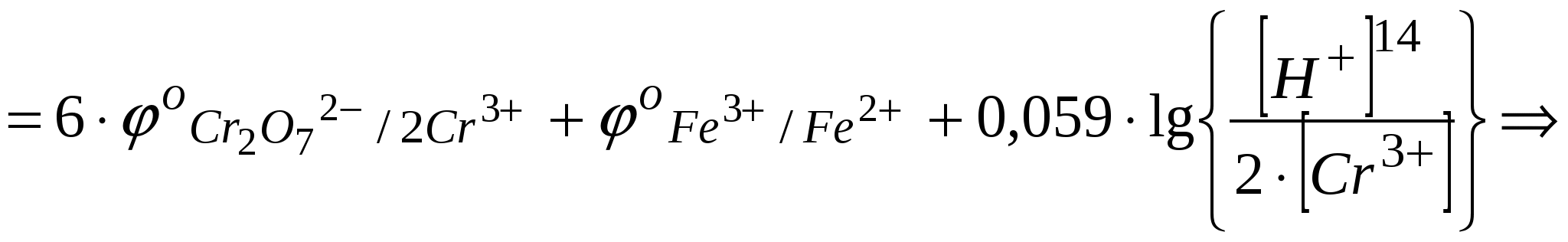

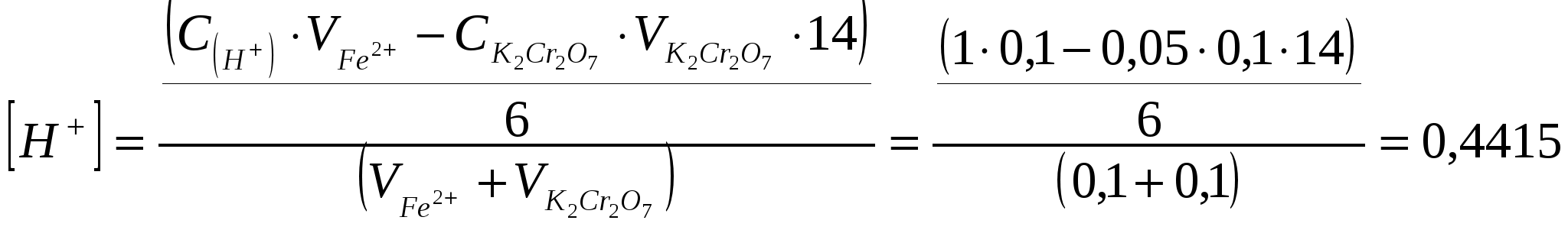 моль/л;
моль/л;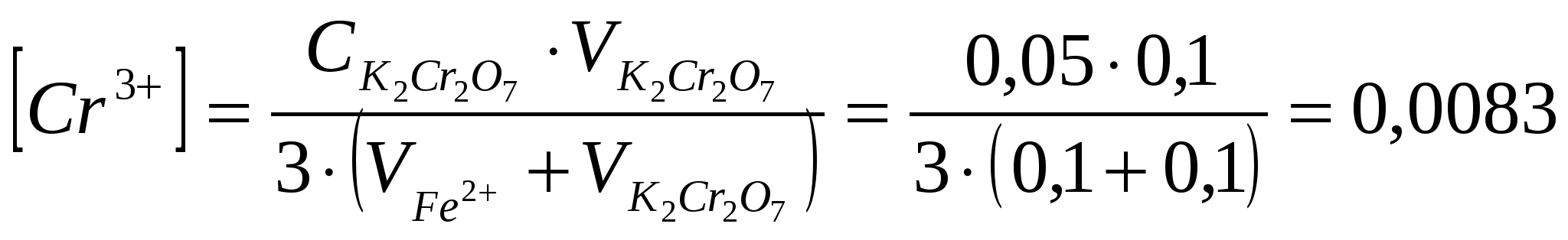 моль/л
моль/л
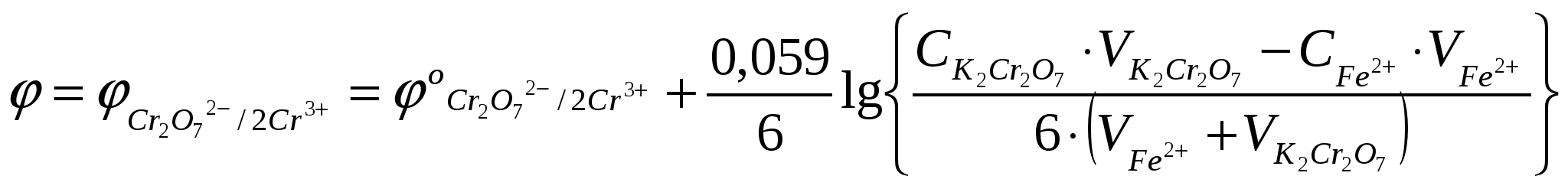 осле ТЭ в растворе присутствуют ионы Fe3+; Cr2O72- и Cr3+, а также ионы водорода, а [Fe2+] – ничтожна и неизвестна. Поэтому раствора считаем по формуле:
осле ТЭ в растворе присутствуют ионы Fe3+; Cr2O72- и Cr3+, а также ионы водорода, а [Fe2+] – ничтожна и неизвестна. Поэтому раствора считаем по формуле: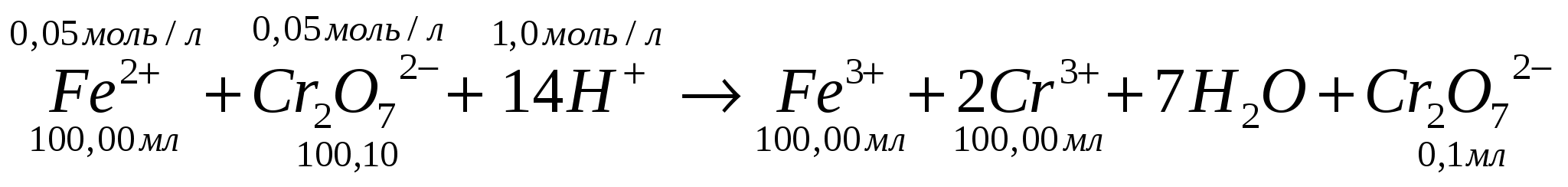
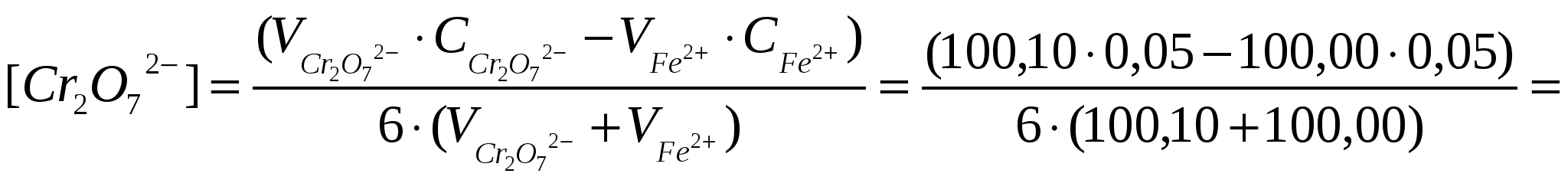
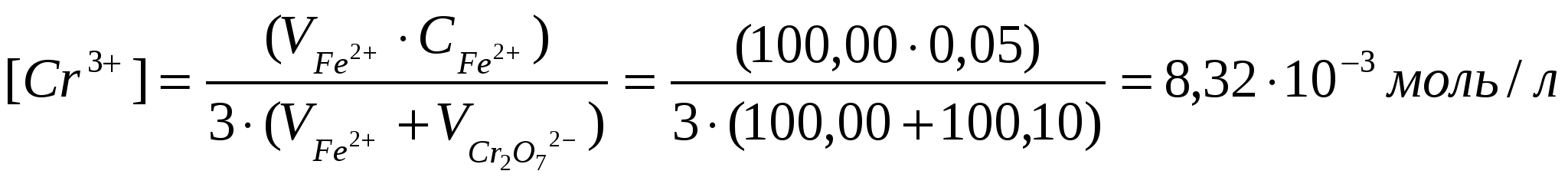 ;
;