УМП КОЛИЧ.АНАЛИЗПрактическое руководство. Учебное пособие по количественному химическому анализу Учеб пособие. Уфа Издво угнту, 2005. 111 с
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
Закон эквивалентов. Эквиваленты веществОбъемный анализ основан на законе эквивалентов: "Все вещества взаимодействуют между собой в соотношениях масс, пропорциональных их эквивалентам. Один эквивалент одного вещества всегда реагирует с одним эквивалентом другого вещества". Величина эквивалента вещества зависит от химической реакции, в которой он участвует. В реакциях нейтрализации эквивалентом называют такую часть молекулы (иона), на которую приходится один принимаемый или отдаваемый ион водорода (или гидроксид-ион). Формула эквивалента вещества "А" имеет вид 1/Z А, где I/Z называется фактором эквивалентности, а «Z» - числом эквивалентности ( Z показывает, во сколько раз величина массы моля эквивалента вещества меньше его молярной массы). Например, в реакции: NaOH + H2SO4 = NaHSO4 + H2O числа эквивалентности и для NaОН и для H2SO4 равны единице, так как в реакции участвует только один ион водорода (один гидроксид-ион) и серная кислота выступает как одноосновная. Формула эквивалента её 1/1 (H2SO4), молярная масса, эквивалента M (1/1 H2SO4) = 1/1 M (H2SO4) = 98 г/моль. В реакции: H2SO4 + 2NaOH = Na2SO4 + 2H2O (1) два эквивалента NаОН взаимодействуют с двумя эквивалентами H2SO4 (кислота в этой реакции двухосновная). Число эквивалентности для неё Z = 2; формула эквивалента 1/2M (H2SO4); молярная масса эквивалента M (1/2 H2SO4) = 1/2M (H2SO4) = 49 г/моль. В реакции взаимодействия буры (Na2B4O7 · 10H2O) c соляной кислотой: Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl (2) Молекула Na2B4O7, взаимодействует с двумя ионами водорода, поэтому число эквивалентности буры Z = 2, а величина молярной массы эквивалента её: М(1/2Na2B4O7·10H2O) = 1/2М(Na2B4O7·10H2O) = ½ • 381,4 = 190,7 г/моль. Математически закон эквивалентов записывается формулами: а) С (1/Z1·A)·V(A) = C(1/Z2·B) ·V(B); б) m(A)/M(1/Z1·A) = C(1/Z2·B) ·V(B)/1000; где С (1/Z1·A) и C(1/Z2·B) - нормальности растворов веществ А и В соответственно, моль/л; V(А) и V(B) - объемы растворов веществ А и В соответственно, мл; m (А) - масса вещества А, г; M(I/Z1 A) - молярная масса эквивалента вещества А, г/моль; m(A)/M(I/Z1A) и С(1/Z2В) • V(B)/1000 - число эквивалентов вещества А и В соответственно. Когда титрование проводится по методу пипетирования, то для расчетов применяют формулу (а), а при титровании по методу отдельных навесок - формулу (б). Для нахождения концентраций ионов водорода и величины рН в различных точках на кривых титрования следует пользоваться следующими формулами: 6) [H+]=(C(1/Zк-ты)·Vк-ты-С(1/Zосн.)·Vосн./(Vк-ты+Vосн.); рН=-lg[H+](в растворе избыток сильной кислоты); 7) [OH-]=(C(1/Zосн.)·Vосн.-С(1/Zк-ты)·Vк-ты)/(Vк-ты+Vосн.); рН=14+lg[ОН-] (в растворе избыток сильной щелочи); 8) рН=½рК(к-ты)-½lgC(к-ты), где рК(к-ты)=-lgK(к-ты) (в растворе слабая кислота); 9) рН=14-½рК(осн.)+½lgC(осн), где рК(осн.)=-lgK(осн.); (в растворе слабое основание); 10) рН=рК(к-ты)-lg(C(к-ты)/С(соли)) (в растворе кислотная буферная смесь); 11) рН=14-рК(осн.)+lg(C(осн.)/С(соли)) (в растворе щелочная буферная смесь); 12) рН=7+½рК(к-ты)+½lgС(соли) (в растворе соль, подвергающаяся гидролизу по аниону); 13) рН=7-½рК(осн.)-½lgC(соли) (в растворе соль, подвергающаяся гидролизу по катиону); 14) рН=(рК1+рК2)/2 (в растворе кислая соль) . 1.2. Лабораторные работы. Метод кислотно-основного титрованияЛабораторная работа № 1 Определение содержания щелочи в контрольном объеме раствораI. Теоретическое обоснование работы Для выполнения работы необходим титрованный раствор соляной кислоты (рабочий раствор), его готовят разбавлением концентрированной кислоты. HCl не отвечает требованиям, предъявляемым к исходным веществам и поэтому из нее нельзя по навеске приготовить раствор точной концентрации. Точную концентрацию соляной кислоты устанавливают по буре Na2B4O7·10H2O, которая отвечает требованиям к исходным веществам (см. 4, с. 215–219). Дважды перекристаллизованная бура быстро и до конца взаимодействует с соляной кислотой по реакции, из которой видно, что молярная масса эквивалента буры равна ½ М(Na2B4O7·10H2O) = 190,7 г/моль. рН в эквивалентной точке будет определяться образовавшейся в результате реакции слабой борной кислотой: pН = ½ рК1(к-ты) - ½ lgС(к-ты), где рК1(к-ты) - силовой показатель константы ионизации борной кислоты по первой ступени, равный 9,24; С(к-ты) - концентрация кислоты в точке эквивалентности, которую можно принять равной половине исходной концентрации буры, так как объем раствора в конце титрования в два раза больше затраченного раствора буры. Допустим, что исходная концентрация буры равна 0,1н, тогда концентрация борной кислоты в эквивалентной точке будет равна 0,05 н , отсюда рН в эквивалентной точке будет равен: рН = ½·9,24 - ½ lg5·10-2 = 4,62 + 0,35 ≈ 5. Так как область скачка величины рН на кривой титрования для этого случая располагается от 6 до 4, то титрование можно проводить в присутствии метилового оранжевого. С выбранным индикатором проводят титрование и на основании полученных данных вычисляют точную концентрацию рабочего раствора соляной кислоты. Используя этот рабочий раствор, можно определить массу щелочи в контрольном объеме. 2. Техника безопасности к работе № 1. 2.1. Все виды работы, связанные с приготовлением соляной кислоты из концентрированной, проводить в вытяжном шкафу, так как последняя дымит на воздухе и имеет резкий удушливый запах. 2.2. При попадании концентрированной кислоты на кожу необходимо хорошо промыть пораженное место струёй воды, затем 5 - 10% раствором питьевой соды. 2.3. Если кислота попала в глаза, то их нужно промыть большим количеством воды и обязательно обратиться к врачу. 2.4. При работе с мерной пипеткой для наполнения ее нужно пользоваться резиновой грушей, конец пипетки необходимо опускать глубоко в жидкость, чтобы не произошло засасывания ее в грушу.
Работа состоит из четырех частей: 3.1. Приготовление 200 мл децинормального 0,1 н раствора соляной кислоты из концентрированной. 3.1.1. Ареометром измерить плотность концентрированной кислоты ρ. 3.1.2. Найти с помощью таблицы или пересчитать молярность (она же нормальность) концентрированной соляной кислоты СНС1. 3.1.3. Найти объем концентрированной соляной кислоты V1(НС1), необходимый для приготовления 200 мл 0,1 М раствора HCI по формуле C(HCl)·V(HCl) = C1(HCl)·V1(HCl), где С(НС1) и V(HCI) - молярная концентрация и объем разбавленной кислоты. 3.1.4. Рассчитанный объем концентрированной соляной кислоты налить в пробирку с делениями с небольшим избытком в 0,1 - 0,3 мл. 3.1.5. В мерный стакан налить 200 мл дистиллированной воды, прилить туда отмеренный объем концентрированной соляной кислоты, перемешать стеклянной палочкой, перелить приготовленный раствор в колбу, закрыть пробкой и снабдить этикеткой. 3.2. Приготовление 100 мл 0,1 н. раствора буры точной концентрации по навеске 3.2.1. Рассчитать навеску (m, г) буры, необходимую для приготовления 100 мл 0,1 н. раствора по формуле: m (Na2B4O7·10H2O) = (C(1/2 Na2B4O7·10H2O)·M(1/2 Na2B4O7·10H2O)·Vм.к.)/1000 где С (1/2 Na2B4O7·10H2O) - концентрация раствора буры, моль/л; М(1/2 Na2B4O7·10H2O) - молярная масса эквивалента буры, г/моль; Vм.к. - объем мерной колбы, мл. Данная формула вытекает из следующих рассуждений: в 1000 мл раствора содержится 0,1M(1/2 Na2B4O7·10H2O) г в 100 мл ― m г. 3.2.2. На аналитических весах взвесить навеску буры, близкую к расчетной (± 10%). Ее можно взять разными способами. Опишем один из них: а) взвесить сухой чистый стаканчик сначала на техно-химических весах (записать вес в лабораторный журнал); б) в стаканчик поместить навеску буры, приблизительно равную расчетной, взвесить вначале на техно-химических, а затем - на аналитических весах (записать в лабораторный журнал); в) Высыпать буру в мерную колбу и взвесить пустой стаканчик с остатками буры на аналитических весах (записать в лабораторный журнал); г) по разности масс стаканчика с бурой и пустого определить точную навеску буры: mст.с бурой – mпуст.ст = mбуры 3.2.3. Перенесение навески буры в мерную колбу на 100,0 мл осуществить следующим образом: в мерную колбу вставить сухую воронку (трубка воронки должна легко входить в горло колбы), постепенно пересыпать навеску буры в колбу через воронку так, чтобы не забивать ее трубку, через эту же воронку налить горячую воду в колбу приблизительно на ⅓ ее объема и встряхивать до полного растворения кристаллов буры; охладить полученный объем до комнатной температуры и долить до метки по нижнему мениску дистиллированной водой комнатной температуры, закрыть мерную колбу чистой пробкой и тщательно перемешать содержимое в колбе, переворачивая ее 6-10 раз. 3.2.4. Рассчитать нормальность раствора буры с точностью до четырех значащих цифр C(1/z Na2B4O7·10H2O) = = (m (Na2B4O7·10H2O)·1000)/M(1/2Na2B4O7·10H2O)·Vм.к., моль/л 3.2.5. Перелить приготовленный раствор буры в чистую колбу, предварительно ополоснув колбу приготовленным раствором буры, и прикрепить этикетку, на которой указана концентрация буры. 3.3. Определение точной концентрации соляной кислоты по буре 3.3.1. Бюретку вымыть до химической чистоты, ополоснуть приготовленным раствором кислоты (дважды), заполнить носик бюретки сплошным столбом раствора, удалив пузырьки воздуха (проверив при этом действие шарикового затвора: не пропускает ли он раствор). Налить раствор кислоты через воронку выше нулевой отметки (воронку при этом приподнять для свободного выхода воздуха), убрать воронку и установить уровень кислоты на нулевом делении по нижнему мениску, выливая лишнюю кислоту через носик бюретки. 3.3.2. В две конические колбочки для титрования (на 100 мл) пипеткой на 10,00, 15,00 или 20,00 мл взять аликвоты раствора буры (Vпип.), предварительно дважды ополоснув пипетку раствором буры! 3.3.3. В каждую колбочку добавить по I капле метилоранжа и титровать до перехода окраски индикатора, из желтой в оранжевую, записывая каждый раз объем израсходованной кислоты по бюретке (V1(HCl) и V11(HCl)) и доливая ее до «0». 3.3.4. Объемы двух параллельных определений не должны отличаться друг от друга более чем на 0,20 мл, в противном случае нужно провести еще одно титрование. Из двух определений рассчитать среднеарифметический объем кислоты, пошедшей на титрование (V1(HCl) + V11(HCl))/2 = Vср. (HCl) 3.3.5. Рассчитать с точностью до четырех значащих цифр нормальность раствора кислоты по формуле: C(HCl) = (C(1/2Na2B4O7·10H2O)·Vпип)/Vср(HCl) Показать преподавателю значение концентрации HCI и получить разрешение на получение контрольной задачи. 3.4. Определение миллиграммового содержания щелочи (NaOH) в контрольном объеме 3.4.1. В химически чистую мерную колбу на 100,0 мл (Vм.к.) получить контрольннй объем раствора щелочи; довести его дистиллированной водой до метки по нижнему мениску, закрыть пробкой и тщательно перемешать, переворачивая колбу (6-10 раз). 3.4.2. Бюретку заполнить рабочим раствором кислоты, концентрацию которой определили. 3.4.3. В две химически чистые конические колбы для титрования пипеткой (предварительно ополоснув пипетку раствором щелочи) взять аликвоты контрольного раствора щелочи, добавить в каждую колбу по 1 капле метилоранжа, титровать кислотой до перехода желтой окраски в оранжево-розовую. 3.4.4. Все объемы параллельных титрований (V1 и V11) не должны отличаться друг от друга более чем на 0,20 мл. Рассчитать среднеарифметический объем. 3.4.5. Рассчитать с точностью до четырех значащих цифр массу щелочи (мг) по формуле: m (NaOH) = (C(HCl)·M(NaOH)·Vcр (HCl)·Vм.к.)/Vпип., мг 3.4.6. Показать преподавателю выполненную работу, получить у него правильный результат (mтеор.) и рассчитать процент относительной ошибки по формуле: % ошибки = [(m(NaOH) – mтеор.) / mтеор.]·100 Ошибка не должна превышать ± 2%, если она больше 2%, то надо проанализировать выполнение работы и по указанию преподавателя заново определить нормальность рабочего раствора кислоты. Для определения массы кислоты в растворе нужно иметь титрованный раствор щелочи. Точную концентрацию щелочи устанавливают по подходящему исходному веществу (обычно по кристаллической щавелевой кислоте). 4. Контрольные вопросы
Лабораторная работа № 2 Определение миллиграммового содержания NaOH и Na2CO3 при совместном присутствии I. Теоретическое обоснование работы Это определение основывается на методе фиксирования двух точек эквивалентности на кривой титрования. Вследствие поглощения углекислого газа из воздуха раствор едкого натра всегда содержит примесь соды Na2CO3. На практике очень часто нужно знать содержание NaOH и Na2CO3 в растворе. При титровании кислотой Na2CO3 сначала превращается в NaНCO3, а затем - в Н2CO3. На кривой титрования образуется две точки эквивалентности. Одна из них соответствует образованию NaНCO3 (рН = (рК1 + рК2)/2 = 8,34), другая - Н2CO3 (рН = 4). Вследствие этого раствор соли Na2CO3 различно титруется с фенолфталеином и метиловым оранжевым. Интервал перехода фенолфталеина находится в пределах рН = 8 - 10. Для рН ≤ 8 наблюдается окраска кислотной формы индикатора - бесцветная, а для рН ≥ 10 наблюдается окраска щелочной формы - малиновая. В интервале от рН = 10 до рН = 8 малиновая окраска постепенно изменяется до бледно-розовой. Значит с фенолфталеином титрование заканчивается в тот момент, когда весь Na2CO3 превратится в NaНCO3: СО32- + Н+ → НСО3- (I) Когда же Na2CO3 титруется с метиловым оранжевым, то порозове-ние индикатора наблюдается при рН = 4, когда вся соль оттитрована полностью до Н2CO3: СО32- + 2Н+ → Н2СО3 (2) Из сравнения приведенных уравнений (1) и (2) видно, что при титровании Na2CO3 с фенолфталеином на один моль соли затрачивается один моль соляной кислоты, а с метиловым оранжевым - два моля. Раствор NaOH титруется одинаково и с метиловым оранжевым и с фенолфталеином. Таким образом,с фенолфталеином оттитровывается ½Na2CO3 и вся щелочь, а после добавления метилового оранжевого оттитровывается вторая половина Na2CO3 (рисунок).
Используя результаты титрования с двумя индикаторами, вычисляют содержание NаОН и Na2CO3, когда они находятся в одном растворе. Так как отношение К1 : К2 для H2CO3 примерно равно 104, то скачок рН около точки эквивалентности, соответствующей образованию NaHCO3, невелик, поэтому это определение не слишком точное. Точность определения понижается также из-за поглощения СО2 из воздуха или из воды, которой разбавляется раствор, когда часть NaOH превращается в Na2CO3. Внимание! Учитывая вышеcказанное, при проведении анализа следует соблюдать следующие условия: а) получив контрольную задачу, раствор закрыть пробкой; б) тотчас же титровать взятый объем раствора; в) в конце титрования с фенолфталеином прибавлять кислоту медленно, чтобы предотвратить образование вместо NaHCO3 свободной H2CO3; г) избегать сильного перемешивания раствора, способствующего поглощению СО2 из воздуха. 2. Техника безопасности При попадании раствора щелочи на кожу нужно промыть пораженное место большим количеством воды, а затем слабым раствором уксусной кислоты. 3. План работы 3.1. Заполнить бюретку титрованным раствором соляной кислоты. 3.2. В химически чистую мерную колбу на 100,0 мл получить контрольный объем смеси NаОН и Na2CO3; довести объем раствора дистиллированной водой до метки по нижнему мениску, закрыть колбу пробкой и перемешать раствор (пробку придерживать пальцем). 3.3. Внимание! Пипетку ополоснуть дважды раствором, который приготовили. В две колбы для титрования пипеткой на 10,0; 15,0 или 20,0 мл прилить аликвоту контрольной задачи и закрыть пробками. 3.4. В первую колбу прилить 8-9 капель фенолфталеина (цвет раствора в колбе становится ярко-малиновым). 3.5. Раствор в первой колбе титровать соляной кислотой до тех пор, пока цвет раствора в колбе не станет бледно-розовым от одной капли HCI (титрование проводить медленно, соляную кислоту приливать по каплям, чтобы избежать образования H2CO3. 3.6. Записать по бюретке объем кислоты, пошедший на титрование 1/2 Na2CO3 и всей щелочи (V1). 3.7. Затем к этому оттитрованному раствору прилить одну каплю метилового оранжевого (при этом раствор в колбе окрасится в желтый цвет) и, не доливая раствор в бюретку до "0", продолжить титрование до неисчезающей оранжевой окраски раствора. 3.8. Записать объем соляной кислоты по бюретке от нулевой метки, пошедший на титрование всего количества соды и щелочи (V2). 3.9. Определение в том же порядке повторить и с контрольным раствором во второй колбе. Записать объемы кислоты V1 и V2. 3.10. Рассчитать массу (мг) соды и щелочи следующим образом: Из данных титрования по двум колбам найти среднее арифметическое (V1сред.) между V1 и V11, а также V2сред. между V2 и V21. Рассчитать объем соляной кислоты (V3), пошедший на титрование ½ количества соды V3 = V2сред. – V1сред. Рассчитать объем кислоты V4, пошедшей на титрование всей соды: V4 = 2V3 Рассчитать объем кислоты V5, пошедшей на титрование щелочи: V5= V2сред. - V4 Рассчитать массу соды в мг в объеме мерной колбы по формуле: m (Na2CO3) = (V4·C(HCl)·M(1/2 Na2CO3)·Vм.к.)/Vпип. Рассчитать массу щелочи в мг в объеме мерной колбы: m (NaOH) = (V5·C(HCl)·M(NaOH)·Vм.к.)/ Vпип. 4. Контрольные вопросы.
Лабораторная работа № 3 Определение процентного содержания карбоната натрия и примесей в пищевой соде I. План работы 1.1. Заполнить бюретку титрованным раствором соляной кислоты. 1.2. Взять навеску исследуемой пищевой соды m (навески) около 1 г (взвесить точно на аналитических весах), растворить в мерной колбе на 100,0 мл, довести до метки дистиллированной водой, перемешать . 1.3. Взять пипеткой на 10,0, 15,0 или 20,0 мл (предварительно ополоснуть ее этим раствором) аликвоту исследуемого раствора в две колбы для титрования и закрыть их пробками. 1.4. В первую из них прилить 8÷10 капель фенолфталеина (цвет раствора - малиновый). 1.5. Сразу же титровать раствор по каплям соляной кислотой до слабо-розовой окраски (рН = 8,5). 1.6. Замерить по бюретке объем соляной кислоты V1, пошедшей на титрование ½ Na2CO3. 1.7. Рассчитать объем соляной кислоты, пошедшей на титрование всего количества карбоната натрия; он равен 2·V1. 1.8. В эту же колбу (первую) прилить 1-2 капли метилового оранжевого (цвет раствора в колбе станет желтым) и продолжать титровать раствор до оранжевого цвета. 1.9. Замерить объем соляной кислоты по бюретке, пошедшей на титрование Na2CO3 и NaHCO3 (V2). 1.10. Рассчитать объем соляной кислоты, пошедшей на титрование NaНСО3 V3 в мл: V3 = V2 – 2V1 1.11. Повторить определение в том же порядке и с контрольным раствором во второй колбе. 1.12. Рассчитать среднее арифметическое из двух титрований: V1сред. и V2сред.
1.13. Рассчитать процентное содержание Na2CO3 в данной навеске по формуле: ω(Na2CO3)% = (2· V1·С(HCl)·M(½ Na2CO3)·Vм.к.·100)/(mнавески·1000·Vпип.), где M(½ Na2CO3) – молярная масса эквивалента Na2CO3; 1.14. Рассчитать процентное содержание NаНСО3 в данной навеске: ω(NaНCO3)% = (V3·С(HCl)·M(NaHCO3)·Vм.к.·100)/(mнавески·1000·Vпип.) 1.15. Рассчитать процентное одержание примесей в соде: ω(примесей)% = 100 – (ω(Na2CO3) + ω(NaНCO3)) Лабораторная работа № 4 Определение процентного содержания аммиака в солях аммония методом обратного титрования I. Теоретическое обоснование Растворы солей аммония, хотя и имеют в результате гидролиза кислую реакцию, однако выступают как очень слабые кислоты с рК = 9. Водородный показатель 0,1н раствора соли аммония определяется по формуле рН = 7 - ½ рК(осн.) - ½ lgС(соли) = 7 -1/2· 4,75 - ½· lg0,1 = 5,12 что практически соответствует нейтральной среде. Поэтому невозможно количественное определение их с достаточной степенью точности прямым титрованием какой-либо сильной щелочью (то есть невозможно правильно установить точку эквивалентности, так как изменение окраски индикатора происходит не от одной капли щелочи, а постепенно). В данном случае применим косвенный метод определения - титрование по остатку (обратное титрование). Смысл этого метода заключается в следующем: К исследуемому раствору приливают точно измеренное количестводругого вещества (промежуточное вещество), которое способно взаимодействовать как с исследуемым веществом, так и с рабочим раствором. Часть промежуточного вещества эквивалентно расходуется на взаимодействие с исследуемым, а остаток его оттитровывается рабочим раствором. Если нормальность промежуточного вещества неизвестна, то проводится контрольное титрование, для того чтобы определить объем рабочего раствора, затраченного на реакцию всего промежуточного вещества. По разности объемов всего промежуточного вещества и части его, затраченного на реакцию с рабочим раствором, находят число молей эквивалентов исследуемого вещества. В нашей работе промежуточным веществом является раствор щелочи, а рабочим раствором - соляная кислота. Щелочь с раствором соли аммония взаимодействует при нагревании по реакции: 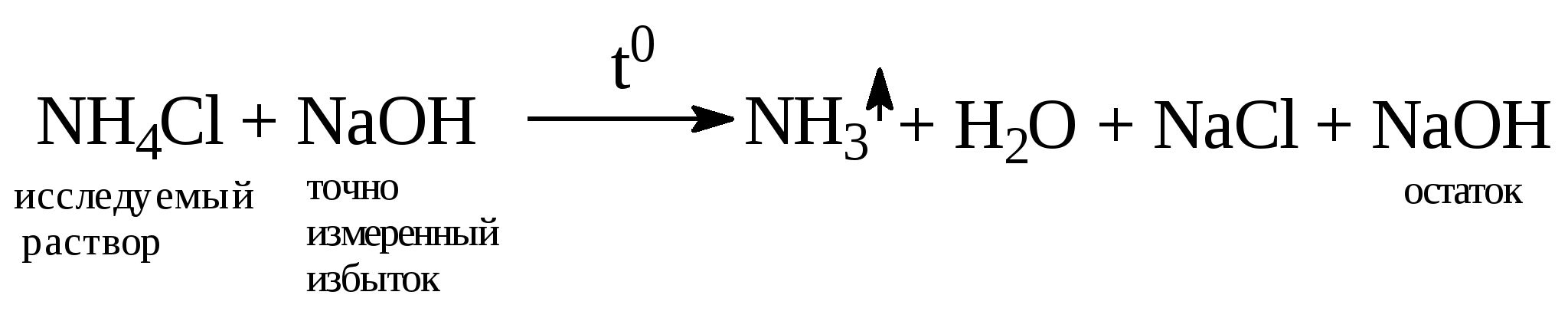 Остаток щелочи, не вошедший в реакцию с солью аммония, титруется соляной кислотой в присутствии метилового оранжевого. 2. План работы 2.1. В сухой стаканчик получить контрольную навеску кристаллической соли аммония и взвесить сначала на технических весах, а затем на аналитических с точностью до четвёртого десятичного знака. 2.2. Перенести навеску соли аммония в мерную колбу на 100,0 мл через сухую воронку и вновь взвесить стаканчик с оставшимися крупинками соли на аналитических весах и по разности масс стаканчика с солью аммония и пустого стаканчика определить навеску соли mcт. с солью – mпуст. ст. = mсоли Через эту же воронку налить в колбу холодную дистилированную воду приблизительно на ½ объёма и встряхивать до полного растворения соли, затем долить до метки водой и тщательно перемешать. 2.3. В две конические колбы на 250 мл взять пипеткой аликвоты полученного раствора (Vпип.), добавить в каждую колбу из бюретки на 50,0 мл точно измеренное, избыточное количество раствора щелочи NаОН (обычно 30 - 40 мл, V1). 2.4. Поставить колбы на электроплитку и кипятить смесь в течение 30 минут (до полного удаления аммиака по универсальной лакмусовой бумажке, смоченной водой). Так как при этом вода испаряется, то время от времени в колбы нужно доливать из промывалки дистиллированную воду приблизительно до первоначального объема. Нужно также следить, чтобы не произошло выброса раствора из колбы. Если это произошло, то данная проба испорчена и должна быть вылита. 2.5. Охладить раствор до комнатной температуры и оттитровать остаток щелочи в обеих колбах, который не вошел в реакцию с солью аммония, соляной кислотой (С(НС1)) в присутствии метилового оранжевого до перехода окраски индикатора от желтой в оранжевую. Из двух затраченных объемов HCI ( V1 и V11 ) найти среднеарифметический объем: V2 = ( V1 + V11)/2 2.6. Если С(NаОН) неизвестна, то нужно провести контрольное титрование ее следующим образом: в две колбы для титрования из бюретки на 50,0 мл прилить 15,0 или 20,0 мл раствора щелочи и оттитровать ее рабочим раствором соляной кислоты в присутствии метилового оранжевого от желтого до оранжевого. Замерить объемы HCl, пошедшие на титрование в обеих колбах,и найти среднеарифметическое значение (V3), затем затраченный объем кислоты (V3) пересчитать на то количество щелочи, которое было взято на реакцию с солью аммония (V4). Найти объем кислоты, пошедшей на титрование щелочи, эквивалентно прореагировавшей с солью аммония (V5): V5 = V4 - V2
где 2.8. Рассчитать процент ошибки. 3. Контрольные вопросы 1. Какие вещества можно использовать в качестве "промежуточных" при количественном определении методом обратного титрования (рабочий раствор - щелочь): а) карбоната кальция; б) металлического магния? 2. В чем смысл метода обратного титрования? 3. Что означает понятие "контрольное титрование"? 4. Как определить, что при кипячении соли аммония со щелочью аммиак полностью удален? 5. Какое значение имеет тот или иной порядок титрования? Что такое свидетели и для чего они применяются? 6. Практическое применение методов кислотно-основного титрования. Лабораторная работа № 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||










 1
1
 2
2