|
|
УМП КОЛИЧ.АНАЛИЗПрактическое руководство. Учебное пособие по количественному химическому анализу Учеб пособие. Уфа Издво угнту, 2005. 111 с
Техника безопасности
При выполнении работ, связанных с применением серной кислоты, соблюдать обычные меры предосторожности при работах с кислотами:
а) при попадании кислоты на кожу быстро смыть проточной водой и обработать 5%-ным раствором соды;
б) при попадании кислоты в глаза их нужно промыть большим количеством воды и обязательно обратиться к врачу.
При работе с мерной пипеткой для набора жидкости нужно пользоваться резиновой грушей, конец пипетки необходимо опускать глубоко в жидкость, чтобы не произошло засасывания её в грушу.
2.2 Лабораторные работы
Перманганатометрия
Лабораторная работа №1
Определение нормальности раствора Сн(Na2C2O4) на основании уравнения:
2MnO4- + 5C2O42- + 16H+ → 2Mn2+ + 10CO2 + 8H2O (6)KMnO4 по оксалату натрия
План работы
Приготовление раствора исходного вещества.
Вычислить навеску, необходимую для приготовления 100,0 мл 0,05 н раствора Na2C2O4. Молярная масса эквивалента оксалата натрия равна ½
и полуреакции:
С2О42- - 2е = 2СО2
½ М(Na2C2O4) = ½ 134,00 = 67,00 г/моль

где: Vм.к. – объем мерной колбы;
С(1/2Na2C2O4) – концентрация приготовляемого раствора;
½ М(Na2C2O4) – молярная масса эквивалента оксалата натрия.
На аналитических весах взять точную навеску около рассчитанного количества и перенести ее без потерь в мерную колбу на 100,0 мл одним из способов, описанных в методе нейтрализации, растворить в теплой дистилированной воде, охладить до комнатной температуры, довести раствор до метки и тщательно перемешать, предварительно закрыв колбу пробкой.
Вычислить титр и нормальность приготовленного раствра оксалата натрия по формулам: Т = m(Na2C2O4)/100 (г/мл)
C(½ Na2C2O4) = 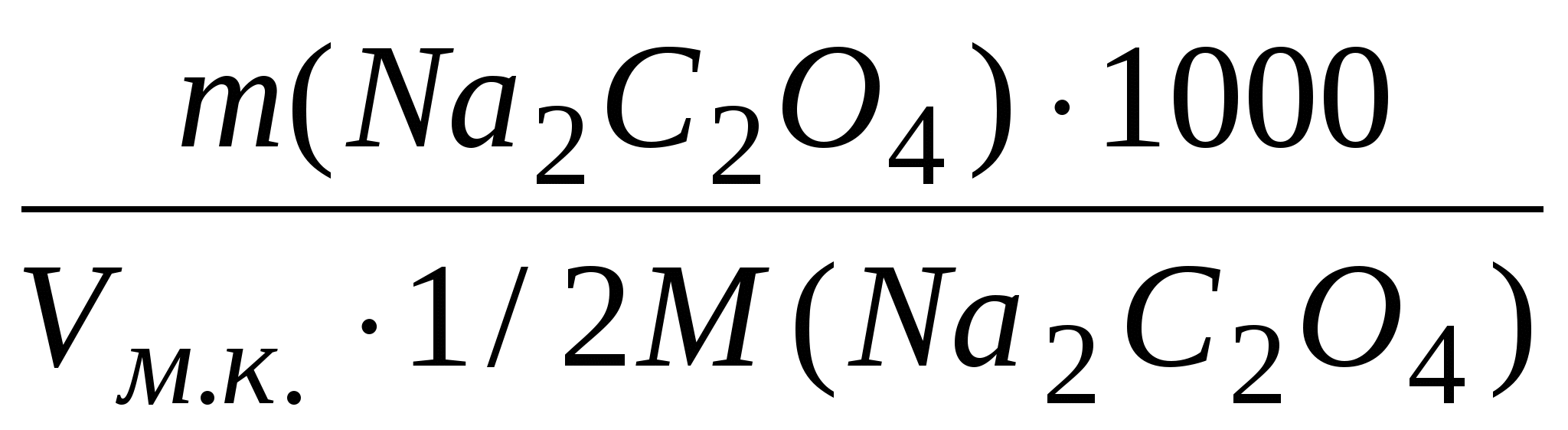
с точностью до четырех значащих цифр.
Определение нормальности KMnO4 по оксалату натрия
Заполнить бюретку на 25,00 мл раствором перманганата калия и установить уровень жидкости на нуле по верхнему мениску.
В две конические колбы для титрования на 250 мл отмерить пипеткой на 15,00 или 20,00 мл аликвоту раствора оксалата натрия.
В эти же колбы прилить цилиндром по 15 мл 2н. раствора серной кислоты (нужно добавлять достаточное количество кислоты, так как она нейтрализуется в процессе титрования). В случае недостатка кислоты во время титрования образуется бурый осадок MnO2, что недопустимо!
Реакция между перманганатом и оксалатом идет очень медленно. Для ускорения ее непосредственно перед титрованием содержимое каждой колбы нагреть почти до кипения (до 70-800С), но не давать кипеть, чтобы не произошло разложения щавелевой кислоты.
Титровать горячий раствор оксалата натрия перманганатом калия медленно, обесцвечивая каждую каплю. Первые капли KMnO4 обесцвечиваются медленно, но как только образуется немного ионов Mn2+, являющихся катализатором данной реакции, дальнейшее обесцвечивание происходит практически мгновенно. Нужно уловить момент, когда одна лишняя капля перманганата окрасит раствор в бледно-розовый цвет, не исчезающий в течение 30 сек. Записать полученный объем по бюретке (V1). Нагреть аликвоту оксалата во второй колбе и оттитровать таким же образом. Записать объем (V2) (разница между объемами не должна превышать 0,20 мл). Из двух отсчетов определить среднее арифметическое:
(V1 + V2)/2 = Vср.
2.6. Вычислить нормальность перманганата калия по формуле:
С(1/5 KMnO4) = 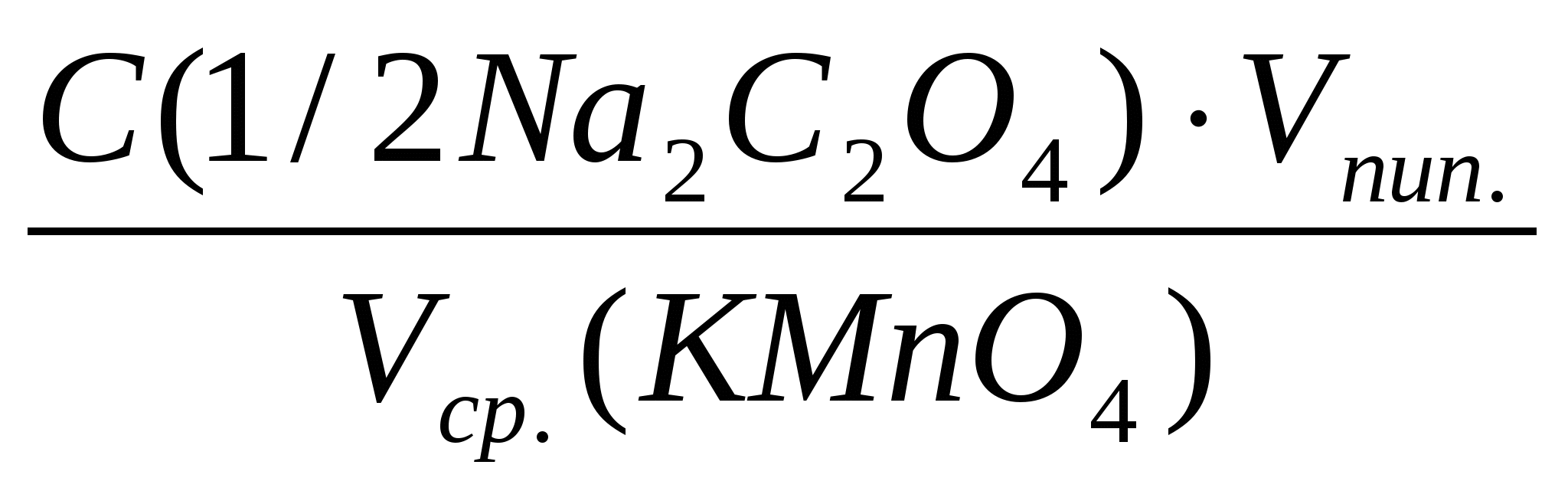 , моль/л , моль/л
с точностью до четырех значащих цифр и показать результат преподавателю.
Лабораторная работа №2
Определение миллиграммового содержания железа (II) в солях,
рудах и технических материалах
Ионы железа (II) легко окисляются перманганатом калия в кислой среде до иона железа (III) по реакции:
MnO4- + Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
Если для анализа дан твердый образец, то его предварительно надо измельчить и растворить в соответствующем растворителе (чаще всего в кислоте). Если исследуемый раствор содержит примеси железа (III) и если нужно определить железо (III) перманганатометрически, то его предварительно необходимо восстановить до железа Fe2+, для чего используют хлорид олова (II) в солянокислой среде.
План работы
Заполнить бюретку раствором KMnO4 известной нормальности и установить уровень жидкости на нуле по верхнему мениску.
В мерную колбу на 100 мл получить неизвестный объем раствора соли железа (II), довести до метки дистилированной водой и тщательно перемешать.
В две колбы для титрования на 200-250 мл прилить пипеткой на 15 или 20 мл аликвоту анализируемого раствора из мерной колбы.
В эти же колбы прилить цилиндром по 15 мл 2н H2SO4.
Титровать содержимое колбы раствором перманганата при комнатной температуре до появления неисчезающей в течение 30 с бледно-розовой окраски. Раствор титранта KMnO4 приливать с такой скоростью, чтобы капли можно было сосчитать.
Записать объемы по бюретке (V1 и V2) соответственно титрованию первой и второй колб и рассчитать средний арифметический объем:
(V1 + V2)/2 = Vср.
Вычислить с точностью до четырех значащих цифр массу железа (II) в миллиграммах по формуле:
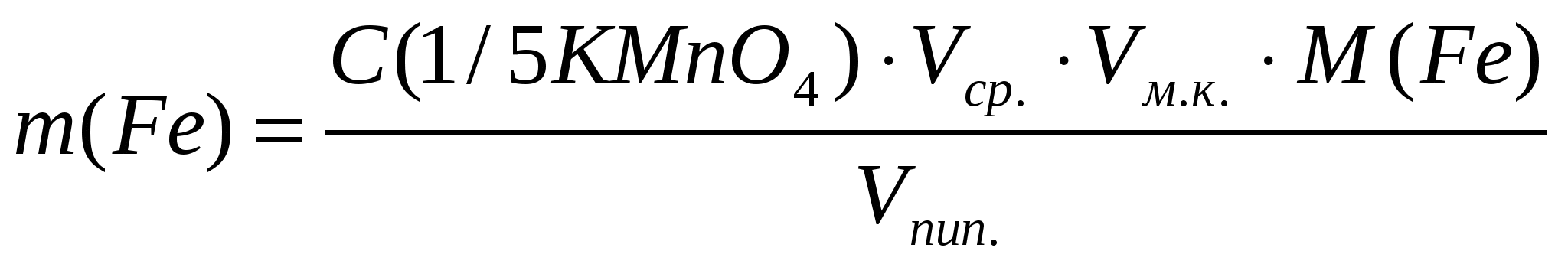 , мг , мг
где: С(1/5KMnO4) – концентрация перманганата калия;
М(Fe) – молярная масса эквивалента железа (Fe2+ + 1e=Fe3+),
M(Fe)=55,84 г/моль;
Vср. – среднеарифметический объем КМnO4, пошедший на титрование аликвоты, мл;
Vм.к. – объем мерной колбы, мл;
Vпип. – объем пипетки, мл.
Показать преподавателю выполненную работу, получить у него правильный результат и вычислить процент относительной ошибки:
% отн. ошибки = 
Ошибка не должна превышать ±2%. Если она превышает два процента, то необходимо проанализировать выполнение работы и по указанию преподавателя повторить ее. В ходе всей работы необходимо аккуратно вести записи в лабораторном журнале, включая все рассчеты.
|
|
|
 Скачать 1.33 Mb.
Скачать 1.33 Mb.