|
|
УМП КОЛИЧ.АНАЛИЗПрактическое руководство. Учебное пособие по количественному химическому анализу Учеб пособие. Уфа Издво угнту, 2005. 111 с
Лабораторная работа №4
Установка нормальности рабочего раствора тиосульфата натрия
Одним из исходных веществ, по которому можно установить нормальность Na2S2O3, является K2Cr2O7.
План работы
Рассчитать навеску бихромата калия, необходимую для приготовления 100,00 мл приблизительно 0,02н раствора K2Cr2O7 по формуле:

Молярная масса эквивалента K2Cr2O7 находится по уравнению полуреакции:
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O
и равна:
1/6M(K2Cr2O7) = 49,03г
На аналитических весах обычным путем взять точную навеску бихромата калия в пределах от 0,0900 до 0,1100 г.
Перенести без потерь навеску в мерную колбу на 100,00 мл и растворить в холодной дистилированной воде. Довести содержимое колбы до метки водой. Перемешать.
Вычислить титр и нормальность полученного раствора бихромата калия c точностью до четырех значащих цифр:
Т = m(K2Cr2O7)/Vм.к.
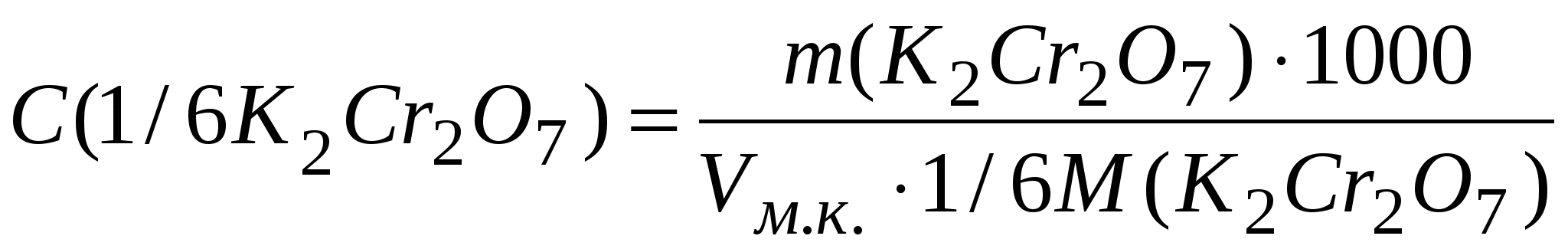
Заполнить бюретку раствором тиосульфата натрия.
В две конические колбы на 250 мл отмерить мензурками 10-15 мл раствора KI и 10-15 мл 2н раствора H2SO4 (если при смешивании растворов появляется желтая окраска иода, то к полученной смеси нужно прилить одну или две капли тиосульфата до обесцвечивания раствора).
В эти же колбы пипеткой отмерить аликвотную часть бихромата калия из мерной колбы, закрыть крышкой или пробкой и поставить в темноту на 5 минут для завершения реакции окисления иодид-иона до иода бихроматом калия.
Затем снять крышку, ополоснуть ее над колбой из промывалки и разбавить содержимое колбы водой приблизительно вдвое для уменьшения интенсивности зеленой окраски соли хрома (III).
Титровать выделившийся иод тиосульфатом натрия сначала быстро до светло-желтого цвета без индикатора, затем прилить 9-10 капель крахмального клейстера и, не доливая бюретки, продолжать титрование медленно до перехода окраски раствора от голубой до бледно-зеленой. Записать объем по бюретке V1. Таким же образом оттитровать иод во второй колбе. Записать объем V2 и вычислить Vср (Na2S2O3).
Вычислить нормальность тиосульфата натрия по данной формуле с точностью до четырех значащих цифр :
С(Na2S2O3) = 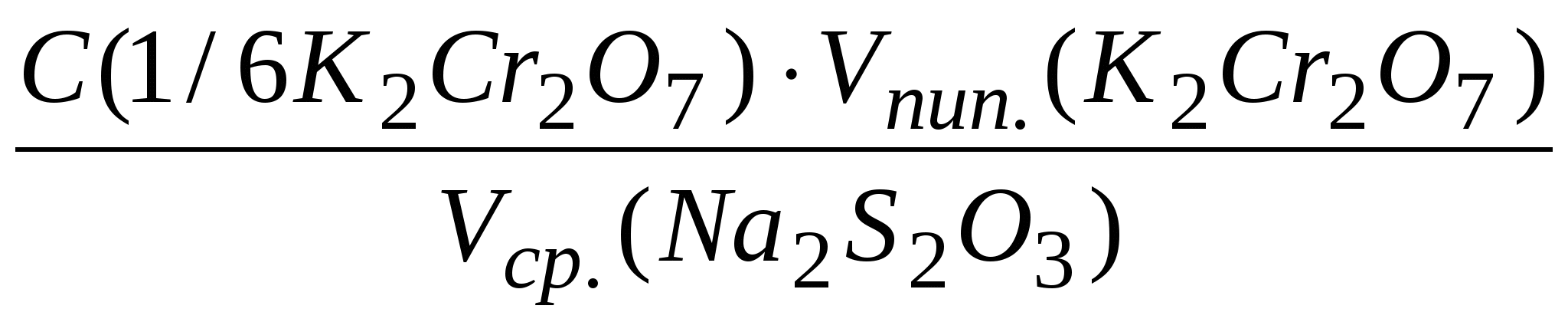
Лабораторная работа №5 Определение миллиграммового содержания меди в сульфате меди
Иодометрическое определение меди основано на реакции:
2Cu2+ + 4I- = 2CuI + I2 (14)
-
2
|
Сu2+ + 1ē = Cu+
|
1
|
2I- - 2ē = I2
|
Молярная масса эквивалента меди равна молярной массе атома меди 63,54 г. Нормальный окислительно-восстановительный потенциал пары 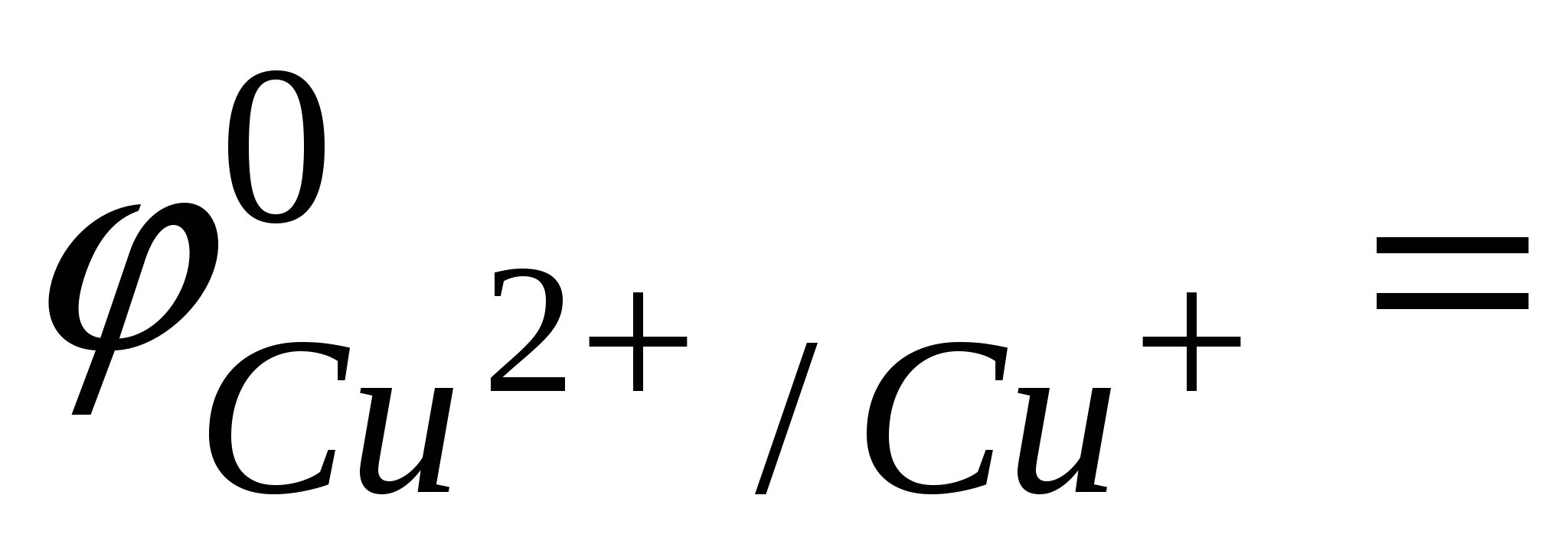 0,17 B, т.е. меньше потенциала пары 0,17 B, т.е. меньше потенциала пары 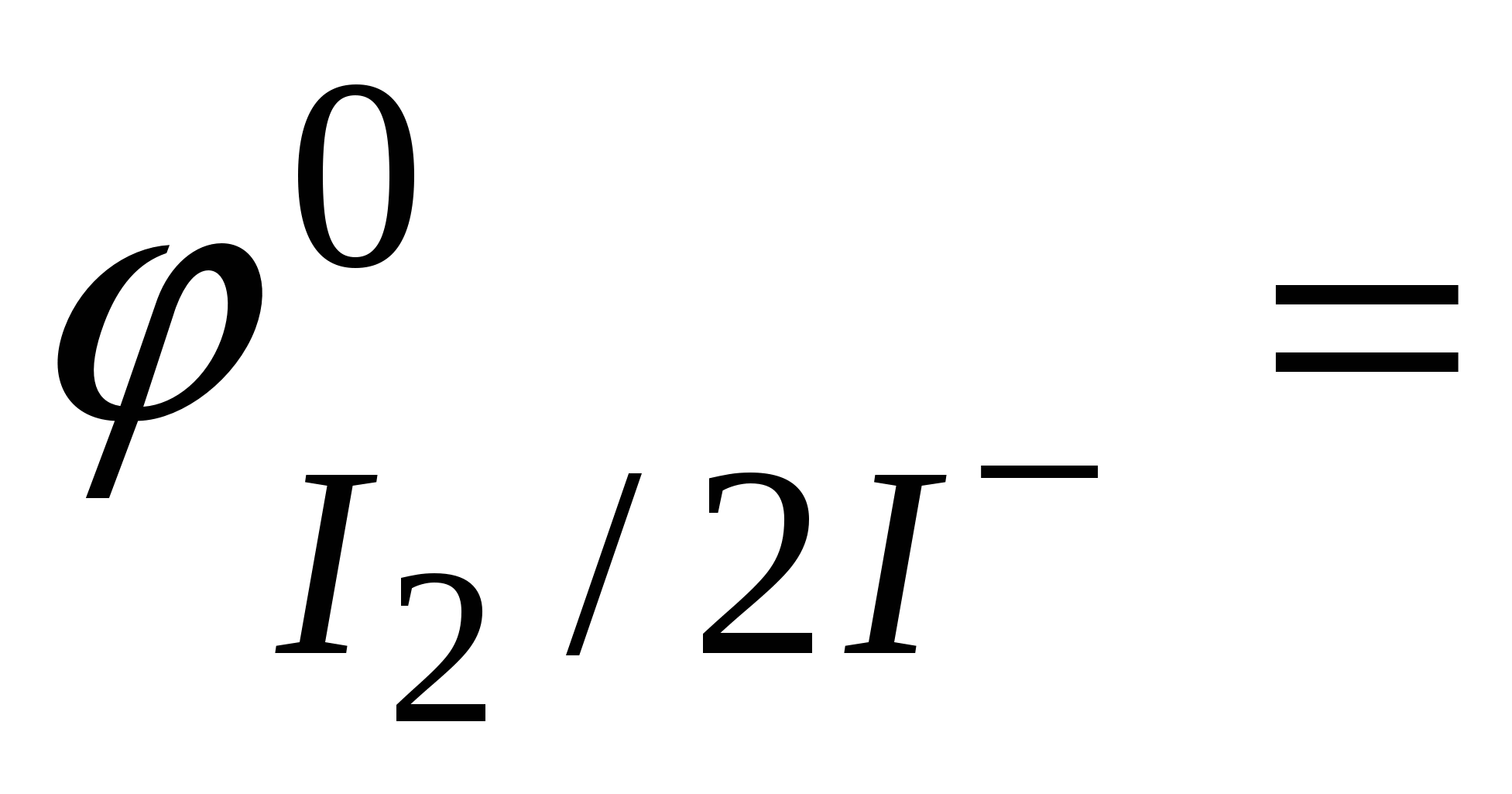 0,54 B. Однако, в этой реакции окислителем является ион Cu2+ и происходит это потому, что концентрация иона Cu+ сильно уменьшается из-за малой растворимости иодида меди (I) (ПРCuI = 10-12), в результате чего потенциал пары Cu2+/Cu+ становится больше величины 0,54 В. Если принять концентрацию иодид-иона равной 10-1 моль/л, то концентрация иона Cu+, найденная из произведения растворимости, равна: 0,54 B. Однако, в этой реакции окислителем является ион Cu2+ и происходит это потому, что концентрация иона Cu+ сильно уменьшается из-за малой растворимости иодида меди (I) (ПРCuI = 10-12), в результате чего потенциал пары Cu2+/Cu+ становится больше величины 0,54 В. Если принять концентрацию иодид-иона равной 10-1 моль/л, то концентрация иона Cu+, найденная из произведения растворимости, равна:
[Cu+] = ПР[CuI]/[I-] = 10-12/10-1 = 10-11 моль/л
Подставив эту величину в уравнение Нернста, можно найти величину потенциала пары Cu2+/Cu+:
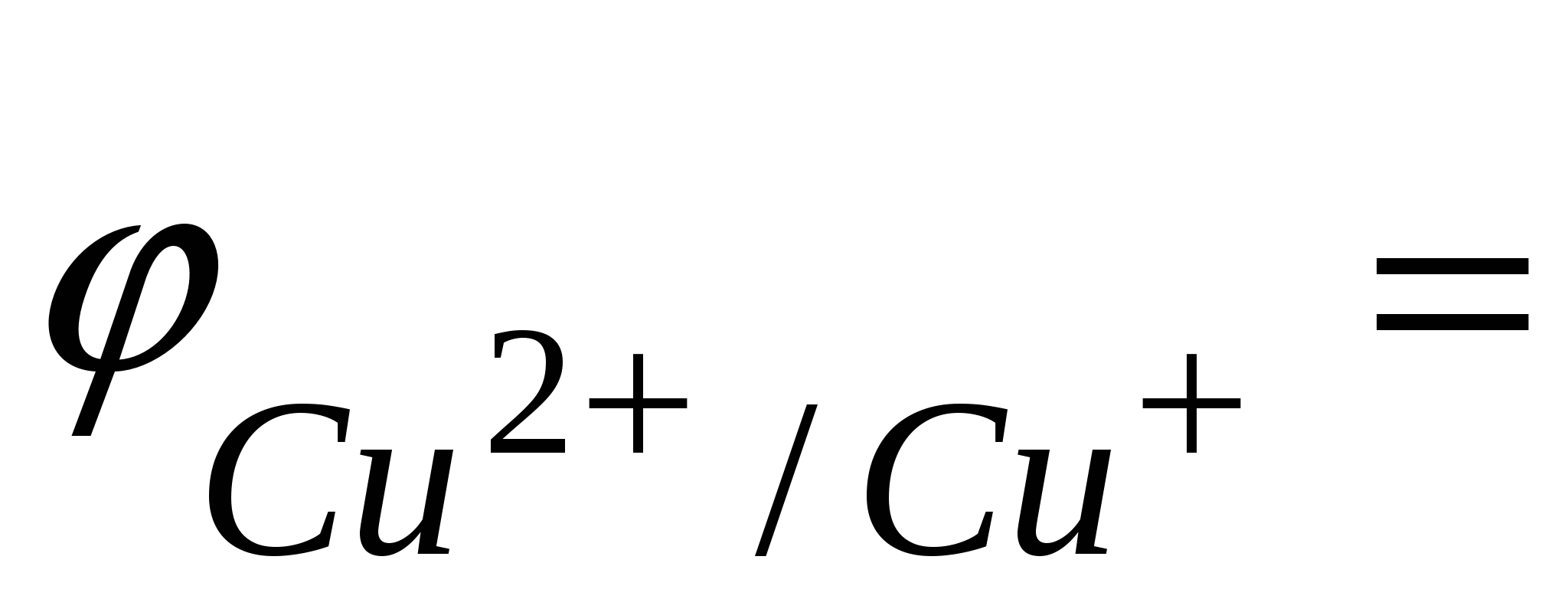 0,17 + 0,059lg([Cu2+]/10-11) = 0,808 + 0,059lg([Cu2+]) 0,17 + 0,059lg([Cu2+]/10-11) = 0,808 + 0,059lg([Cu2+])
и в результате такой величины
Δ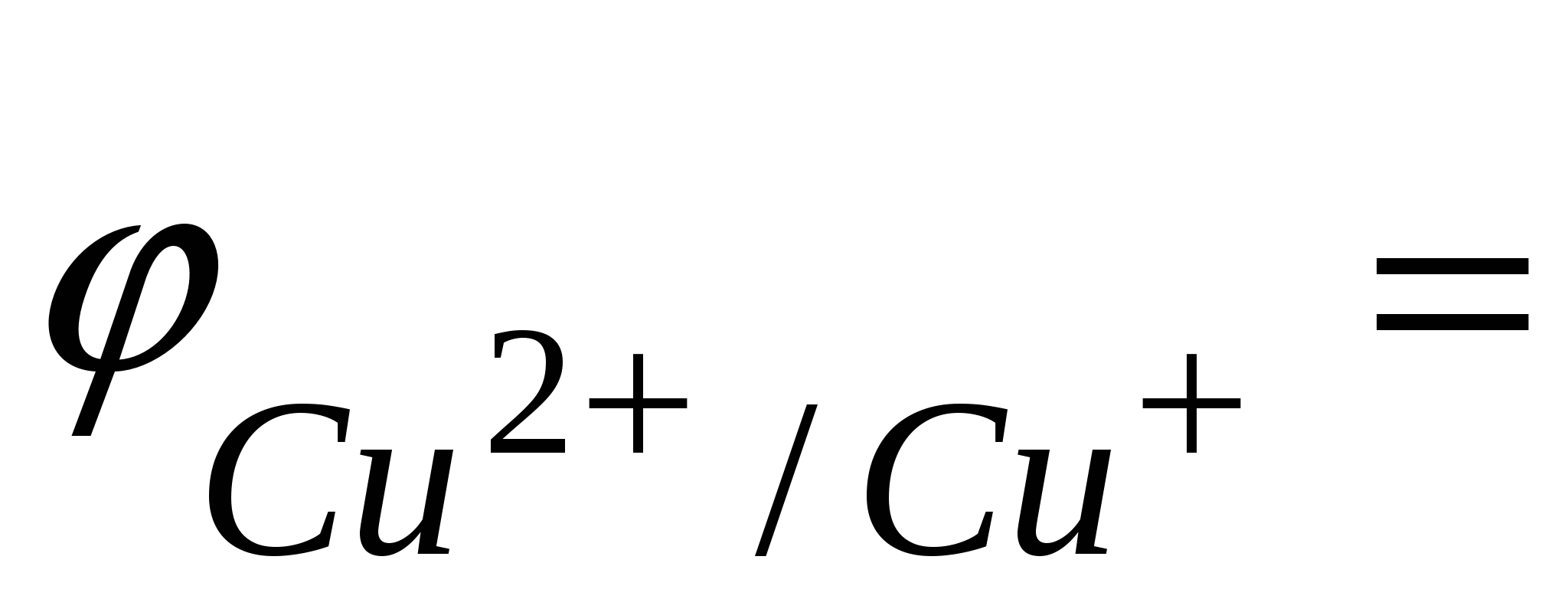 0,808 + 0,059lg[Cu2+] 0,808 + 0,059lg[Cu2+]
Δ реакции (14)становится больше нуля и реакция практически протекает. реакции (14)становится больше нуля и реакция практически протекает.
Раствор сульфата меди перед анализом нужно подкислить для подавления реакции гидролиза.
План работы
В мерную колбу на 100,00 мл получить подкисленный раствор сульфата меди, довести до метки водой, перемешать.
В две колбы для титрования отмерить мензуркой 10-15 мл 10%-ного раствора KI, подкислить несколькими каплями серной кислоты, обесцветить тиосульфатом.
Пипеткой прилить в колбы аликвотную часть исследуемой соли меди, закрыть пробкой или крышкой и поставить в темноту на 5 минут для завершения реакции.
Заполнить бюретку раствором тиосульфата натрия.
Титровать выделившийся иод тиосульфатом сначала до светло-желтого цвета, затем прилить в колбу 9-10 капель крахмального клейстера и продолжать титрование до исчезновения голубой окраски (остается белый осадок CuI). Записать объем V1. Таким же образом оттитровать иод во второй колбе и записать объем V2. Рассчитать среднеарифметический объем Vср(Na2S2O3).
Рассчитать массу меди по формуле:
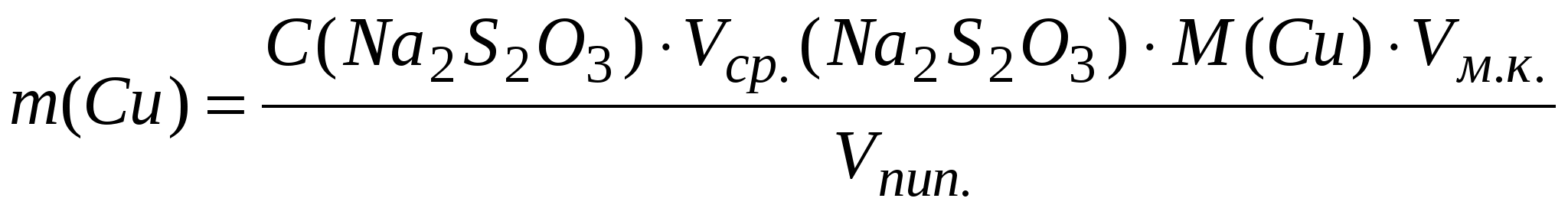 мг; мг;
Показать результат преподавателю и, получив у него правильный результат (mтеор.), определить относительную ошибку анализа:
%отн. ошибки = 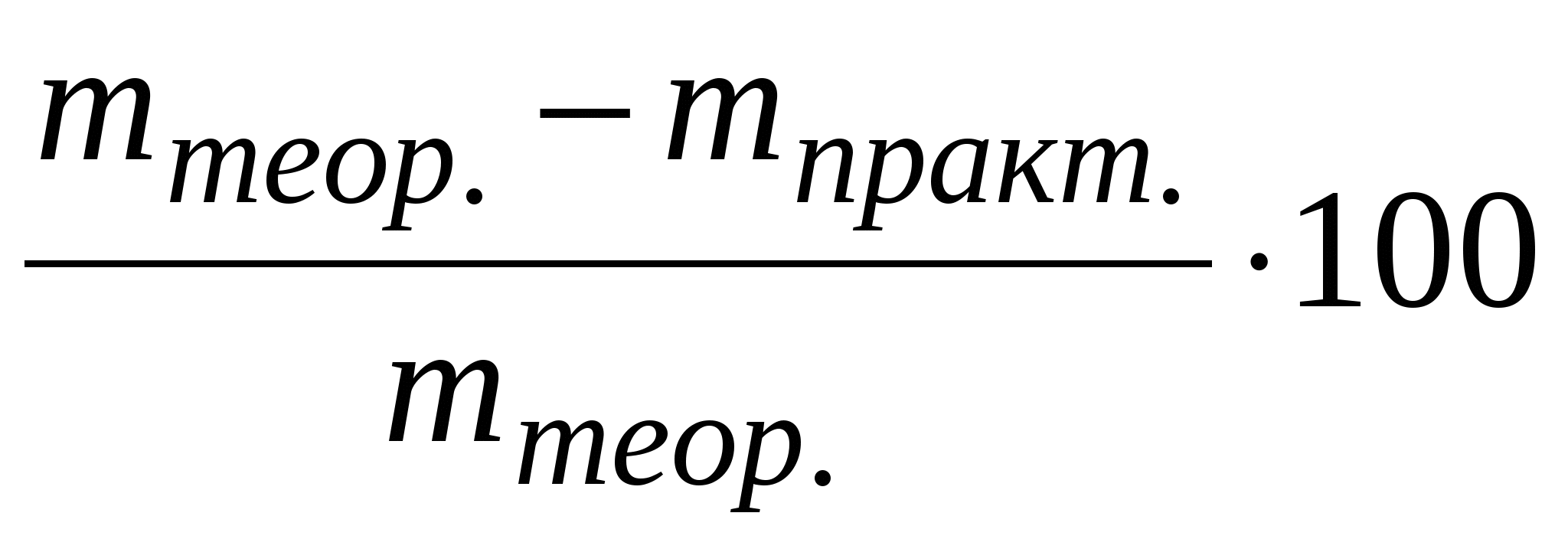
2.3. Задачи и примеры решений
Контрольные вопросы
Напишите уравнение Нернста и поясните значение всех входящих в него величин.
Как определить направление реакции окисления-восстановления и полноту ее протекания?
Выведите формулу для расчета константы равновесия реакции окисления-восстановления.
Какими способами фиксируется точка эквивалентности в методах окисления-восстановления? Привести конкретные примеры.
Как связан интервал перехода редокс-индикатора с его стандартным окислительно-восстановительным потенциалом?
Какие реакции называются автокаталитическими? Показать механизм автокатализа на конкретном примере.
Какие условия (температура, рН, скорость добавления титранта) необходимо соблюдать при титровании оксалата натрия раствором KMnO4? Дать необходимые пояснения.
Почему оксалат натрия является более удобным исходным веществом для установки титра KMnO4, чем щавелевая кислота?
Привести примеры перманганатометрического титрования: прямого, обратного и по методу замещения.
Как зависит величина скачка на кривой титрования в методах окисления-восстановления от концентрации исходных растворов, концентрации ионов водорода, разности стандартных потенциалов окислителя и восстановителя?
Какие из указанных рабочих (стандартных) растворов являются приготовленными, а какие – установленными: KMnO4, K2Cr2O7, KBrO3, I2?
Почему рабочие растворы KMnO4 и Na2S2O3 нельзя использовать сразу после приготовления? Что происходит с этими растворами при хранении? Привести уравнения соответствующих реакций.
Какие установочные вещества (первичные стандарты) используют при стандартизации растворов: а) KMnO4; б) Na2S2O3? Привести уравнения химических реакций и определить молярные массы эквивалентов.
В каких случаях и почему при редоксиметрических титрованиях рекомендуется нагреть анализируемый раствор?
Какие рабочие растворы используют при обратном титровании в методе: а) перманганатометрии; б) иодометрии? Привести примеры определений.
Предложить два различных метода определения MnO2 в пиролюзите. Записать уравнения химических реакций, расчетные формулы.
Как изменится (понизится, повысится, останется неизменной) точность перманганатометрического определения ионов Fe2+, если в раствор ввести: а) «защитную смесь»; б) избыток фторида натрия?
Почему реакцию окисления Cr3+ перекисью водорода выполняют в щелочной среде, а не в кислой?
Что представляют собой окислительно-восстановительные индикаторы? Какой химический процесс является причиной изменения их окраски?
Охарактеризуйте окислительно-восстановительную способность пары иод – иодид-ион.
II. Оценка возможности протекания реакций
Пример: Можно ли действием MnO4- в кислой среде окислить ион Sb3+ до иона Sb5+?
Решение: По таблице находим величины стандартных окислительно-
восстановительных потенциалов:
φ0 MnO4-/Mn2+ = +1,51 B; φ0 Sb5+/Sb3+ = +0,671 B;
Рассчитаем Δ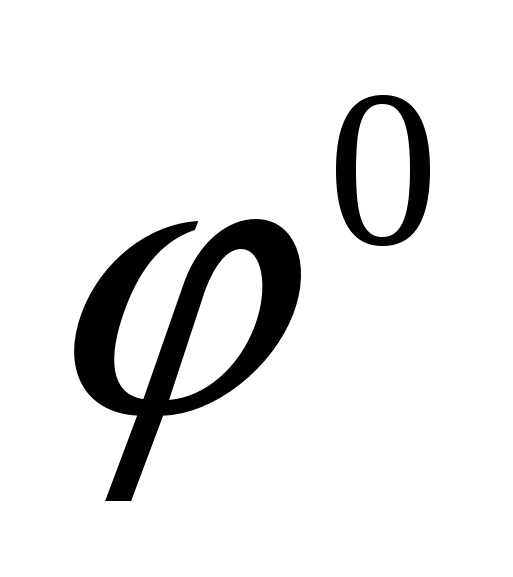 реакции: реакции:
Δ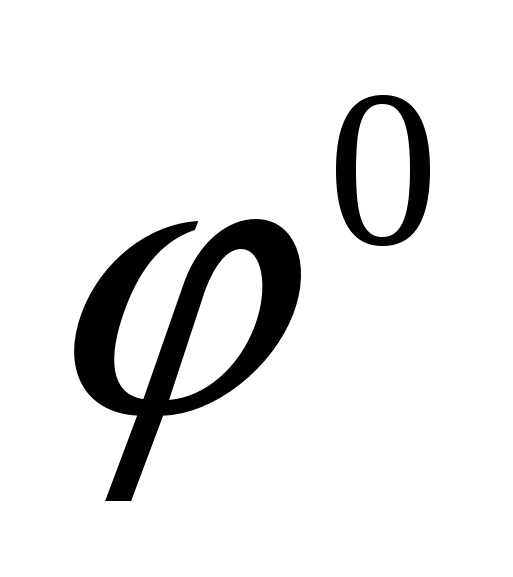 реакции = 1,51 – 0,671 = 0,839 В; так как Δ реакции = 1,51 – 0,671 = 0,839 В; так как Δ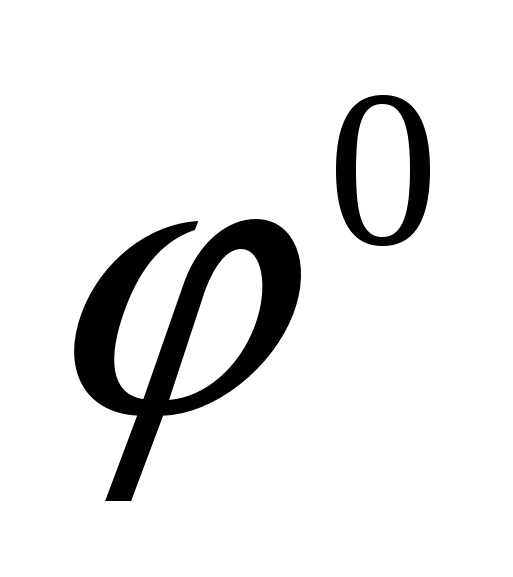 имеет положительное значение, следовательно реакция возможна: имеет положительное значение, следовательно реакция возможна:
5Sb3+ + 2MnO4- + 16H+ = 5Sb5+ + Mn2+ + 8H2O
Итак, уравнение в полном виде:
5SbCl3 + 2KMnO4 + 16HCl = 5SbCl5 + 2MnCl2 + 2KCl + 8H2O
Можно ли:
1. Действием Cl2 окислить SnCl2 в SnCl4?
2. Действием PbO2 в кислой среде окислить Cl- в Cl2?
3. Действием HNO3 окислить Mn2+ в MnO4-?
4. Действием HNO3 окислить Br- в Br2?
5. Действием HNO3 окислить Fe2+ в ионы Fe3+?
6. Действием KClO3 в кислой среде окислить I- в I2?
7. Действием KClO3 в кислой среде окислить Cl- в Cl2?
8. Действием ионов Fe2+ восстановить Cl2 в Cl-?
9. Действием ионов Fe2+ восстановить I2 в I-?
10. Действием ионов Fe2+ восстановить ионы Sn4+ в ионы Sn2+?
11. Действием ионов Fe2+ восстановить ионы MnO4- в кислой среде в ионы Mn2+?
12. Действием ионов Fe2+ восстановить ионы Сr2O72- в кислой среде в ионы Сr3+?
13.Действием K2Cr2O7 в кислой среде окислить ионы AsO33- в ионы AsO43?
14. Действием K2Cr2O7 в кислой среде окислить ионы Mn2+ в ионы MnO4-?
15. Действием K2Cr2O7 в кислой среде окислить ионы SO32- в ионы SO42?
16. Действием K2Cr2O7 в кислой среде окислить ионы SO42- в ионы S2O82-?
17. Действием I2 окислить S2O32- в ионы S4O62-?
18. Действием Mn2+ восстановить ионы S2O82- в ионы SO42-?
19. Действием С2O42- восстановить ионы MnO4- в ионы Mn2+?
20. Действием MnO4- в кислой среде окислить ионы Sn2+ в ионы Sn4+?
III. Расчет потенциалов
Пример: Вычислить окислительный потенциал пары Fe3+/Fe2+ при концен-
трациях ионов [Fe3+] = 1 моль/л; [Fe2+] = 0,0001 моль/л.
Решение: Составим схему реакции:
Fe3+ + 1e → Fe2+
Воспользуемся уравнением Нернста:
φок/вос = φ0ок/вос + 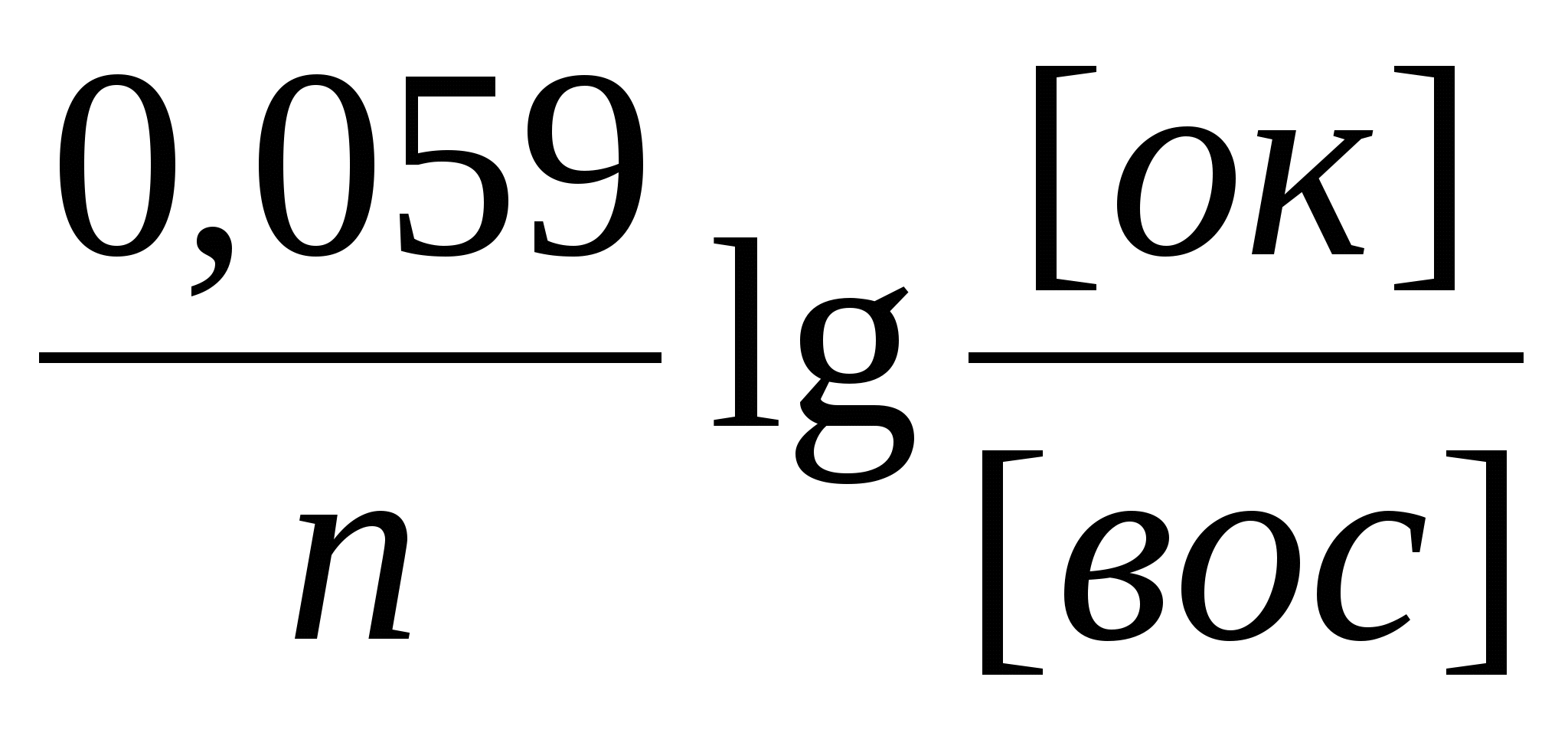 , ,
Таким образом, для пары Fe3+/Fe2+ оно будет иметь вид:
φ Fe3+/Fe2+ = φ0 Fe3+/Fe2+ + 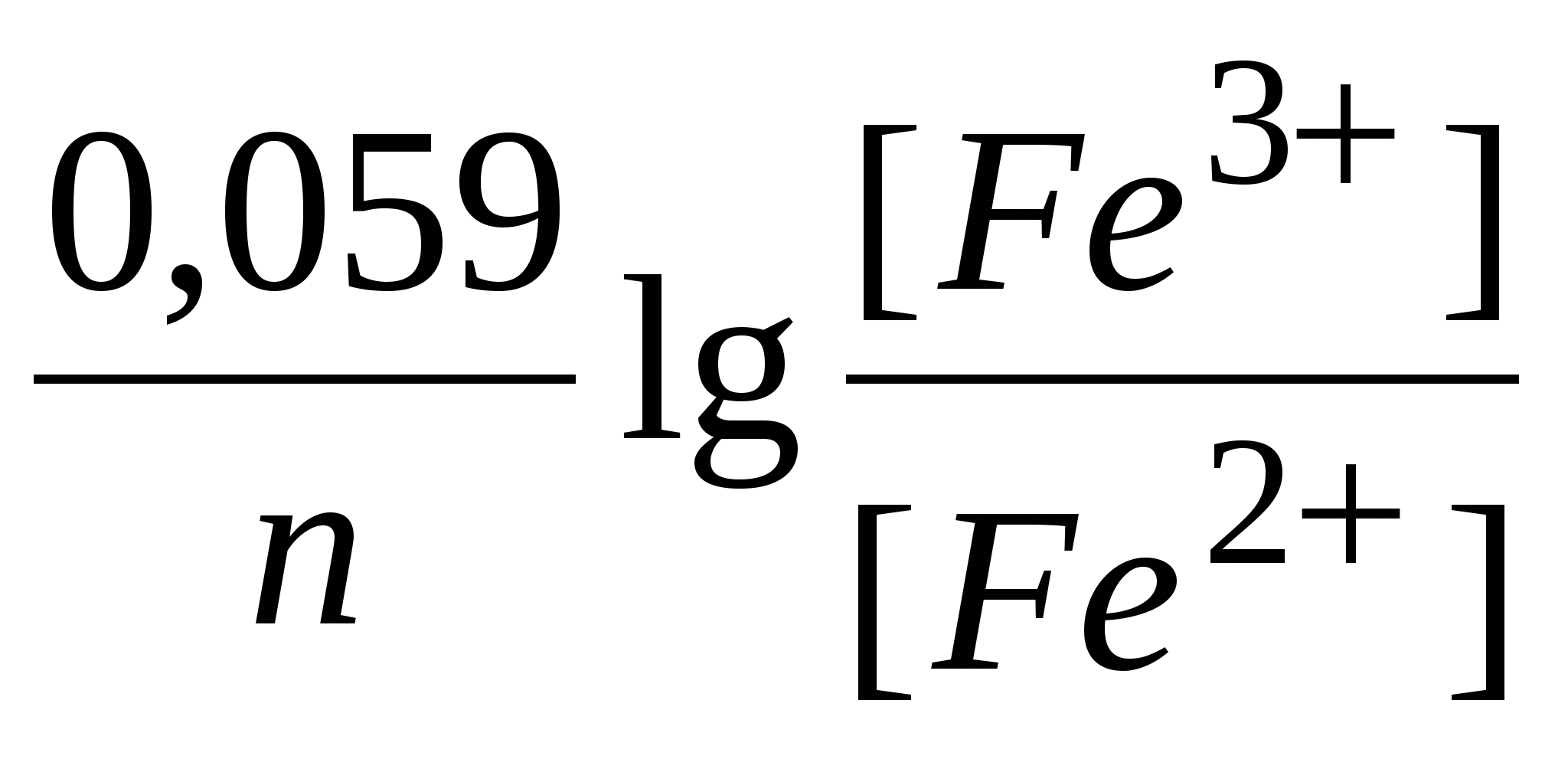 , ,
где φ0 Fe3+/Fe2+ = +0,771В; n = 1,
тогда имеем:
φ Fe3+/Fe2+ = +0,771 + 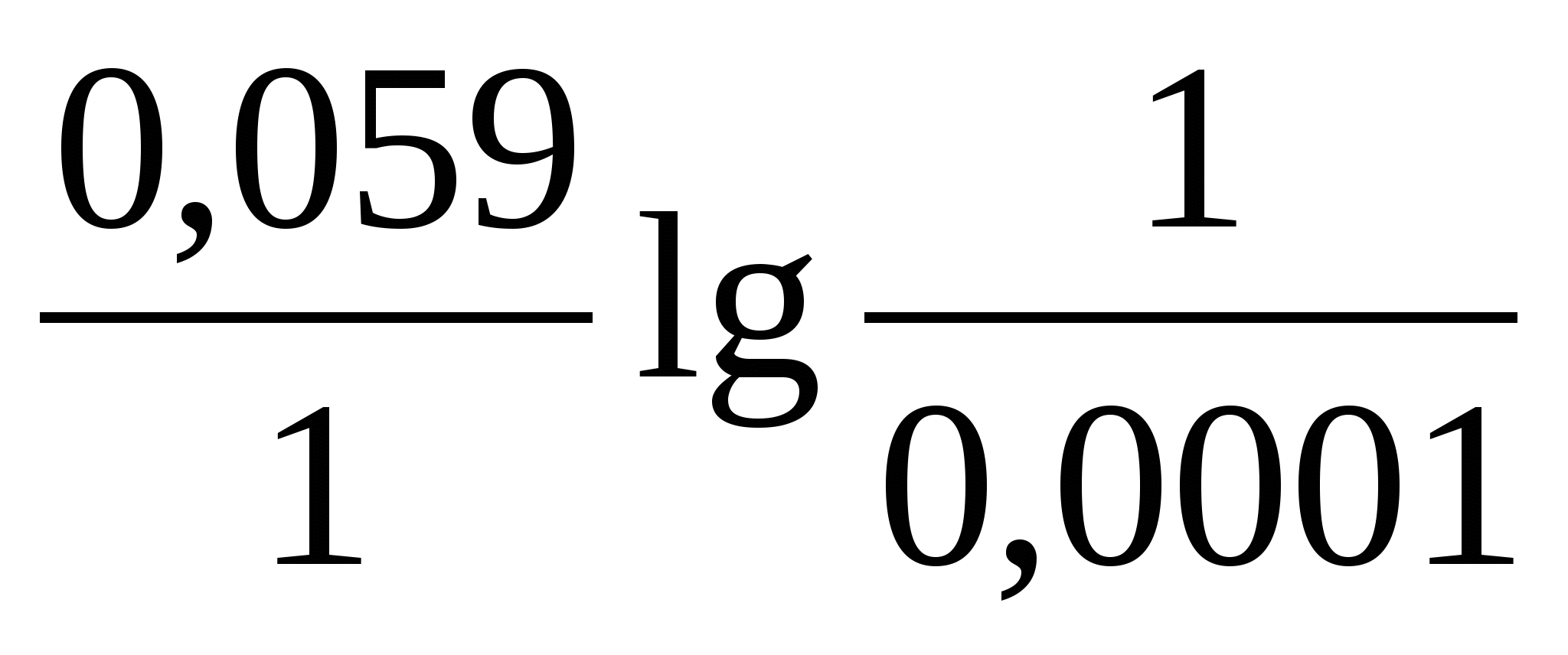 = 1,002 В = 1,002 В
Вычислить окислительный потенциал пары:
Sn4+/Sn2+ при концентрации ионов [Sn4+] = 0,1 моль/л, ионов [Sn2+] = 0,0001 моль/л.
Cd2+/Cd0 при концентрации ионов [Cd2+] = 0,2 моль/л.
Mn2+/Mn0 при концентрации ионов [Mn2+] = 0,2 моль/л.
MnO4-/Mn2+ при концентрации ионов [H+] = 10-5 моль/л, [MnO4-] = [Mn2+].
PbO2/Pb2+ при концентрации ионов [Pb2+] = 0,5 моль/л, [H+] = 0,1 моль/л.
Сu+/Cu0 при концентрации ионов [Cu+] = 0,01 моль/л.
AsO43-/AsO33- при концентрации ионов [AsO43-] = 0,1 моль/л, [AsO33-] = 0,01 моль/л, [H+] = 0,1 моль/л.
Ni+2/Ni0 при концентрации ионов [Ni+2] = 0,4 моль/л.
NO3-/NO2- при концентрации ионов [NO3-] = 0,2 моль/л, [NO2-] = 0,15 моль/л, [H+] = 0,01 моль/л.
Fe3+/ Fe2+ при концентрации ионов [Fe3+] =0,001 моль/л, [Fe2+] =0,01 моль/л.
BrO3-/ BrO- при концентрации ионов [BrO3-] =0,01 моль/л, [BrO-] =0,1 моль/л, [OH-] = 0,1 моль/л.
IO3-/ IO- при концентрации ионов [IO3-] =0,2 моль/л, [IO-] =0,1 моль/л, [OH-] = 0,01 моль/л.
Cr2O72-/ 2Cr3+ при концентрации ионов [Cr2O72-] =0,3 моль/л, [Cr3+] =0,5 моль/л, [H+] = 0,1 моль/л.
Br2/ 2Br- при концентрации ионов [Br-] =0,2 моль/л.
PO43-/ PO33- при концентрации ионов [PO43-] =0,2 моль/л, [PO33-] =0,3 моль/л, [H+] = 0,1 моль/л.
CrO42-/ Cr3+ при концентрации ионов [CrO42-] =0,1 моль/л, [Cr3+] =0,2 моль/л, [H+] = 0,1 моль/л.
C2O42-/CO2 при концентрации ионов [C2O42-] =0,2 моль/л, [H+] = 0,1 моль/л.
S4O62-/S2O32- при концентрации ионов [S4O62-] =0,2 моль/л, [S2O32-] = 0,3 моль/л.
SO42-/H2S при концентрации ионов [SO42-] = 0,5 моль/л, [H+] = 0,1 моль/л.
NO3-/NO при концентрации ионов [NO3-]=1 моль/л, [H+] = 0,1 моль/л.
IV. Составление окислительно-восстановительных реакций
Пример: As2S3 + NO3- → AsO43- + NO+SO42-
Решение: Находим по таблице значения окислительно-восстановительных потенциалов:
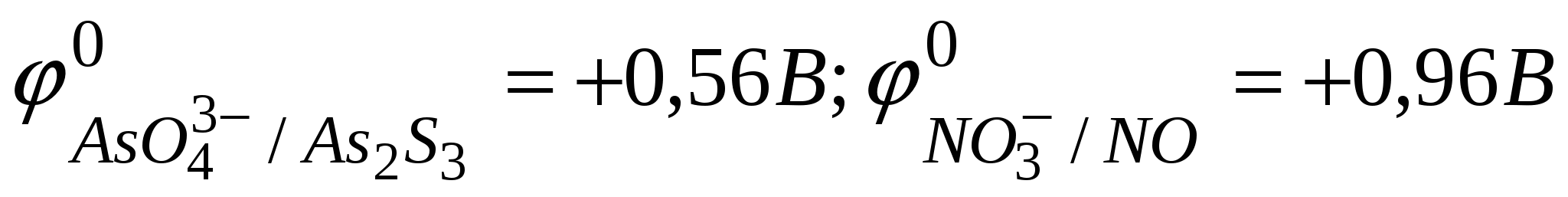
Таким образом, окислителем является N+5(ион NO3-), а восстановителем As+3 (As2O3). Исходя из величин ОВП рассчитаем ЭДС реакции:
ЭДС = 0,96 – 0,56 = 0,40 В, таким образом протекание реакции возможно.
Составляем уравнение ионно-электронного баланса:
-
3
|
As2S3 + 20H2O – 28e → 2AsO43- + 3SO42- + 40H+
|
28
|
NO3- + 4H+ + 3e → NO + 2H2O
|
Таким образом:
-
3As2S3 + 4H2O + 28NO3- → 6AsO43- + 9SO42- + 8H+ + 28NO, или
|
3As2S3 + 4H2O + 28HNO3 → 6H3AsO4 + 9H2SO4 + 28NO
|
Пользуясь значениями стандартных окислительно-восстановительных потенциалов, закончить схемы и составить уравнения в молекулярной форме следующих окислительно восстановительных процессов:
а) I2 + SO32- → I- + SO42-
б) Окисление марганца (II) до перманганата персульфатом аммония (NH4)2S2O8.
а) S2- + Br2 → S↓ + Br-
б) Взаимодействие KI c HNO2 в кислом растворе.
а) As + HNO3(конц.) →
б) Окисление церия (III) до церия (IV) висмутатом натрия (NaBiO3).
а) MnO4- + H2O2 → Mn2++…
б) Окисление HAsO32- до HAsO42- кислородом воздуха.
а) Cr2O72- + H2O2 + nH+(среда) →
б) Окисление урана (IV) до урана (VI) с помощью Н2О2.
а) I2 + OH- → IO- + I-
б) Взаимодействие анилина со смесью KВrO3 и KBr в кислом растворе.
а) Sb2S3 + NO3- → SbO42-+SO42-
б) Восстановление железа (III) до железа (II) диоксидом серы.
а) As2O3 + ClO3- → AsO43-+…
б) Восстановление КbrO3 до Br2 раствором С2О42-.
а) S2- + ClO- → SO42-+…
б) Окисление азотистой кислоты раствором перманганата калия
а) Cr3+ + Br2 + n(OH)-(среда) →
б) окисление Н2О2 раствором KMnO4
а) S2- + Cr2O72- → S↓+…
б) Взаимодействия KI с IO3- в кислом растворе
а) NO2- + ClO3- → Cl-+…
б) Окисления SCN- до SO42- ионами IO3- в кислой среде (HCl)
а) C2O42- + MnO4- + nH+(среда) → СО2+…
б) Взаимодействия KI с HNO2 в кислом растворе
а) S2O32- + ClO- → Cl- + SO42-
б) Восстановления Cr2O72- до Cr3+ в кислой среде раствором KI.
а) H2O2 + Cr2O72- → CrO5+…
б) Восстановления BrO3- до Br- в кислой среде
а) Br- + Cr2O72- → Cr3++…
б) Восстановления Сu2+ до Cu+ в слабокислой среде раствором KI.
а) I- + IO3- → I2
б) Бромирования фенола
а) Cr3+ + MnO4- + nOH-(среда) →
б) Окисления Sn2+ до Sn4+ в кислой среде раствором Fe3+
а) Mn2+ + PbO2 + nH+(среда) →
б) Восстановления MnO4.- до MnO42-
а) I- + MnO4- → I2+…
б) Восстановления SbO43- до SbO33- в кислом растворе
V. Определение молярных масс эквивалентов окислителей и восстановителей в реакциях
Пример: Определить молярные массы эквивалентов сульфата меди, иона меди, йодида калия; йодид иона по реакции:
2Cu2+ + 4I- ↔ 2CuI↓ + I20
Решение: Cоставляем полууравнения:
-
2
|
Cu2+ + 1e → Cu+
|
- окислитель
|
1
|
2I- - 2e → I20
|
- восстановитель
|
2CuSO4 + 4KI → I2 + 2CuI↓ + 2K2SO4
Итак, молярная масса эквивалента сульфата меди равна:
Э(CuSO4) = М(CuSO4)/n = 159,54/1 = 159,54 г/моль
Молярная масса эквивалента меди:
Э(Cu2+) = Ат.вес/n = 63,54/1 = 63,54 г/моль
Молярная масса эквивалента иодид-иона:
Э(I-) = M(I2)/n = 2·126,9/2 = 126,9 г/моль
Молярная масса эквивалента иодида калия:
Э(KI) = M(KI)/n = 165,99/1 = 165,99 г/моль
Пример: Рассчитайте молярную массу эквивалента бромата калия KВrO3 и мышьяка (III) в окислительно-восстановительной реакции между бромат-ионом BrO3- и арсенит-ионом AsO33- в кислой среде.
Решение: Запишем соответствующие полуреакции и суммарную реакцию в ионной форме:
-
1
|
BrO3- + 6e + 6Н+ → Br- + 3H2O
|
|
3
|
AsO33- - 2e + H2O → AsO43- + 2H+
|
|
Молярная масса эквивалента или эквивалентная масса для реагента в окислительно-восстановительном процессе равна его молярной массе, поделенной на число электронов в соответствующей полуреакции:
M(1/6·KВrO3) = Э(KВrO3) = M(KВrO3)/6 = 167,0/6 = 27,833 г
M(1/2·As) = Э(As) = M(As)/2 = 74,9216/2 = 34,4608 г
Определте молярные массы эквивалентов окислителей и восстановителей:
81.Fe2+ + MnO4- + 8H+ → Fe3+ + Mn2+ + 4H2O
82. I2 + 2S2O32- → 2I- + S4O62-
83. H2O2 + 2I- + 2H+ → I2 + 2H2O
84. 6Fe2+ + Cr2O72- + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O
85. H2SO3 + I2 + H2O → SO42- + 2I- + 4H+
86. 5H2C2O4 + 2MnO4- + 6H+ → 2Mn2+ + 10CO2 + 8H2O
87. C2H4 + Br2 → C2H4Br2
88. HAsO2 + I2 + 2H2O → H3AsO4 + 2I- + 2H+
89. MnO2(тв) + 2I- + 4H+ → Mn2+ + I2 + 2H2O
90. H2S + I2 → S(тв) + 2I- + 2H+
91. 3N2H4 + 2BrO3- → 3N2 + 2Br- + 6H2O
92. 5Fe(CN)64- + MnO4- + 8H+ → 5Fe(CN)63- + Mn2+ + 4H2O
93. I2 + Cl2 + 6H2O → 2IO3- + 2Cl- + 12H+
94. AsH3 + MnO4- + H+ → AsO43- + Mn2+ + 2H2O
95. Sb3+ + MnO4- + 8H+ → Sb5+ + Mn2+ + 4H2O
96. Ag+ + H2O2 + 2OH- → O20 + Ag0 + 2H2O
97. Bi3+ + Sn2+ + 6OH- → Bi0 + SnO32- + 3H2O
98. PH3 + MnO4- + 4H2O → H3PO4 + Mn2+ + 8H+
99. Bi2S3 + NO3- + 4H+ → 2Bi3+ + 3S0 + NO0 + 2H2O
100. C2O42- + ClO3- + 2H+ → 2CO20 + ClO20 + H2O
VI. Расчеты навесок и концентраций растворов
Пример: Рассчитайте массу m навески образца с массовой долей железа (II), приблизительно равной ω(Fe) = 10%, для перманганатометрического определения железа (II) в этом образце. Молярная концентрация эквивалента железа (II) в анализируемом растворе объемом V = 25,00 мл = 0,025 л, приготовленном растворением взятой навески в воде, подкисленной серной кислотой, должна быть равна С(Fe2+) ≈ 0,05 моль/л.
Решение: В основе определения лежит реакция:
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Так как один ион Fe2+ отдает один электрон, то молярная масса эквивалента железа (II) равна в этой реакции его атомной массе.
Э(Fe2+) = M(Fe2+) = Ат. вес(Fe2+) = 55, 847 г.
Масса железа (II) m(Fe) в растворе равна:
m(Fe) = C(Fe2+)·M(Fe2+)·V = 0,05·55,847·0,025 = 0,06981 г.
Массовая доля железа равна:
ω(Fe) = m(Fe)/m(навески)·100 = 10%
Отсюда: m(навески) = 0,06981·100/10 = 0,6981 г.
Пример: Рассчитайте молярную, нормальную концентрацию, титр, титр по железу (II) и по мышьяку (III) раствора дихромата калия K2Cr2O7, полученного растворением навески m=2,2415 г дихромата калия в объеме V = 500,00 мл воды.
Решение: 1) Рассчитаем молярную концентрацию раствора:
С(K2Cr2O7) = (m·V)/M(K2Cr2O7) = (2,4515·0,5)/294,185
= 0,0167 моль/л.
2) Рассчитаем молярную концентрацию эквивалента раствора:
С(1/6·K2Cr2O7) =(m·V)/M(1/6·K2Cr2O7)=(2,4515·0,5)/49,031 = 0,1000н
Здесь фактор эквивалентности K2Cr2O7 как окислителя равен f=1/6 в соответствии с полуреакцией:
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
3) Рассчитаем титр раствора:
Т(K2Cr2O7)=(С(K2Cr2O7)·М(K2Cr2O7))/1000= (0,0167·294,185)/1000
= 0,004913 г/мл
4) Рассчитаем титр бихромата калия по железу (II):
Т(K2Cr2O7/Fe)=(С(1/6·K2Cr2O7)·М(Fe))/1000=(0,1·55,847)/1000
= 0,005585 г/мл
Здесь фактор эквивалентности железа (II) равен f=1, т.к.:
Fe2+ - 1e → Fe3+
5) Рассчитаем титр бихромата калия по мышьяку (III), учитывая, что при реакции с бихроматом калия мышьяк (III) теряет 2 электрона:
As+3 – 2e → As+5
Поэтому f = ½. Тогда:
Т(K2Cr2O7/As)=(С(1/6·K2Cr2O7)·М(½As))/1000=(0,1·37,4608)/1000
= 0,003746 г/мл
Нормальность KMnO4 равна 0,02200 г·моль/л. Чему равны титры его по Н2С2О4, по Fe и по Н2О2?
Ответ: Т(KMnO4/ Н2С2О4) = 0,0009904 г/мл
Т(KMnO4/ Fe) = 0,001228 г/мл .
Т(KMnO4/ Н2О2) = 0,0003741 г/мл .
Рассчитать массу навески Na2S2O3·5H2O, необходимую для приготовления: а) 1500 мл 0,10М раствора; б) 1500 мл раствора с титром по иоду 0,0015 г/мл.
Ответ: а) 37,23 г. .
б) 0,01269 г
Найти для 0,1010н раствора KMnO4: а) молярность; б) титр; в) титр по кислороду; г) титр по железу.
Ответ: а) 0,02020 г/мл; б) 0,003193 г/мл; .
в) 0,0008080 г/мл; д) 0,005641 г/мл
Молярность раствора HNO3 равна 0,1121н. Найти нормальность раствора, если HNO3 восстанавливается до NO.
Ответ: 0,3363н
Азотная кислота плотностью 1,185 г/см3 содержит 30,1% HNO3. Рассчитать ее нормальность в реакциях окисления, если при этом HNO3 восстанавливается до NO.
Ответ: 16,99н
Смешаны следующие растворы бихромата калия: 300 мл раствора, содержащего в этом объеме 1,56 г K2Cr2O7, 400 мл 0,0365М раствора и 250 мл 0,213н раствора; после смешения смесь разбавлена водой до 1 литра. Какова нормальность полученного раствора в реакции окисления?
Ответ: 0,172н
Выразить концентрацию 0,100н раствора KMnO4 в процентах Fe, соответствующих каждому миллилитру этого раствора, если навеску руды для определения железа берут точно 0,5000 г.
Ответ: 1,117%
Сколько миллилитров 1,000н раствора K2Cr2O7 надо прибавить к 1300 мл раствора K2Cr2O7 с титром по железу 0,004500, чтобы получился раствор с титром по железу 0,005000?
Ответ: 12,8 мл
Сколько граммов KMnO4 надо взять, чтобы приготовить 1.5 л 0,05000н раствора его для титрования в кислой среде?
Ответ: 23,7 г
До какого объема следует разбавить 500 мл 0,100н K2Cr2O7 для получения раствора с титром по железу 0,005000?
Ответ: 558,5 мл
Какой объем KMnO4 с молярной концентрацией 0,1 моль/л требуется для приготовления 100 мл раствора с молярной концентрацией 0,05 моль/л.
Ответ: 10 мл
Какой объем 0,1000н раствора KMnO4 пойдет на титрование: а) 0,15г Na2C2O4; б) навески 0,30 г руды, содержащей 43% (масс.) железа?
Ответ: а) 22 мл; б) 23 мл
Рассчитать массу навески руды, содержащей около 60% Fe2O3, чтобы при титровании раствора железа (II), полученного при обработке ее, расходовалось 15 – 25 мл 0,1000н раствора KMnO4.
Ответ: от 200 до 330 мг
Рассчитайте навеску Na2C2O4 для приготовления 100 мл стандартного раствора с молярной концентрацией эквивалента С(1/2 Na2C2O4) = 0,05 моль/л, используемого при стандартизации раствора KMnO4. Определите Т(Na2C2O4) и Т(Na2C2O4/ KMnO4).
Ответ: 0,3350 г; 0,003350 г/мл; 0,001580 г/мл.
Какую массу KMnO4 надо взять для приготовления: а) 500 мл 0,05н раствора (z = 5); б) 500 мл раствора с Т(KMnO4/Fe) = 0,005932 г/мл; в) 250 мл раствора с Т(KMnO4/СаО) = 0,005246 г/мл. Титрование ведется в кислой среде.
Ответ: а) 0,7902 г; б) 1,6786 г; в) 1,4783 г
Рассчитать навеску вещества (г), содержащего 0,3% серы, чтобы на титрование полученного из нее H2S потребовалось 10,0 мл 0,05000н I2.
Ответ: 2,672 г.
Сколько мл раствора, содержащего 25,00 г/л K2Cr2O7, эквивалентны 3,4000 г FeSO4·7H2O в кислой среде?
Ответ: 23,98 мл
Найдите массу навески K2Cr2O7 для приготовления 250 мл раствора с молярной концентрацией эквивалента С(1/6 K2Cr2O7) = 0.05 моль/л.
Ответ: 0,6129 г
До какого объема следует разбавить 10 мл раствора бромата калия KВrO3 с молярной концентрацией 0,1000 моль/л, чтобы получить раствор с Т(KВrO3/As3+) = 0,000375 г/мл.
Ответ: до 600 мл
Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, титр и титр по мышьяку (III) раствора бромата калия KВrO3, полученного растворением 0,0278 г бромата калия в 100 мл воды и предназначенного для дихроматометрического определения мышьяка (III).
Ответ: 0,0017 моль/л; 0,0100 моль/л;
2,783·10-4 г/мл; 3,75·10-4 г/мл
VII. Рассчитать область скачка титрования, окислительно-восстановительный потенциал в точке эквивалентности и подобрать индикатор при титровании
Пример1: 1) Рассчитать область скачка на кривой окислительно-восстановительного титрования раствора Fe (II) раствором Се (IV) и подобрать ОВ-индикатор.
Решение: При титровании протекает ОВ реакция:
Fe2++Ce4+Fe3++Ce3+
В реакции участвует только один электрон для обеих окислительно-восстановительных парn=1.
|
|
|
 Скачать 1.33 Mb.
Скачать 1.33 Mb.