УМП КОЛИЧ.АНАЛИЗПрактическое руководство. Учебное пособие по количественному химическому анализу Учеб пособие. Уфа Издво угнту, 2005. 111 с
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
Пример: Вычислить рН и рОН 0,05 М раствора H2SO4. (α = 1)Решение: так как Н2SO4 сильная кислота, то распадается на ионы полностью по уравнению: Н2SO4 2Н+ + SO42- концентрация иона водорода равна: Сн+ = 0,05 *2*1 = 0,1 моль/л рН = -lg 10-1 = 1; рОН = 14 - 1 = 13. Ответ: рН = 1; рОН = 13. II Вычислить концентрацию (моль/л) ионов Н+ и ОН- по величине рН или рОН:
Пример: Вычислить концентрации ионов водорода и гидроксид- иона, если рН = 9,5. Решение: рН = 9,5; 9,5 = - lg[Н+]; или lg[Н+] = -9,5: превращаем мантиссу логарифма в положительную величину, а характеристику оставляем со знаком минус: -9,5 = 10,5. Находим антилогарифм 0,5 = 3; следовательно концентрация [H+] = 3 * 10 –10 моль/л; [OH-] = Ответ: [H+] = 3 * 10-10 моль/л; [OH-] = 3,3 * 10 –5 моль/л. III Вычислить рН и рОН растворов, если:
Пример: Вычислить рН и рОН раствора слабой кислоты НСООН, если концентрация ее равна 0,04 моль/л, а константа диссоциации Кд = 1,8 * 10-4. Решение: Муравьиная кислота слабая, диссоциирует на ионы обратимо, поэтому концентрация ионов водорода не равна концентрации кислоты. [H+] находим из Кд(НСООН). НСООН Н+ + НСОО-Кд = [H+] = [HCOO-], а [HCOOH]недис. [HCOOH]исх. 1,8 * 10-4 = рН = -lg 2,68 * 10-3 = -(lg 2,68 + lg 10-3) = 3- 0,43 = 2,57 рОН = 11,43 Ответ: рН = 2,57; рОН = 11,43. IV Вычислить рН и рОН растворов, если смешали:
Пример: Вычислить рН и рОН раствора, если смешали 20,0 мл 0,1 М раствора NaOH и 19,0 мл 0,1 М раствора CH3COOH. Решение: Так как в растворе в избытке оказалось сильное основание, то оно и будет определять рН раствора, гидролизом ацетата натрия можно пренебречь. Находим [OH-]: [OH-] = рОН = -lg2,56 * 10-3 = -(lg2,56 + lg 10-3) = 3-0,4 = 2,6 рН = 14 – 2,6 = 11,4 Ответ: рН = 11,4; рОН = 2,6; V Вычислить рН и рОН растворов, если смешали:
Пример: Вычислить рН и рОН раствора, если смешали 15 мл 0,1 н раствора НСl и 20 мл. 0,1 н. NH4ОН. Решение: так как слабое основание взято в избытке, то в растворе в результате образуется щелочная буферная смесь HCl + NH4ОН NH4Cl+ Н2О + (NH4ОН) 0,1*15 0,1*20 0,1*15 избыток рН этой смеси расчитывается по формуле: рН = 14 - рК NH4ОН + lg(Cосн/Ссоли) Так как под логарифмом стоит отношение концентраций, то вместо этих концентраций логично поставить объемы. рН = 14 - 4,74 + lg(5/15) = 9,26 + lg3,3*10-1 = 9,26 - 0,48 = 8,78, где lg3,3*10-1 = (lg3,3 + lg10-1) = -1 + 0,52 = - 0,48 рОН = 14 - 8,78 = 5,22 Ответ: рН = 8,78; рОН = 5,22 VI Выбрать индикатор для титрования раствора (1) рабочим раствором (2):
Пример 1: Выбрать индикатор для титрования 0,01 н. раствора NaОН 0,01 М раствором HСl. Решение: рабочий раствор - сильная кислота и определяемое вещество - сильное основание. Для выбора индикатора нужно на кривой титрования найти рН двух точек - начала скачка и конца скачка. а) начало скачка на кривой титрования - недотитровано 0,1 от объема титруемого раствора NaОН. Так как объем не задан, то берем 100 мл. В начале недотитрована щелочь, поэтому находим концентрацию [ОН-]: [ОН-] = ( 0,01·100 - 0,01· 99,9)/ 100 = 1*10-5 моль ( принебрегаем изменением объема смеси ) рОН = 5; рН = 14 - 5 = 9 б) конец скачка - раствор перетритирован на 0,1 от объёма раствора NaOH, в избытке сильная кислота, находим концентрацию ионов водорода: [Н+] = (0,01*100,1 - 0,01*100) / 100 =1*10-5 моль/л. рН =5 Величина скачка от 9 до 5. В этом интервале происходит изменение окраски индикаторов: фенол-фталеина (рТ = 8), метилового красного (рТ=5,5, лакмуса (рТ=7). Каждый индикатор можно использовать для данного титрования. Пример 2: Выбрать индикатор для титрования 0,1 М раствора NH4ОН 0,1 м. раствором НCl. Решение: рабочий раствор - сильная кислота, определяемое вещество - слабое основание. а) Начало скачка на кривой титрования - в избытке раствор аммиака NH4ОН + НCl = NH4Cl+ H2О + (NH4ОН) 100 мл. 99,9 мл. 99,9 мл. 0,1 мл. (избыток) образуется аммиачная буферная смесь рН = 14 - рК NH4ОН + lg(Сосн/Ссоли) рН = 14 - 4,74 + lg(0,1/99,9) = 9,26 - 3 = 6,26 б) конец скачка - в избытке сильная кислота. Находим концентрацию ионов водорода:[Н+] = (0,1·100,1 - 0,1 ·100)/100 = 10-4 моль/л, рН = 4 Интервал скачка рН от 6,26 до 4. 4. В этом интервале происходит изменение окраски индикаторов метилового красного (рТ = 5,5) и метилового оранжевого (рТ = 4). VII Вычислить эквивалентную массу вещества (А), которое титруется рабочим раствором (Б) в присутствии индикатора (В):
Пример: Вычислить эквивалентную массу кислоты Н3РО4, если титровать раствор ее рабочим раствором NаОН в присутствии: а) фенолфталеина; б) метилового оранжевого. Решение: а) рТ фенолфталеина = 8 - 10, титрование с ним заканчивается, когда получается соль Nа2НРО4 по реакции Н3РО4 + 2NаОН = Nа2НРО4 + 2Н2О рН Nа2НРО4 = (рК3 + рК2)/2 =(12,67 + 7,21)/2 = 9,94 ( рК2 и рК3 - показатели второй и третьей констант диссоциации Н3РО4) Кислота титруется как двухосновная (Z =2). Эквивалентная масса Н3РО4 равна 98/2 = 49 г/моль. б) рТ метилового оранжевого = 4. Титрование с ним заканчивается, когда получается соль NаН2РО4 по реакции Н3РО4 + NаОН = NаН2РО4 + Н2О рН NаН2РО4 = (рК2 + рК1) /2 = (7,21 + 2,12)/ 2 = 4,66,( рК2 и рК1 - показатели второй и первой констант диссоциации Н3РО4) Кислота тритируется как одноосновная (Z = 1). Эквивалентная масса ее 98 г/ моль. VIII Расчеты, связанные с приготовлением рабочих растворов
Пример 1: Сколько мл. серной кислоты ( = 1,837 г/ мл) требуется для приготовления 2,5 л 0,2 М раствора? Решение. Расчет можно вести на основании закона эквивалентов, используя “золотое правило” 35,2·V1 = 0,4·2500; V1 = 28,4 мл. Ответ: 28,4 мл. Пример 2: Сколько граммов Na2B4O7*10H2o надо взять, чтобы приготовить 500 мл. 0,1 н раствора? Решение: Массу буры находим по формуле: 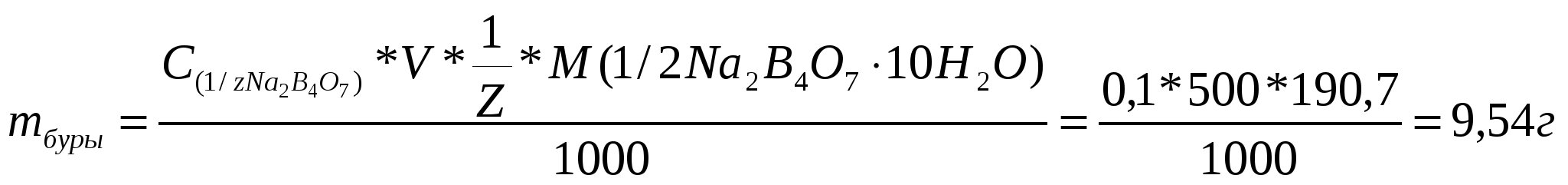 Zбуры = 2; эквивалентная масса 190,7 г. Ответ: 9,54 г. IX. Вычисление результатов титриметрического анализа (прямое титрование).
Пример: Рассчитать массовую долю (%) основного компонента (Na2B4O7x10H2O) в загрязнённой буре, если при титровании 0,8530 г её идёт 20,20 мл 0,2100М раствора HCl? Решение: Определение ведётся методом отдельных навесок. Процентное содержание чистой буры определяется по формуле: Находим сначала массу чистой буры (mчист.) по результатам титрования: 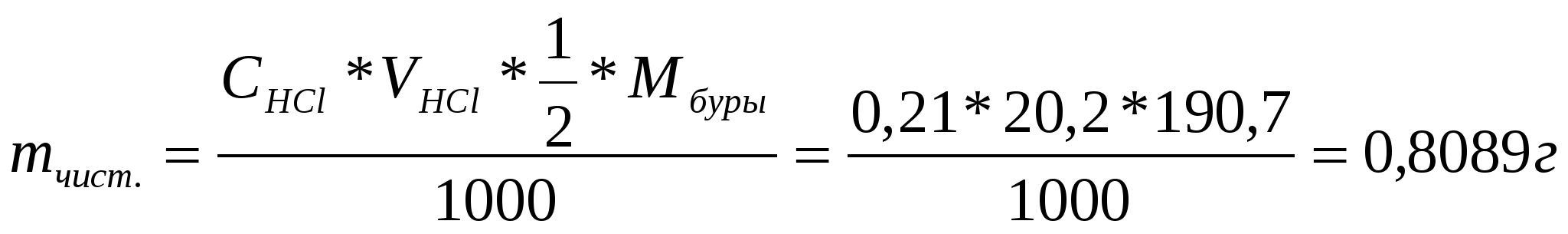 X. Вычисление результатов титриметрического анализа (метод обратного титрования)
Пример: Для определения вольфрама в стали навеску 1,000 г обработали соответствующим образом и превратили вольфрам , находящийся в ней, в H2WO4. К этой кислоте добавили избыток (40,00 мл) 0,005548М раствора NaOH. На обратное титрование избытка NaOH с фенолфталеином пошло 18,00 мл 0,005659М раствора HNО3. Сколько процентов вольфрама содержит сталь? Решение: При титровании с фенолфталеином вольфрамовая кислота титруется как одноосновная до кислой соли: H2WO4 + NaOH = NaHWO4 + H2OZH2WO4 = 1; Эквивалентная масса H2WO4 равна М(H2WO4). Эквивалентная масса вольфрама равна его атомной массе (183,85 г/моль). Находим массу чистого вольфрама: Ответ: 2,21%. 2. МЕТОД РЕДОКСОМЕТРИИ (ПЕРМАНГАНАТОМЕТРИЯ И ИОДОМЕТРИЯ) Методы объемного анализа, в которых применяются реакции окисления и восстановления веществ, называются методами окисления-восстановления или редоксиметрии. Характерной особеностью окислительно-восстанови-тельных реакций (ОВР) является переход электронов между реагирующими частицами. Частицу, принимающую электрон, называют окислителем, а частицу, отдающую электрон - восстановителем. Например, в реакции: MnO4- + Fe2+ + 8H+ → Mn2+ + Fe3+ + 4H2O (1) электроны от иона Fe2+ переходят к иону MnO4-. В результате этого степень окисления Mn+7 уменьшается до Mn2+, а степень окисления железа (+2) увеличивается до степени окисления (+3). Ион MnO4- в данном случае является окислителем, а ион Fe2+ - восстановителем. Следовательно, процесс окисления одного вещества неразрывно связан с восстановлением другого. Каждую ОВР можно представить как сумму двух полуреакций, одна из которых отражает превращение окислителя в восстановитель, а другая - восстановителя в окислитель. В реакции (1) уравнение полуреакций с окислителем имеет вид: MnO4- + 8H+ + 5e = Mn2+ + 4H2O (1.1) а с восстановителем: Fe2+ - e = Fe3+ (1.2) Суммирование уравнений (1.1) и (1.2) дает уравнение (1). При суммировании необходимо предусмотреть, чтобы в соответствии с законом электронейтральности раствора число электронов, отдаваемых восстановителем, было равно числу электронов, принимаемых окислителем. Количественно силу окислителя и восстановителя оценивают по величине окислительно-восстановительного потенциала – ОВП (φ0, φ или φ0ОХ/RED, где ОХ – окисленная форма а RED – восстановленная форма). Чем больше величина ОВП, тем большими окислительными свойствами обладает окисленная форма, а чем меньше величина ОВП, тем большими восстановительными свойствами обладает восстановленная форма. Чем сильнее указанный окислитель, тем слабее сопряженный с ним восстановитель, и наоборот. Когда комбинируются две какие-либо окислительно-восстановительные пары, то более сильный из двух окислителей отнимает электроны у более сильного восстановителя, причем образуется более слабый окислитель и восстановитель. Например, в случае пар Cl2/2Cl- и Fe3+/Fe2+ более сильным окислителем является Cl2, т.к. Сl2 + 2Fe2+ → 2Cl- + 2Fe3+ В сторону образования более слабого восстановителя (Сl-) и окислителя (Fe3+), чем исходные. Окислители с большим значением ОВП, способны окислять любой из восстановителей с меньшим потенциалом, а восстановители с меньшим потенциалом способны восстанавливать окислители с большим потенциалом. Например, ионы Cr2O72- в кислой среде (φ0 Cr2O72- + 14Н+ + 6е/2Сr3+ + 7H2O = 1,36 В) могут окислять все восстановители с меньшими значениями ОВП – I-, SO32-, S2O32-, Sn2+, S2-. Но ионы Cr2O72- не могут окислить Mn2+ в MnO4-, однако ионы Cr3+ cпособны восстановить ионы MnO4- в ионы Mn2+. Учитывая вышесказанное, можно, пользуясь таблицей ОВП (φ0) при стандартных условиях, предвидеть направление течения ОВР. Следует учитывать, что изменение некоторых условий протекания реакций, которые влияют на величину ОВП, может привести к изменению соотношения потенциалов окислительно-восстановительных пар, и реакция, невозможная в стандартных условиях (когда ∆G0>0), будет возможна в соответствующих условиях (когда ΔG<0). Зависимость ОВП от температуры и концентрации компонентов окислительно-восстановительной системы выражается формулой Нернста: φОХ/RED = φ0ОХ/RED + где ПОХ – произведение концентраций всех компонентов окислительно- восстановительной системы, находящихся в одной части схемы с окисленной формой, причем концентрация каждого компонента берется в степени, равной стехиометрическому коэффициенту, стоящему перед формулой соответствующего компонента; ПRED – соответственно то же для компонентов, находящихся в одной части схемы с восстановленной формой. Концентрации трудно- растворимых и газообразных веществ и воды не входят в эти произведения; R – газовая постоянная, 8,31 Дж/моль·К; T – абсолютная температура, К; F – число Фарадея, 96500 кулонов; n – количество электронов окислительно-восстановительной системы. Преобразованная формула Нернста имеет вид: φОХ/RED = φ0ОХ/RED+ Например, для реакции (1) формула Нернста будет такой: ОВР протекает слева направо когда: а) Δφ0 или Δφ >0 (Δφ0 = φ0ок - φ0восс.; Δφ = φок - φвосс.); б) ΔG0р-ии или ΔGр-ии <0 ΔG0р-ии = -n·F·( φ0оx - φ0RED.); ΔGр-ии = -n·F·( φоx - φRED). Так как ОВР обратимы и вследствие этого устанавливается химическое равновесие, то для них можно рассчитать константу равновесия К: lg K = где n – число электронов. Из формулы (4) видно, что константа равновесия должна быть тем больше, чем больше разность стандартных потенциалов окислительно-восстановительных пар. Если же эта разность велика, реакция идет практически до конца, а при малой разности потенциалов химическое превращение до конца не доходит. К реакциям, применяемым в редоксиметрии, предъявляются те же требования, что и к любой реакции, используемой в объемном анализе, а именно: а) возможность фиксирования точки эквивалентности; б) большая скорость; в) отсутствие побочных процессов; г) практическая необратимость. Для фиксирования точки эквивалентности применяются редокс-индикаторы, представляющие собой окислители или востановители, окисленные и восстановленные формы которых имеют различную окраску. При изменении потенциала в титруемом растворе меняется цвет индикатора. Выбирается тот индикатор, область перехода окраски которого (находится по формуле φ0 ± 0,059/п, где φ0 – стандартный окислительно-восстановительный потенциал индикатора; п – число отданных либо принятых электронов) совпадает со скачком потенциала на кривой титрования восстановителя окислителем либо наоборот. Окислительно-восстановительные реакции обычно идут с меньшими скоростями, чем реакции, связанные со взаимодействием ионов. Для ускорения их приходится применять катализаторы или нагревание реакционной смеси. Окислительно-восстановительные процессы часто проходят очень сложно, с побочными реакциями. Поэтому не всякую реакцию можно применить в методах редоксиметрии. Окислительно-восстановительные процессы чаще всего обратимы. Для сдвига равновесия в нужную сторону используют или добавление избытка ионов водорода (если реакция идет с поглощением их), или увеличение концентрации одного из компонентов. Иногда применяются методы непрямого титрования: замещения или обратного титрования. Редоксиметрия, в свою очередь, подразделяется на методы, различающиеся применяемым рабочим раствором. Наиболее употребительны из них: а) перманганатометрия, использующая реакции окисления, производимые перманаганатом калия (KMnO4). б) хроматометрия, использующая реакции окисления дихроматом калия (K2Cr2O7) в кислой среде. в) броматометрия, использующая реакции окисления, производимые броматами (KBrO3) в кислой среде. г) иодометрия, в основе которой лежат реакции окисления свободным иодом или восстановления иодид-ионами, и другие. В случае окислительно-восстановительных процессов эквивалентом называют такую часть молекулы (иона, атома), на которую приходится один принимаемый или отдаваемый электрон в данной реакции. Формула эквивалента вещества А имеет вид 1/ZA, где 1/Z – фактор эквивалентности, а Z – число эквивалентности. Например для перманганата калия в кислой среде фактор эквивалентности равен 1/5, число эквивалентности – 5, а формула эквивалента 1/5 (KMnO4). 2.1. Метод перманганатометрии В данном методе рабочим раствором является перманганат калия KMnO4. Ион перманганата (MnO4-) окисляет в кислой, щелочной и в нейтральной средах. В объемном анализе наибольшее применение имеет окисление в кислой среде, когда перманганат-ион восстанавливается до иона Mn2+ по уравнению: MnO4- + 8H+ + 5e = Mn2+ + 4H2O Молярная масса перманганата калия М(KMnO4) = 158,03 г/моль, а молярная масса эквивалента М(1/5KMnO4) = 1/5·М(KMnO4) = 31,61 г/моль. Окислительно-восстановительный потенциал данной системы находится по уравнению: Видно, что величина потенциала зависит не только от концентраций ионов MnO4- и Mn2+, но и сильно зависит от концентрации ионов водорода. Молярная масса эквивалента перманганата калия в нейтральной или слабо щелочной средах находится на основании уравнения: MnO4- + 3H2О +3e = MnО(ОН)2 + 4OН- (5) Т.е. MnO4- восстанавливается до MnO2, точнее до ее гидрата MnO(ОН)2, выпадающего в виде бурого осадка. Следовательно, молярная масса эквивалента KMnO4 равна 1/3·М(KMnO4) = 52,68 г/моль. Стандартный потенциал пары MnO4-/Mn2+ (1,52 В) гораздо выше стандартного потенциала пары MnO4-/MnО2 (0,59 В), поэтому окислительная сила перманганата в кислой среде выше, чем в нейтральной. Титрование перманганатом может осуществляться прямым и косвенным способом. Прямым методом титрования определяют многие восстановители, которые легко и без потерь окисляются перманганатом. Обратное титрование обычно применяют для анализа восстановителей, которые взаимодействуют с перманганатом медленно. Для анализа окислителей методом перманганатометрии их предварительно восстанавливают до соединений низших степеней окисления. Метод перманганатометрии имеет следующие достоинства:
Недостатки метода:
Приготовление и хранение раствора KMnO4 Обычно при титровании перманганатом применяют 0,05н его раствор. Для приготовления 1 л 0,05н раствора перманганата калия, предназначенного для титрования в кислой среде, навеска рассчитывается по формуле: m(KMnO4) = 1/5M(KMnO4)·0,05 = 1,5803 г Если рабочий раствор KMnO4 предназначается для слабо щелочных или нейтральных растворов, то навеска его рассчитывается по формуле: m(KMnO4) = 1/3M(KMnO4)·0,05 = 2,64 г Навеску перманганата взвешивают на технических весах в стеклянном бюксе, растворяют в 1 л дистилированной воды, нагревают до кипения, охлаждают и оставляют в темной колбе с притертой пробкой до следующего занятия. Если в колбе при хранении образуется осадок MnO2, то раствор осторожно сливают с осадка или фильтруют через стеклополотно. Точную нормальность раствора перманганата устанавливают по одному из исходных веществ: H2C2O4·2H2O; Na2C2O4; As2O3; K4[Fe(CN)6]·3H2O. Наиболее удобным является щавелевокислый натрий (оксалат натрия) (Na2C2O4). Очистка его легко достигается перекристаллизацией. |
