Современные методы иммунодиагностики инфекционных болезней. Учебное пособие. Удк. 57. 396 Васильев Д. А., Барышников П. И., Новиков Б. В
 Скачать 426 Kb. Скачать 426 Kb.
|
2.5.Техника постановки распространенных вариантов ИФАИзвестно значительное число модификаций постановки ИФА в зависимости от природы определяемых веществ и целей исследования. Все методы ИФА подразделяются на две основные группы: гомогенные и гетерогенные методы ИФА. Первые характеризуются тем, что вся совокупность иммунологических и ферментативных реакций происходит в единой смеси всех используемых компонентов реакции без их разделения и удаления промежуточных продуктов и не прореагировавших компонентов. Для вторых характерно проведение анализа на твердой фазе в виде последовательных стадий, причем после каждой стадии происходит отмывка твердой фазы и, соответственно, удаление промежуточных продуктов и избытка не прореагировавших компонентов. Необходимо отметить, что гомогенные методы анализа очень сложны в отработке оптимальных условий их проведения и используются практически только для определения низкомолекулярных гормонов, метаболитов и лекарственных веществ. Гетерогенные же методы ИФА более просты и воспроизводимы и поэтому стали широко использоваться для качественного и количественного выявления высокомолекулярных веществ и получили широкое распространение в диагностике инфекционных болезней человека и животных. Наиболее простыми и часто употребляемыми в диагностике вариантами твердофазного ИФА для определения антител и антигенов являются: непрямой метод и метод ингибирования – для выявления антител; метод «двойных» антител (сандвич) для выявления антигенов. 2.5.1.Непрямой методДанный вариант ИФА проводят с использованием антивидовых конъюгатов. Наиболее распространенными антивидовыми коньюгатами являются меченые ферментом антитела кролика, иммунизированного глобулинами других видов млекопитающих (например, крупного рогатого скота), меченые антитела осла, иммунизированного иммуноглобулинами кролика и т. д. Данный подход позволяет решить проблемы серодиагностики заболеваний животных, используя ограниченный набор антивидовых иммуноферментных конъюгатов, что значительно облегчает задачу производства реагентов для ИФА. Непрямой твердофазный метод ИФА ставили по следующей схеме (рис.1):
В 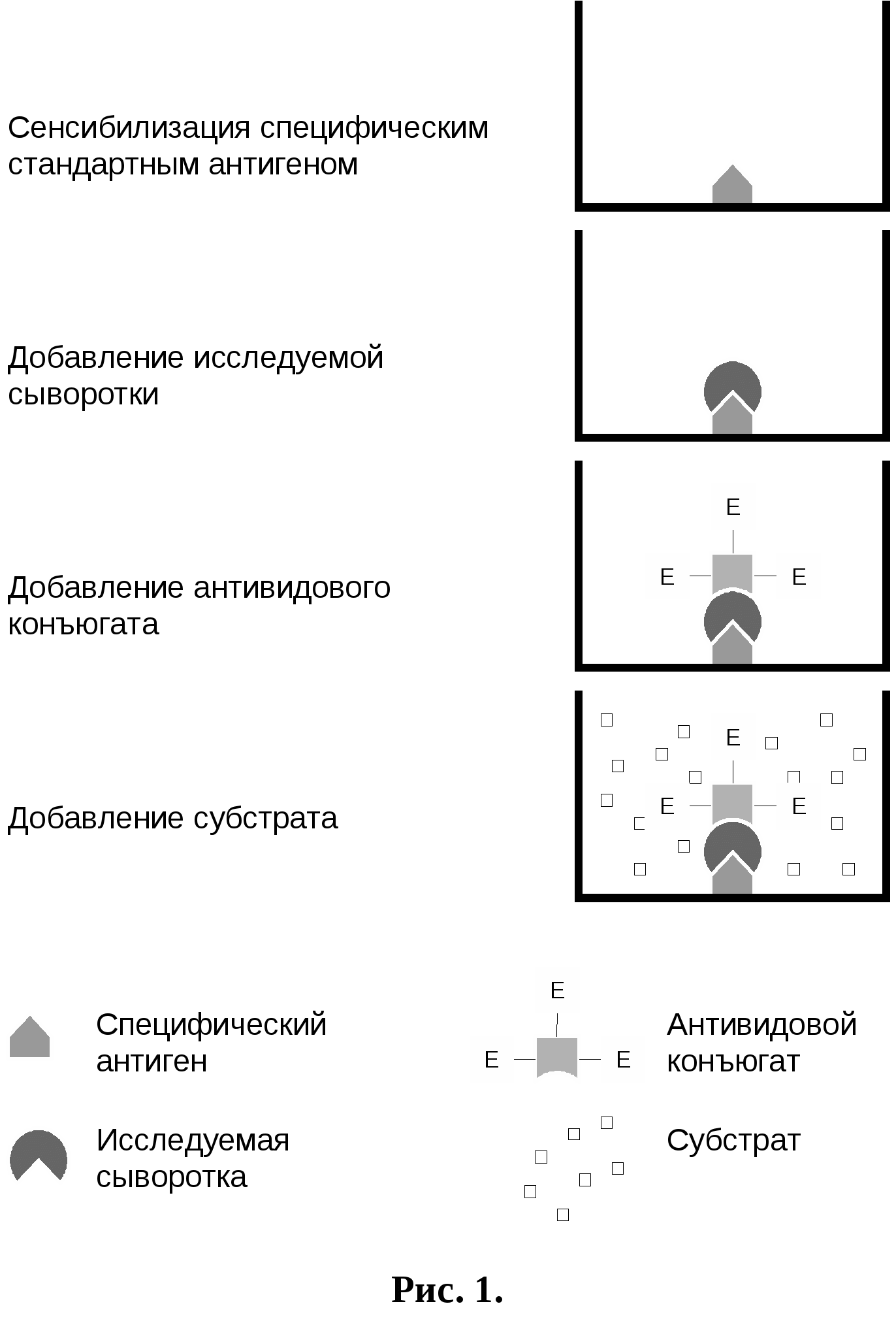 се компоненты реакции вносили в объеме 0,2 мл. После каждого этапа (внесения реактантов в лунки) пластины отмывали физиологическим раствором рН 7,3 с 0,05 % твина 20. Для этого лунки заполняли этим раствором, встряхивали и содержимое выливали, повторяли отмывание до 3-х раз. При постановке реакции использовали контроли: контроль субстрата: в I-й ряд сенсибилизированной пластины вносили только субстратную смесь, в промежуточные этапы – ФБР рН с 0,05% твина 20. Субстратный контроль использовали в качестве нулевого в показаниях спектрофотометра; контроль коньюгата: во 2-й ряд сенсибилизированной пластины вместо сыворотки вносили ФБР рН 7,4 с 0,05 % твина 20. Контроль коньюгата выявляет неспецифическое связывание коньюгата с антигеном; положительный контроль: положительную сыворотку крови крупного рогатого скота в разведении 1:400 в ФБР рН с 0,05 % твина 20 вносили в 2 лунки 3-го ряда сенсибилизированной пластины; отрицательный контроль: нормальную сыворотку крови крупного рогатого скота в разведении 1:400 в ФБР рН 7,4 с 0,05 % твина 20 вносили в 2 лунки 3-го ряда сенсибилизированной пластины (Барышников П.,1995). 2.5.2.Твердофазный «сандвич»–вариант ИФАЭтот вариант ИФА является крайне распространенным для определения антигенов, обладающих более чем одной распознаваемой антителами детерминантой. В процессе анализа антиген как бы «зажат» между молекулами антител, что и обусловило название метода «сандвич». Это название теперь используется практически во всей литературе на правах официального термина. Данный вариант ИФА ставили по следующей схеме (рис.2):
Все компоненты реакции вносят в объеме 0,2 мл. После каждого этапа пластины отмывают физиологическим раствором рН 7,3 с 0,05% твина 20. Для этого лунки заполняют этим раствором, встряхивают и выливают содержимое, затем вновь повторяют отмывание до 3-х раз. П 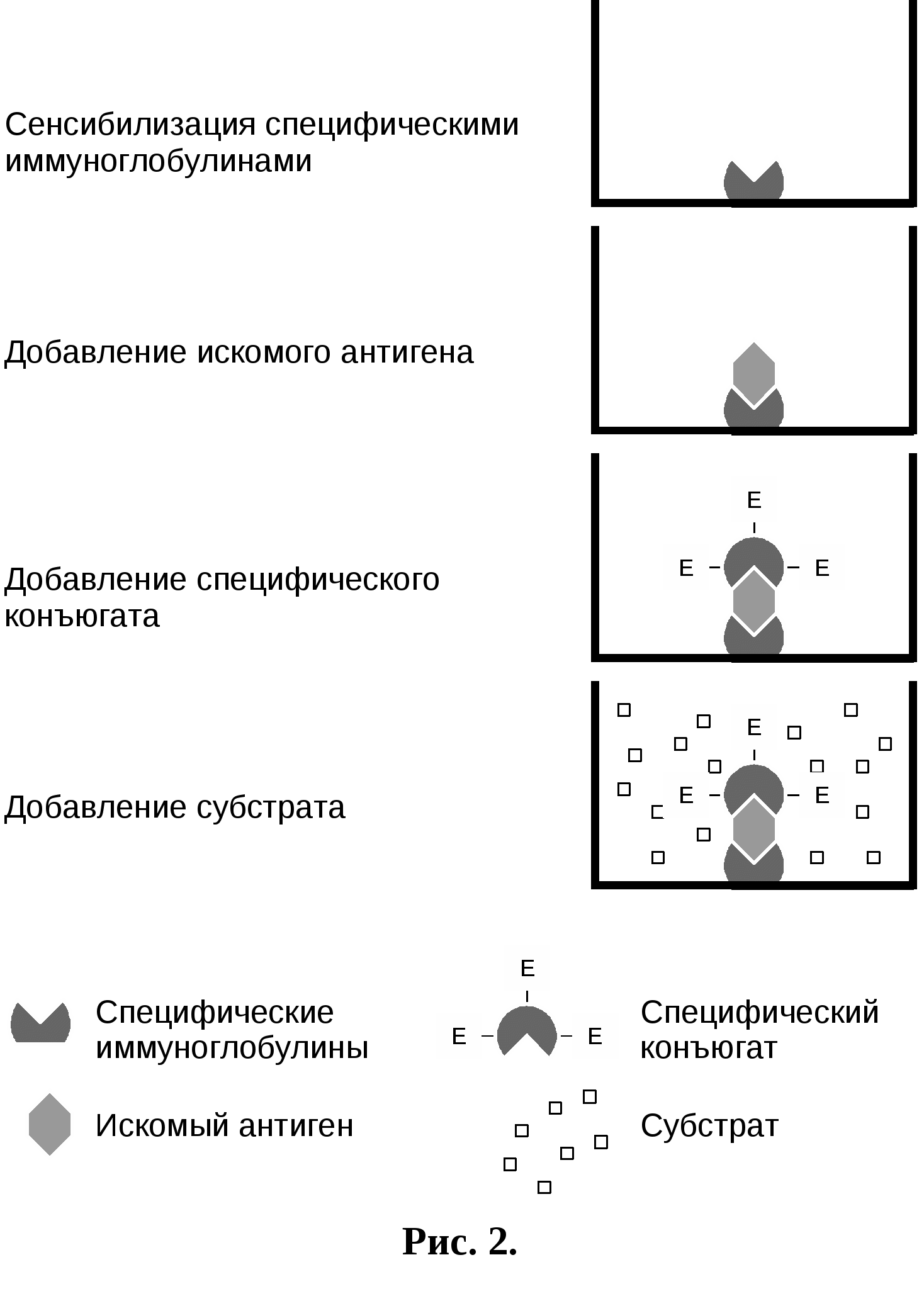 ри постановке реакции использовали контроли: контроль субстрата: в 1-й ряд сенсибилизированной пластины вносят только субстратную смесь, в промежуточные этапы ФБР рН 7,4 с 0,05% твина 20.Субстратный контроль используется в качестве нулевого в показаниях спектрофотометра; контроль конъюгата: во 2-й ряд сенсибилизированной пластины вместо антигена, вносят ФБР рН 7,4 с 0,05 % твина 20. Контроль конъюгата выявляет неспецифическое связывание конъюгата с сенсибилизированной пластиной; положительный контроль: специфический антиген в ФБР рН 7,4 с 0,05% твина 20 вносят в 2 лунки 3-го ряда сенсибилизированной пластины. Основным достоинством «сандвич» – варианта является высокая чувствительность, превышающая возможности других схем твердофазного ИФА. Эффективность образования специфического комплекса на каждой стадии анализа зависит от константы связывания реакции антиген-антитело и концентрации компонентов. При данной величине константы связывания и крайне низких концентрациях антигена рассматриваемый метод дает возможность сдвигать равновесие в сторону образования специфических комплексов за счет использования избытка иммобилизированных и меченых ферментом антител. Ограничением применения «сандвич»- варианта ИФА является невозможность определения моновалентных антигенов – стероидных гормонов, лекарств, пестицидов и т.д. (Дзантиев Б.,1985). 2.5.3.Метод ингибирования ИФАДанный вариант ИФА также используется для выявления специфических антител в сыворотке крови больных животных, особенно при использовании антительных реагентов, приготовленных на основе моноклональных антител. Его выполнение не требует дополнительных компонентов, а используют те же, которые применяют при постановке «сандвич» -варианта ИФА. Тем самым, использование этого варианта ИФА имеет значение в том плане, что применение одних и тех же компонентов для реализации 2-х целей должно повысить универсальность и эффективность реакции, а также снизить стоимость анализа. Метод ингибирования ИФА ставили по следующей схеме (рис. 3):
Все компоненты реакции используются в объеме 0,2 мл. После каждого этапа пластину 3-х кратно отмывали физиологическим раствором рН 7,2 с 0,05 % твина 20, как было указано для дугих вариантов ИФА. П 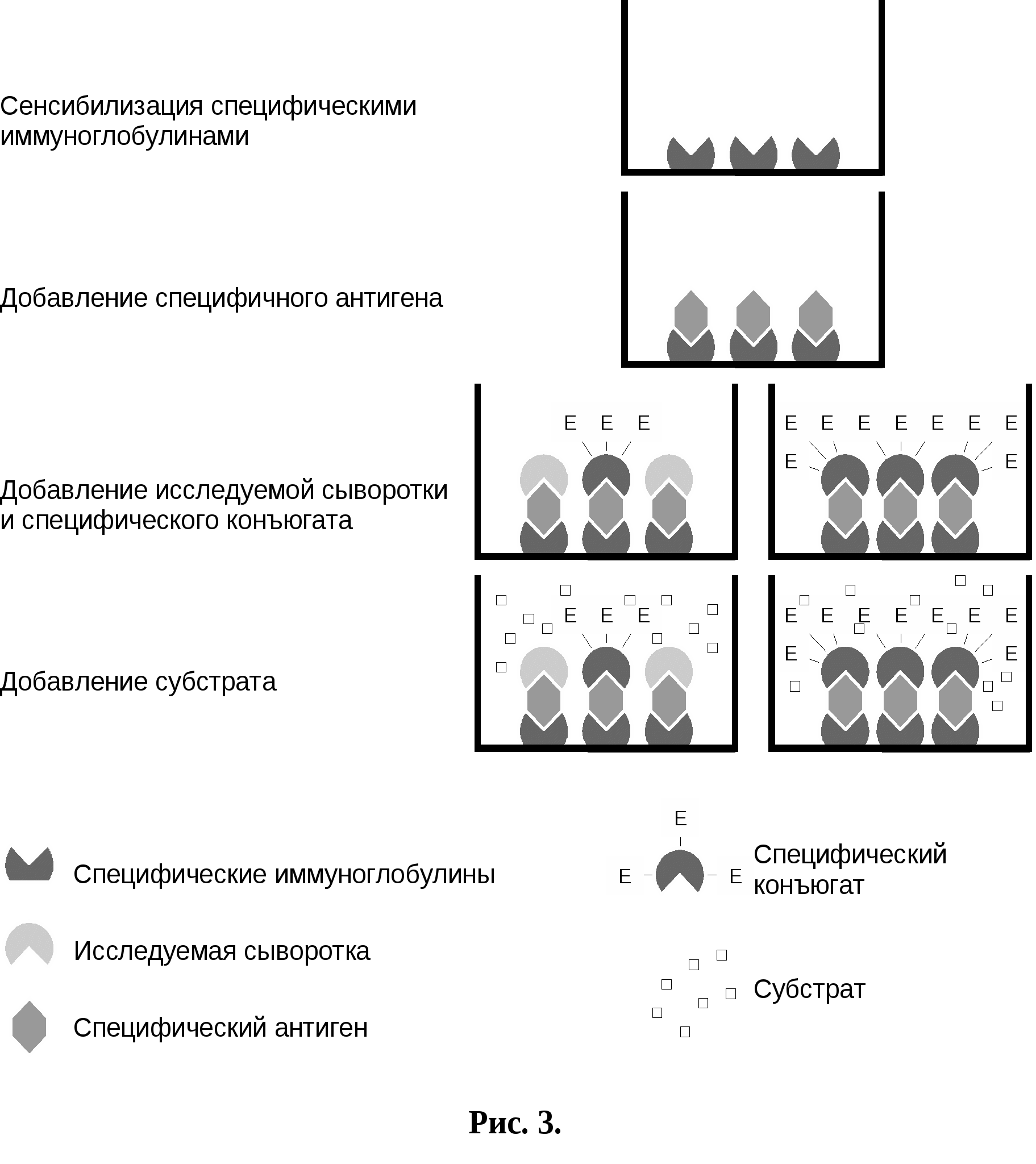 ри постановке реакции использовали контроли: контроль субстрата: в 1-й ряд сенсибилизированной пластины вносили только субстратную смесь, а вместо других компонентов – ФБР рН 7,4 с твином 20. Субстратный контроль используется в качестве нулевого в показаниях спектрофотометра; контроль конъюгата: во 2-й ряд сенсибилизированной пластины вместо антигена и сывороток вносили ФБР рН 7,4 с твином 20. Контроль конъюгата выявляет неспецифическое связывание конъюгата с сенсибилизированной пластиной; положительный контроль: специфическую сыворотку крупного рогатого скота в разведении 1:10 в ФБР рН 7,4 с твином 20 вносили в 2 лунки 3 ряда сенсибилизированной пластины; отрицательный контроль: нормальную сыворотку крупного рогатого скота в разведении 2: 10 в ФБР рН 7,4 с твином 20 вносили в 2 лунки 3 ряда сенсибилизированной пластины. |
