Батурицкая Н. В., Фенчук Т. Д. Удивительные опыты с растениями. 1991. Батурицкая Н. В., Фенчук Т. Д. Удивительные опыты с растениями. Удивительные опыты с растениями
 Скачать 0.92 Mb. Скачать 0.92 Mb.
|
|
34. Влияние ростовых веществ дрожжей на укоренение черенков Наряду с ингибиторами роста в группу негормональных регуляторов входят также вещества, стимулирующие рост: витамины, некоторые фенольные соединения, например, кофейная, феруловая кислоты. Изучите влияние комплекса витаминов, содержащихся в клетках дрожжей, на укоренение черенков. Д 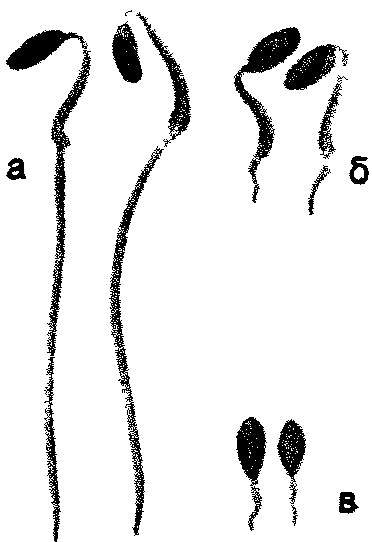 ля опыта нужны черенки различных видов растений, дрожжи, фильтровальная бумага, мерный цилиндр на 500 мл. ля опыта нужны черенки различных видов растений, дрожжи, фильтровальная бумага, мерный цилиндр на 500 мл.89 Рис. 15. Действие салициловой кислоты на рост проростков дыни: а — контроль, б — кислота. 200 мкг/мл. в — кислота, 500 мкг/мл Приготовьте раствор дрожжей концентрацией 100 мг/л. Черенки, например, пеларгонии зональной, разделите на 2 группы. Одну группу (контроль) поместите на сутки в воду, а вторую (опытные растения) — на такой же срок в раствор дрожжей. Через сутки черенки достаньте из раствора дрожжей, обмойте водой и перенесите в сосуд, заполненный наполовину водой. Чтобы вода не застаивалась, в сосуды с контрольными и опытными черенками поместите несколько кусочков древесного угля. Черенки должны находиться в сосудах с водой до появления корней у растений обоих вариантов. В таблице для подведения итогов отметьте дату появления корней и число их к концу опыта. Результаты опыта показывают, что вещества, выделяемые дрожжевыми клетками в воду, ускоряют появление корней на 10—12 дней и увеличивают их число в 2—10 раз. Использование раствора дрожжей позволяет ускорить корнеобразование у растений с трудноукореняющимися черенками, например, лимона, роз, сирени. Ускорение корнеобразования обусловлено выделением в воду из дрожжевых клеток витамина b1, биотина (витамина Н), а также спирта мезоинозита. Витамины, входя в состав различных ферментов, усиливают действие фитогормонов, что приводит к усилению процессов регенерации в черенках опытных растений. 90 35. Влияние качества света на рост растений Стимулятором или ингибитором роста растений может быть и свет. Большое значение имеет качественный, спектральный состав света. В солнечном спектре выделяют обычно 6 участков, имеющих различную окраску: фиолетовый, синий, зеленый, желтый, оранжевый, красный. Рассмотрим влияние на рост растений синего, зеленого, красного света. Для опыта нужны растения салата листового, редиса посевного, укорененные черенки бегонии вечноцветущей, камнеломки отпрысковой, хроматические камеры (50х50х х50 см), стержни к шариковым ручкам (синие, зеленые, красные), ацетон, небольшие поролоновые тампоны для окрашивания стекол. Для изучения роста растений в условиях освещения красным, зеленым, синим светом необходимы 4 хроматические камеры, пропускающие свет определенных спектральных участков. В качестве хроматической камеры можно использовать готовые стеклянные аквариумы, либо изготовить их на основе деревянного каркаса из стекла. Использовать аквариумы в качестве хроматических камер лучше в том случае, если опыт проводится в лаборатории. При проведении опыта в полевых условиях нужны специальные хроматические камеры (рис. 16), в которых предусмотрена система вентиляции. Окрасить стекла можно пастой шариковых ручек, которую слегка разводят ацетоном и наносят на стекла поролоновым тампоном. 91 В опыте 4 варианта: I — растения, выращиваемые под синими стеклами, II — под зелеными, Ill — под красными, IV — под неокрашенными (контроль). В каждую камеру помещают по 3 растения. Растения в фазе проростков или небольшие укорененные черенки бегонии вечноцветущей накройте хроматическими камерами. Через 1—2 месяца сравните длину главного побега, среднюю длину междоузлий, количество и размеры листьев. 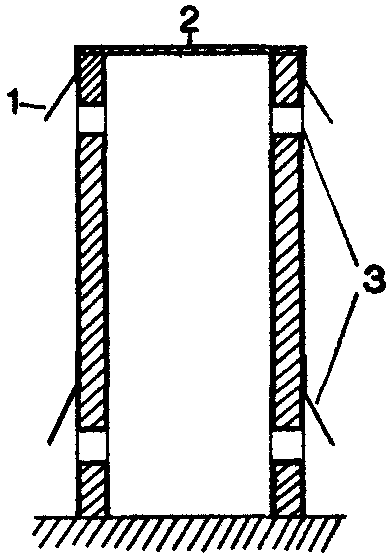 Рис. 16. Хроматическая камера (вид в разрезе): 1 — навесы из полосок клеенки, 2 — цветное стекло, 3 — щели для вентиляции Наблюдения показывают, что растения, выросшие под красным, зеленым, синим светофильтром, отличаются по скорости развития и формирования стебля и листьев от растений, находившихся при естественном освещении или в камере с неокрашенными стеклами. Синий свет вызвал торможение роста стебля, но не оказал влияния на количество и площадь листьев. Зеленый свет способствовал вытягиванию стеблей. Растения этого варианта имели мало листьев, площадь их пластинок уменьшилась. При освещении красными лучами тоже наблюдалось усиление линейного роста, уменьшение площади листьев, быстрое отмирание нижних 92 листьев. Растения контрольного варианта, освещавшиеся естественным солнечным светом, по длине стебля занимали промежуточное положение между растениями, выросшими на синем и красном свету, но имели более развитую листовую поверхность, большее количество цветков. Результаты опыта свидетельствуют, что условия освещения оказывают регуляторное воздействие на рост растений (рис. 17). При анализе результатов опыта необходимо учитывать, что свет в жизни растений выполняет 2 важные функции: энергетическую и регуляторную. Энергия света, поглощенного хлорофиллом и вспомогательными п 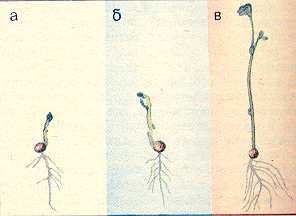 игментами (у высших растений—каротиноидами), расходуется в процессе фотосинтеза на обра- игментами (у высших растений—каротиноидами), расходуется в процессе фотосинтеза на обра-Рис. 17. Растения гороха, развивающиеся одинаковое количество времени в белом (а), синем (б) и оранжевом (в) свете 93 зование органических веществ из неорганических. Максимумы поглощения света хлорофиллом расположены в сине-фиолетовой и красной частях спектра, каротиноидов — в синей. Накопление органического вещества прямо пропорционально количеству поглощенной световой энергии, поэтому освещение растений зелеными лучами, мало поглощаемыми хлорофиллом, неблагоприятно для фотосинтеза и образования необходимых для ростовых процессов органических веществ. Вторая функция света — регуляция процессов роста и развития. В этом случае свет поглощается не хлорофиллом, а другими пигментами: синий свет—флавинами, красный— фитохромом. Реакции фоторегулирования могут осуществляться с помощью очень малого количества пигмента, поглощающего ничтожную часть падающего солнечного излучения. Влияние света на онтогенез растений многообразно. Он регулирует прорастание семян, образование листьев, корней, цветков, листопад, переход почек в состояние покоя. Синие, фиолетовые, ультрафиолетовые лучи стимулируют процессы деления клеток, но подавляют их рост в фазе растяжения, что приводит к задержке роста растений в высоту. Подавление растяжения клеток обусловлено, с одной стороны, сильным возрастанием количества ингибиторов роста, а с другой,—уменьшением содержания ауксинов в результате его фоторазрушения. Поэтому растения, выращенные в условиях освещения исключительно синим светом, имеют приземистую, часто розеточную форму. 94 Оконное стекло задерживает ультрафиолетовые лучи. Поэтому растения, выросшие в хроматической камере с неокрашенными стеклами, имеют более вытянутые стебли по сравнению с растениями, растущими вне камеры. Красный свет подавляет процессы деления клеток, но стимулирует их растяжение. Это приводит к усилению линейного роста растений, вытягиванию стеблей и междоузлий. Растения, выращенные на красном свету, могут внешне напоминать этиолированные, т. е. выросшие без света растения. Зеленые лучи тоже выполняют определенные функции в образовании и активации ферментов. Поэтому гармоничный рост растений возможен только в условиях освещения белым светом, который, как известно, содержит все участки солнечного спектра, от ультрафиолетового до дальнего красного: фиолетовый, синий, голубой, зеленый, желтый, оранжевый, красный. Оптимальные для роста растений соотношения красного и синего света в общем светопотоке могут несколько меняться в зависимости от вида и возраста растений. Известно, например, что крестоцветные более требовательны к синему цвету, а злаки — к красному. При культивировании растений в условиях искусственного освещения (светокультура растений) регуляция спектрального состава и интенсивности света дает возможность управлять формированием урожая. 95 36. Тормозящее влияние света на рост растений Изучите скорость роста растений в течение суток. Для опыта нужны семена гороха посевного, подсолнечника, клубни картофеля, линейка. В горшках с почвой вырастите в темноте проростки гороха, подсолнечника, картофеля. Когда ростки достигнут 3—4 см, точно измерьте их длину и утром выставьте на свет. Чем интенсивнее освещение, тем нагляднее будут результаты. Через 9—12 ч снова измерьте длину проростков и на ночь поставьте в темное место. Утром растения измерьте и выставьте на свет. Наблюдения за ростом растений в дневное и ночное время проведите в течение нескольких дней. На основе полученных данных постройте кривую суточной периодичности роста растений. Для этого на оси абсцисс отметьте время измерения длины растений (с указанием часа суток), а на оси ординат —прирост стебля в длину. Результаты опыта показывают, что в ночное время рост проростков идет быстрее, чем днем. Тормозящее действие света на рост растений обусловлено его влиянием на количественное соотношение гормонов в растении. На свету происходит частичное разрушение ауксинов и подавление синтеза гиббереллинов. Это приводит к снижению их количества днем и возрастанию в ночное время суток. Одновременно на свету возрастает количество абсцизовой кислоты, ингибирующей деление и растяжение клеток. 96 Задание. Понаблюдайте за ростом какого-либо растения на клумбе или огороде. Определите средний прирост за день и за ночь. 37. Влияние табачного дыма на рост растений Загрязнение воздуха, в том числе табачным дымом, оказывает отрицательное воздействие на рост растений, особенно выраженное у молодых особей. Для опыта нужны семена гороха посевного, бобов, 3 чашки Петри, 3 стеклянных колпака и пластинки из стекла в качестве подставок под колпаки, табак, чашечки для его сжигания. В чашках Петри разложите на увлажненной фильтровальной бумаге, которую можно предварительно сложить в виде гармошки, по 10 семян гороха посевного. После прорастания семян поместите чашки под стеклянные колпаки. Проростки в первой чашке — контрольные. Проростки во второй чашке окурите табачным дымом 1 раз, а в третьей — 2—3 раза с интервалом в 1—2 дня. Д  ля окуривания необходимо зажечь в чашечке для сжигания табак. Чтобы колпаки достаточно герметично закрывали чашки с проростками, их края смажьте вазелином. ля окуривания необходимо зажечь в чашечке для сжигания табак. Чтобы колпаки достаточно герметично закрывали чашки с проростками, их края смажьте вазелином.Обычно уже однократной обработки растений табачным дымом достаточно, чтобы у проростков гороха листья приобрели бледно-зеленую окраску, развился слабый стебель. В третьей чашке растения заметно отстают в росте, окраска листьев бледно-зеленая, стебельки изогнуты (рис. 18). Рис 18 Влияние табачного дыма на рост растений а — контроль б — трехкратное окуривание Задание Сравните влияние табачного дыма на рост растений различного возраста 38. Срастание корневых систем древесных растений Срастание корней в природных условиях происходит у многих видов древесных растений Для наблюдения этого явления нужны групповые насаждения сосны обыкновенной или березы бородавчатой, дуба черешчатого, клена остролистного возрастом не менее 5 лет, лопата, совок, нож В 80—100 м от центра группы растений выкопайте траншею глубиной 80—100 см и длиной 1—2 м Стенку 98 траншеи, обращенную к деревьям, осторожно разрушьте и освободите всю корневую систему В корневой системе двух или нескольких растущих очень близко друг к другу деревьев можно наблюдать срастание стержневых корней, врастание бокового корня в стержневой, срастание боковых корней и даже срастание одного корня с корнями не скольких особей (рис 19) Сфотографируйте сросшиеся корневые системы и засыпьте почвой обнаженные корни Такие срастания корней аналогичны прививкам побегов растений Считают, что срастание корней — положительное явление в жизни растений Можно представить себе березовую рощу как единый организм (срастание корней у березы происходит особенно легко из-за гладкой поверхности корней). Благодаря срастанию корней в природе можно наблюдать удивительное явление Р 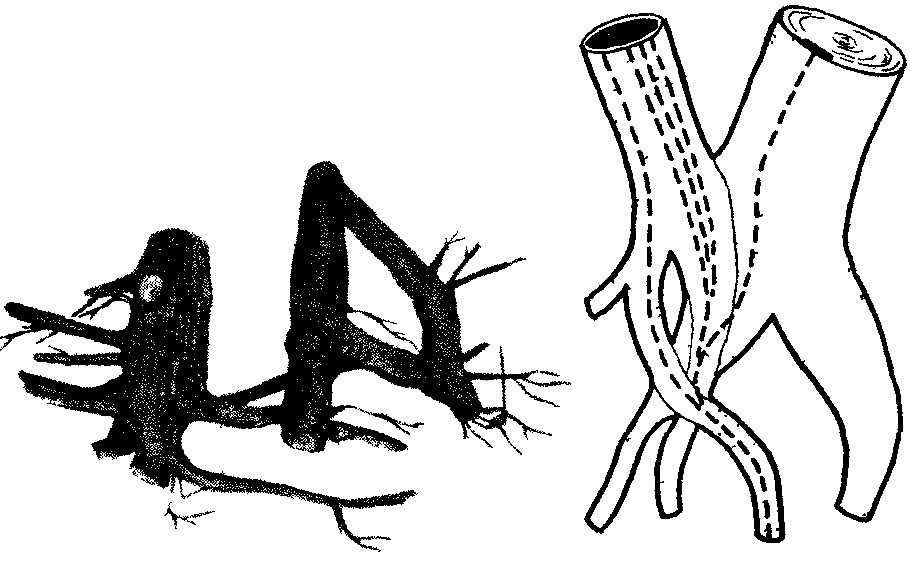 ис 19 Срастание корней древесных растений живые пни. ис 19 Срастание корней древесных растений живые пни. Например, в посадках сосны обыкновенной до 50% пней, оставшихся после прореживания посадок, могут быть живыми. Большинство таких пней находится на расстоянии 2,5 м от молодого дерева. Причем у живого пня функционируют только те корни, которые срослись с живым деревом. Пни, не сросшиеся корнями с другими деревьями, отмирают через год. 39. Взаимное влияние растений Помимо абиотических факторов внешней среды (свет, температура, вода, кислород, элементы питания), на рост растений оказывают влияние биологически активные вещества, которые выделяются в почву и воздух другими растениями. Явление взаимного влияния растений носит название аллелопатии (от греч. «аллелон» — взаимно, «патос» — страдание). Растения могут выделять вещества, которые тормозят (токсины) или ускоряют (стимуляторы) рост других растений. Для изучения взаимного влияния растений нужны наклюнувшиеся семена пшеницы, овса и ячменя, 4 горшка с почвой. В  3 горшка посейте раздельно одинаковое количество семян пшеницы, овса, ячменя. В четвертый горшок посейте поочередно семена всех 3 видов растений. Общее количество семян в нем должно быть таким же, как и в контрольных горшках. 3 горшка посейте раздельно одинаковое количество семян пшеницы, овса, ячменя. В четвертый горшок посейте поочередно семена всех 3 видов растений. Общее количество семян в нем должно быть таким же, как и в контрольных горшках.Через месяц подведите итоги опыта. Рост пшеницы, ячменя и овса в раздельном и смешанном посевах происходит по-разному. Растения овса в смешанном посеве отстают 100 Рис 20. Изменение длины корней овса в смешанных с ячменем и пшеницей посевах: а — контроль, б — посев через зерно, в — посев через ряд в росте, имеют менее развитую корневую систему по сравнению с растениями, выращенными в раздельном посеве (рис. 20). Это может быть обусловлено конкуренцией за питательные вещества, ведь растения принадлежат к одному семейству и имеют сходные биологические свойства. Взаимное влияние растений в посеве проявляется также через корневые выделения, которые могут стимулировать или угнетать растущие рядом растения. В состав корневых выделений входят минеральные соединения, органические кислоты, алкалоиды, ферменты, ингибиторы роста негормональной природы, например кумарин, кофейная кислота и стимуляторы, например витамины. 101 Под влиянием комплекса токсинов, выделяемых корневыми системами одних растений, может происходить подавление деления и роста клеток, интенсивности процессов фотосинтеза и дыхания соседних растений. Задание. Определите, как влияют на рост культурных растений сорняки, например пырей ползучий, марь белая, осот огородный. 40. Влияние газообразных выделений растений на прорастание семян Выясните, как влияют летучие выделения растений (фитонциды) на прорастание семян гороха. Для проведения опыта нужны наклюнувшиеся семена гороха посевного или другого вида растений, листья комнатных растений (алоэ древовидное, пеларгония зональная), 2 чашки Петри (или пол-литровые банки), пластилин, ступка с пестиком, фильтровальная бумага. В центре чашки Петри из пластилина сделайте бортик, тщательно приклеивая его ко дну (рис. 21). Вокруг бортика поместите смоченное водой кольцо из фильтровальной бумаги и расположите на нем по периметру чашки на равном расстоянии друг от друга 10 семян гороха. 5 г ткани исследуемого растения разотрите в ступке с песком. Поместив кашицу в углубление, ограниченное бортиком, быстро закройте чашку и поставьте в теплое место. В контрольную чашку в углубление вместо кашицы налейте чистую воду. Регулярно следите за состоянием семян и при необходимости увлажняйте фильтроваль- 102 ную бумагу. Отметьте, на какие сутки от начала опыта наблюдается прорастание семян. Когда корешки в одном из вариантов опыта достигнут 1—1,5 см, проведите учет их длины у каждого семени и вычислите среднюю длину корешка, а также процент проросших семян. Средние значения длины корней, процент проросших семян в каждом варианте занесите в таблицу. Результаты опыта показывают, что летучие выделения листьев могут оказывать на прорастание семян и рост корней гороха посевного как стимулирующее (алоэ древовидное), так и тормозящее (пеларгония зональная) действие. В состав летучих соединений, получивших общее название фитонцидов (от треч. «фитон»—растение, «цидо»—убиваю), входят эфирные масла, альдегиды уксусной и пропионовой кислот, метиловый и этиловый спирты, полифенолы и другие соединения. К образованию комплекса летучих соединений способны все растения, причем повре- 1  03 03Рис. 21. Схема опыта по изучению действия летучих соединений растений на прорастание семян. ждение клеток усиливает выделение фитонцидов. Именно поэтому при проведении описанного выше опыта рекомендуется использовать кашицу, получаемую путем растирания листьев. Состав и количество химических веществ, выделяемых растениями, специфичны для каждого вида, что сказывается на характере их взаимоотношений. Например, ясень обыкновенный, осина, липа мелколистная, клен ясенелистный подавляют, а береза бородавчатая, клен остролистный — стимулируют рост дуба. Напротив, сосна обыкновенная отрицательно реагирует на выделение газообразных веществ листьями березы бородавчатой. Химические вещества, выделяемые листьями и корнями высших растений, играют важную роль в формировании сообществ растений (фитоценозов). 41. Бактерицидное действие фитонцидов горчицы Фитонциды растений обладают мощным бактерицидным действием. Например, фитонциды чеснока, лука, хрена, горчицы убивают многие виды бактерий, простейших, низших грибов в течение нескольких минут и даже секунд. Изучите бактерицидные свойства фитонцидов горчицы черной. Для опыта нужна горчица пищевая в виде порошка или пасты, вареное яйцо, колба емкостью 500 мл, пробка с крючком, сургуч. На дно колбы поместите немного разведенной в теплой воде горчицы. На крючок, приделанный к пробке, подвесьте в сеточке очищен- 104 ное от скорлупы яйцо. Опустите сеточку с яйцом в колбу таким образом, чтобы оно не касалось слоя горчицы, и плотно закройте колбу пробкой. Для герметичности можно залить пробку сургучом или парафином. Под действием фитонцидов горчицы, основным компонентом которых являются аллилгорчичные масла, происходит стерилизация воздуха у поверхности яйца. В атмосфере летучих выделений горчицы яйцо может сохраняться без признаков порчи продолжительное время. Описан опыт, в котором куриное яйцо в колбе сохранилось свежим благодаря горчице в течение 20 лет. Количество фитонцидов, выделяемых различными растениями, неодинаково. 1 га соснового леса выделяет за сутки около 5 кг летучих фитонцидов, а можжевелового — около 30 кг. Фитонциды являются одним из факторов естественного иммунитета: растение стерилизует себя продуктами собственной жизнедеятельности. Задание. Проверьте, используя описанную методику, бактерицидное действие фитонцидов чеснока, хрена, лука. РАЗДРАЖИМОСТЬ И ДВИЖЕНИЯ У РАСТЕНИЙ Для растений движения также естественны, как и для животных. Но поскольку большинство растений не способно к перемещению в пространстве, у многих людей существует представление об их неподвижности. Даже известный французский биолог Жан Батист Ламарк в свое время дал растениям такое определение: «Растения представляют собой живые организованные тела, части которых никогда не обладают раздражимостью. Они не переваривают пищи и не способны двигаться ни под влиянием волн, ни вследствие истинной раздражимости». Заметим, что Ламарк выделил 3 основных критерия, по которым различают растения и животных: наличие у животных организмов раздражимости, способности к движению и способности к перевариванию пищи. Справедливость восторжествовала только в конце XIX в. Исследования Ч. Дарвина в 1865—1880 гг., индийского ученого Д. Ч. Боса в 1895—1937 гг., русских ученых И. Ф. Леваковского и Т. И. Вяземского 106 в 1860—1901 гг. показали, что раздражимость так же свойственна растениям, как и животным. Изучение способности растений к движениям Ч. Дарвин начал сразу же после выхода в свет его знаменитой книги «Происхождение видов путем естественного отбора». На основании изучения более 100 видов лазящих и вьющихся растений, 31 вида хищных растений, принадлежащих к 11 родам, ученый сделaл вывод о способности растений к восприятию раздражения и проведению возбуждения по тканям. В итоговой книге «Способность к движению у растений» великий естествоиспытатель с удовлетворением заключил: «В настоящий момент мы знаем, что движение растений происходит постоянно и что только его размах или направление, или то и другое вместе должны видоизменяться для пользы растения соответственно внешним и внутренним стимулам». Доказательство единства, физиологической общности процессов раздражимости у растений и животных — одно из величайших достижений биологии конца XIX — начала XX в. РАЗДРАЖИМОСТЬ РАСТЕНИЙ Что же такое раздражимость? Это способность организма воспринимать воздействия внешней и внутренней среды и реагировать изменением процессов жизнедеятельности. Спектр внешних воздействий, воспринимаемых растением, широк — свет, температура, сила тяжести, химический состав окружающей среды, магнитное поле Земли, механические и электрические раздражения. У растений так же, как и у животных восприятие раздражения и ответная реакция, например двигательная, пространственно разобщены. Передача раздражения (проведение возбуждения) может осуществляться путем возникновения и распространения по растению электрического потенциала, т. н. потенциала действия. В существовании электричества у растений можно убедиться на довольно простых опытах. 42. Обнаружение токов повреждения в разрезанном яблоке Так называемые токи повреждения были впервые обнаружены в конце XVIII в. итальянским ученым Луиджи Гальвани у животных организмов. Если разрезать отпрепарированную мышцу лягушки поперек волокон и подвести электроды гальванометра к срезу и продольной неповрежденной поверхности, гальванометр зафиксирует разность потенциалов около 0,1 В Первые доказательства существования аналогичных процессов у растений были получены спустя почти 100 лет, когда по аналогии стали измерять токи повреждения на разных растительных тканях. Срезы листьев, стебля, репродуктивных органов, клубней всегда оказывались заряженными отрицательно по отношению к здоровой ткани. Итак, вернитесь в 1912 г. и повторите опыт с измерением потенциалов надрезанного яблока. Для опыта, кроме яблока, нужен гальванометр, способный измерить разность потенциалов около 0,1 В. 108 Яблоко разрежьте пополам, удалите сердцевину. Если оба электрода, отведенных к гальванометру, приложить к наружной стороне яблока (кожуре), гальванометр не зафиксирует разности потенциалов. Один электрод перенесите во внутреннюю часть мякоти, и гальванометр отметит появление тока повреждения. Кроме яблока, можно измерить токи повреждения, достигающие 50—70 мВ, у срезанных стеблей, черешков, листьев. Как показали более поздние исследования, средняя скорость тока повреждения в стебле и черешке составляет около 15—18 см/мин. В неповрежденных органах биотоки тоже постоянно существуют, но для их измерения нужна высокочувствительная аппаратура. Установлено, что ткань листа заряжена электроотрицательно по отношению к центральной жилке, верхушка побега заряжена положительно по отношению к основанию, листовая пластинка — положительно по отношению к черешку. Если стебель положить горизонтально, то под действием силы земного тяготения нижняя часть его становится более электроположительной по отношению к верхней. Наличие биоэлектрических потенциалов характерно для любой клетки. Разность потенциалов между вакуолью клетки и наружной средой составляет около 0,15 В. Только в 1 см2 листа может содержаться 2—4 млн клеток, и каждая — маленькая электростанция. Решающую роль в возникновении растительного, как впрочем и животного, электричества играют 109 мембраны клетки. Проницаемость их для катионов и анионов в направлении из клетки и в клетку не одинакова. Установлено, что если концентрация какого-либо электролита с одной стороны мембраны в 10 раз выше, чем с другой, то на мембране возникает разность потенциалов 0,058 В. Под действием различных раздражителей проницаемость мембран меняется. Это приводит к изменению величины биопотенциалов и возникновению токов действия. Возбуждение, вызванное раздражителем, может передаваться по растению от корней к листьям, регулируя, например, работу устьиц, скорость фотосинтеза. При смене освещения, изменении температуры воздуха токи действия могут передаваться и в противоположном направлении — от листьев к корням, что приводит к изменению активности работы корня. Интересно, что вверх по растению биотоки распространяются в 2,5 раза быстрее, чем вниз. С наибольшей скоростью возбуждение у растений идет по проводящим пучкам, а в них — по клеткам-спутницам ситовидных трубок. Скорость распространения потенциала действия (электрических импульсов) по растению у различных видов не одинакова. Быстрее всех реагируют насекомоядные растения и мимоза—2—12 см/с. У других видов растений эта скорость значительно ниже — около 25 см/мин. 43. Опыт с зеленой горошиной Этот опыт впервые был поставлен крупнейшим исследователем проблемы раздражимости растений 110 индийским ученым Д. Ч. Босом. Он показывает, что резкое повышение температуры вызывает в семенах появление токов действия Для опыта нужны несколько зеленых (несозревших) семян гороха посевного, бобов, фасоли, гальванометр, препаровальная игла, спиртовка. Соедините внешнюю и внутреннюю части зеленой горошины с гальванометром. Очень осторожно в бюксе нагрейте горошину (не повреждая) приблизительно до 60°С. При повышении температуры клеток гальванометр регистрирует разность потенциалов до 0,1—2 В. Вот что отметил по поводу этих результатов сам Д. Ч. Бос: если собрать 500 пар половинок горошин в определенном порядке в серии, то суммарное электрическое напряжение составит 500 В, что вполне достаточно для казни на электрическом стуле. Самыми чувствительными у растений являются клетки точек роста, находящиеся на верхушках побегов и корней. Многочисленные побеги, обильно ветвящиеся и быстро нарастающие в длину кончики корней как бы ощупывают пространство и передают информацию о нем в глубь растения. Доказано, что растения воспринимают прикосновение к листу, реагируя на него изменением биопотенциалов, перемещением электрических импульсов, изменением скорости и направления передвижения гормонов. Например, кончик корня реагирует более чем на 50 механических, физических, биологических факторов и всякий раз при этом выбирает наиболее оптимальную програму для роста. Убедиться в том, что растение реагирует на прикосновения, особенно частые, надоедливые, можно на следующем опыте. 44. Стоит ли трогать растения без надобности Познакомьтесь с тигмонастиями — двигательными реакциями растений, вызванными прикосновениями. Для опыта в 2 горшка высадите по одному растению, желательно без опущения на листьях (бобы, фасоль). После появления 1—2 листьев начинайте воздействие: листья одного растения слегка потрите между большим и указательным пальцем 30—40 раз ежедневно в течение 2 недель. К концу второй недели различия будут видны отчетливо: растение, подвергавшееся механическому раздражению, отстает в росте (рис. 23). Результаты опыта свидетельствуют, что длительное воздействие на клетки слабыми раздражителями может привести к торможению процессов жизнедеятельности растений. П  остоянным воздействиям подвергаются растения, высаженные вдоль дорог. Особенно чувствительны ели. Их ветви, обращенные к дороге, по которой часто ходят люди, ездят машины, всегда короче ветвей, расположенных на противоположной стороне остоянным воздействиям подвергаются растения, высаженные вдоль дорог. Особенно чувствительны ели. Их ветви, обращенные к дороге, по которой часто ходят люди, ездят машины, всегда короче ветвей, расположенных на противоположной сторонеРаздражимость растений, т. е. их способность реагировать на разные воздействия, лежит в основе активных движений у растений, которые не менее разнообразны, чем у животных. Перед тем как приступить к описанию опытов, раскрывающих механизм движения растений, целесообразно ознакомиться с классификацией этих движений. Если растения 112 Рис. 23 Влияние на рост растений механического воздействия на осуществление движений затрачивают энергию дыхания, это физиологически активные движения. По механизму изгиба они подразделяются на ростовые и тургорные. Ростовые движения обусловлены изменением направления роста органа. Это сравнительно медленные движения, например изгибы стеблей к свету, корней к воде. Тургорные движения осуществляются путем обратимого поглощения воды, сжатия и растяжения специальных двигательных (моторных) клеток, расположенных у основания органа. Это быстрые движения растений. Они свойственны, например, насекомоядным растениям, листьям мимозы. Более подробно типы ростовых и тургорных движений будут рассмотрены ниже по мере выполнения опытов. Для осуществления пассивных (механических) движений прямых затрат энергии клетки не требуется. В механических движениях в большинстве случаев цитоплазма не участвует. Наиболее распространены, гигроскопические движения, которые вызываются обезвоживанием и зависят от влажности воздуха. 113 ГИГРОСКОПИЧЕСКИЕ ДВИЖЕНИЯ В основе гигроскопических движений лежит способность оболочек растительных клеток к поглощению воды и набуханию. При набухании вода поступает в пространство между молекулами клетчатки (целлюлозы) в оболочке и белка в цитоплазме клетки, что приводит к значительному увеличению объема клетки. 45. Движения чешуи шишек хвойных, сухого мха, сухоцветов Изучите влияние температуры воды на скорость движения семенных чешуи шишек. Для опыта нужны по 2—4 сухие шишки сосны и ели, высушенные соцветия акроклиниума розового или гелихризума большого (бессмертники), сухой мох кукушкин лен, часы. Р  ассмотрите сухую шишку сосны. Семенные чешуи подняты, хорошо видны места, к которым были прикреплены семена (рис. 24). ассмотрите сухую шишку сосны. Семенные чешуи подняты, хорошо видны места, к которым были прикреплены семена (рис. 24).Опустите половину шишек сосны в холодную воду, а вторую — в теплую (40—50 °С). Наблюдайте за движением чешуи. Отметьте 114 Рис. 24. Шишки сосны. время, которое потребовалось для полного их смыкания. Достаньте шишки из воды, стряхните и проследите за движением чешуи в процессе высыхания. Отметьте время, за которое чешуи вернутся в исходное состояние, занесите данные в таблицу:
115 Повторите опыт с теми же шишками несколько раз. Это позволит не только получить более точные данные, но и убедиться в обратимости изучаемого вида движений. Результаты опыта позволят сделать важные выводы: 1) Движение семенных чешуи шишек обусловлено потерей и поглощением ими воды. Об этом же свидетельствует прямая зависимость движения чешуи от температуры воды: при ее повышении скорость движения молекул воды возрастает, набухание чешуи происходит быстрее. 2) Чтобы набухание чешуи могло изменить их положение в пространстве, строение и химический состав клеток на внешней и внутренней стороне чешуи должны быть различными. Это действительно так. Оболочки клеток верхней стороны чешуи шишек хвойных более эластичны, растяжимы по сравнению с клетками нижней стороны. Поэтому при погружении в воду они поглощают ее больше, быстрее увеличивают свой объем, что приводит к удлинению верхней стороны и движению чешуи вниз. В процессе обезвоживания клетки верхней стороны теряют воду тоже быстрее клеток нижней стороны, что приводит к загибанию чешуи вверх. Интересно наблюдать вызываемые набуханием движения листьев кукушкина льна либо других листостебельных мхов. У живых растений листья направлены в сторону от стебля, а у сухих — прижаты к нему. Если опустить сухой стебелек в воду, через 1—2 мин листья переходят из вертикального положения в горизонтальное. 116 Очень красивы движения высушенного соцветия бессмертника. Если сухое соцветие опустить в воду, через 1—2 мин листочки обертки приходят в движение и соцветие закрывается. Задание. Сравните скорость движения чешуи шишек различных видов хвойных. Зависит ли она от размера шишек? Сравните скорость движения чешуи шишек сосны и ели, листьев мхов и листочков обертки соцветия бессмертника, выявите черты сходства и различия. 46. Гигроскопические движения семян. Гигрометр из семян аистника Гигроскопические движения играют важную роль в распространении семян различных растений. Изучите механизм самозакапывания семян аистника, перемещения по почве семян василька полевого. Для опыта нужны семена аистника (грабельника), василька синего, лист плотной бумаги, часы, предметное стекло. Аистник — распространенное в Белоруссии растение. Свое название получило благодаря сходству плода с головой аиста (рис. 25). Рассмотрите внимательно строение сухого плода аистника. Доли зрелого коробочковидного плода снабжены длинной остью, в нижней части спирально закрученной. Плод покрыт жесткими волосками. На предметное стекло нанесите каплю воды и опустите в нее сухой плод. Закрученная спиралью нижняя часть начинает раскручива- 117 ться и плод, не имеющий опоры на стекле, совершает вращательные движения. После полного выпрямления ости перенесите плод на сухую часть стекла. По мере высыхания нижняя часть снова закручивается в спираль и вызывает вращение плода. П 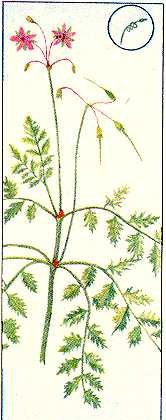 роведите хронометраж опыта, сравнивая скорости процессов раскручивания и закручивания спирали. роведите хронометраж опыта, сравнивая скорости процессов раскручивания и закручивания спирали.Механизм движения плода аистника тот же, что и чешуи шишек хвойных — различие в гигроскопичности клеток ости. Наблюдения за движением плода в капле воды позволяют понять поведение его в почве. Когда плод падает на землю, верхний конец ости, загнутый под прямым углом, цепляется за окружающие его стебельки и остается неподвижным. При закручивании и Рис. 25. Аистник. 118 раскручивании спирального участка нижняя часть плода с семенем ввинчивается в землю. Путь назад преграждают жесткие, отогнутые вниз волоски, покрывающие плод. Чтобы изготовить примитивный гигрометр, в кусочке картона или дощечке, покрытой белой бумагой, проделайте отверстие и закрепите в нем нижний конец плода. Для калибровки прибора сначала высушите, затем смочите ость водой и отметьте крайнее положение (рис. 26). Размещать прибор лучше на улице, где колебания влажности выражены более резко, чем в помещении. Аистник — не единственное растение, способное к самозакапыванию семян. Сходное строение и механизм распространения имеют ковыли, овсюг, лисохвост. П  лоды василька (семянки с хохолком из твердых щетинок) не способны к самозакапыванию. При колебаниях влажности почвы щетинки попеременно опускаются и поднимаются, толкая плод вперед. лоды василька (семянки с хохолком из твердых щетинок) не способны к самозакапыванию. При колебаниях влажности почвы щетинки попеременно опускаются и поднимаются, толкая плод вперед.Задание. Соберите семена василька, лисохвоста, овсюга. Изучите поведение их во влажной и сухой среде, сравните с аистником. Рис 26. Гигрометр из аистника. 119 | |||||||||||||||||||||||||||||||||||||||
