химия. V2 Введение в курс общей и неорганической химии
 Скачать 230 Kb. Скачать 230 Kb.
|
V1: Основные закономерности протекания химических процессов V2: Химическая термодинамика. Химическое равновесие.I: S: Наука, которая изучает законы, описывающие превращения различных видов энергии при химических, физических и биологических процессах, называется ### +: термодинамик#$# *I: S: Соответствие между системой и ее видом L1: животное L2: стол L3: термос с содержимым, надежно закрытый пробкой I: L4: R1: открытая R2: закрытая R3: изолированная R4: гомогенная S: Энтальпии образования диоксида углерода отвечает тепловой эффект реакции +: С + О2 = СО2 -: СаСО3 = СО2 + СаО -: СО + 1/2О2 = СО2 -: Н2СО3 = СО2 + Н2О I: S: Энтальпии сгорания глюкозы отвечает тепловой эффект реакции -: С6Н12О6 2С2Н5ОН + 2СО2 *I: -: С6Н12О6 2СН3-СН(ОН)-СООН S: Химический процесс протекает самопроизвольно, если энергия Гиббса 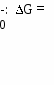 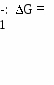  +: G 0 +: G 0 *I: S: Химическим равновесием называется такое состояние обратимого процесса, когда +: скорость прямой реакции равна скорости обратной -: концентрации реагирующих веществ равны концентрациям продуктов -: количество реагирующих веществ равно количеству продуктов -: масса реагирующих веществ равна массе продуктов *I: С(к) + СО2(г) 2СО(г), Н=119,8 кДж/моль вправо, необходимо +: понизить давление -: ввести катализатор I: -: понизить температуру -: понизить концентрацию углерода S: Мерой хаотичности является функция состояния системы - +: энтропия -: энтальпия I: S: Энергия при образовании химической связи +: выделяется -: поглощается I: S: Тепловой эффект обратной реакции -: внутренняя энергия -: свободная энергия Гиббса -: не изменяется -: может и поглощаться и выделяться +: равен тепловому эффекту прямой реакции, взятому с обратным знаком -: равен тепловому эффекту прямой реакции -: больше теплового эффекта прямой реакции -: меньше теплового эффекта прямой реакции I: S: Истинным критерием самопроизвольности процесса является +: свободная энергия Гиббса -: энтальпия *I: S: Наиболее калорийными являются +: жиры -: белки V2: Растворы-: энтропия -: внутренняя энергия -: углеводы -: минеральные соли V3: Ионные равновесия в растворах сильных электролитов. Вода и ее свойства. Водородный показатель.I: S: Термодинамически неустойчивой системой является +: пересыщенный раствор -: насыщенный раствор *I: S: Соответствие между раствором и его видом L1: сплав золота с медью L2: 5% раствор соляной кислоты L3: раствор глюкозы в воде L4: раствор белка в воде L5: I: S: Соответствие между веществом и степенью диссоциации L1: мочевина L2: соляная кислота L3: ортофосфорная кислота L4: угольная кислота L5: I: -: ненасыщенный раствор -: разбавленный раствор R1: твердый раствор R2: разбавленный раствор R3: раствор неэлектролита R4: раствор высокомолекулярного соединения R5: ненасыщенный 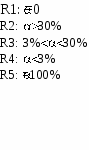 Q: Правильная последовательность веществ по возрастанию степени диссоциации 1: фруктоза 2: Al(OH)3 3: H3PO4 4: HClO4 *I: S: Растворению газов в жидкостях способствует +: понижение температуры -: понижение давления *I: -: применение катализатора -: изменение объема системы S: Одним из наиболее распространенных растворителей в биосфере и химических технологиях является ### +: вода I: S: Атом кислорода в молекуле воды находится в …-гибридизации, валентный угол - …. +: sp3; 104,30 -: sp3; 109,280 I: -: sp2; 1200 -: sp; 1800 S: Аномально высокая температура кипения воды связана с образованием межмолекулярных ### связей. +: водородных I: S: Вода имеет +: высокую диэлектрическую проницаемость -: высокую электрическую проводимость I: -: низкую теплоемкость -: низкую температуру испарения S: Величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда, является количественной характеристикой межионного взаимодействия и называется ### ### +: ионн#$# сил#$# I: S: Ионная сила (моль/л) 0,1М раствора хлорида кальция равна +: 0,30 -: 0,15 -: 0,60 -: 0,20 I: S: Ионная сила раствора сульфата меди (II) равна 0,252 моль/л. Коэффициент активности ионов меди составляет +: 0,095 -: -1,02 -: 0,006 -: 0,063 I: S: Вода – очень слабый электролит, поэтому ее молярная концентрация остается практически постоянной при ее диссоциации, а следовательно, остается постоянной и величина Кw = [H+][OH-], которую называют +: ионным произведением воды -: водородным показателем *I: -: активностью -: произведением растворимости S: Значение ионного произведения воды зависит только от температуры. При 220С оно составляет +: 1,00 10-14 моль2/л2 -: 8,31Дж/(моль К) I: -: 6,02 1023 моль- -: 14 S: Метиловый оранжевый в растворе с рН=2 окрашивается в …. цвет +: красный -: оранжевый *I: S: Лакмус в растворе с рН=4 окрашивается в …. цвет +: красный -: оранжевый I: -: желтый -: оранжево-желтый -: синий -: оранжево-красный S: Концентрация гидроксид-ионов в растворе с рН=4 составляет (моль/л) +: 10-10 -: 10-14 -: 10-4 -: 10-7 *I: +: [Н+] [ОН-] -: [Н+]=[ОН-] -: [Н+] 10-7  -: [ОН-] 10-7 -: [ОН-] 10-7*I:  S: Для раствора с рН=5,7 правильным является соотношение S: Для раствора с рН=5,7 правильным является соотношение+: [Н+] 10-7 моль/л -: [Н+] [ОН-] -: [Н+]=[ОН-] *I: S: Для раствора с рН=7 правильным является соотношение -: [Н+] [ОН-] -: [ОН-] 10-7 моль/л  -: [Н+] 10-7 -: [Н+] 10-7-: [ОН-] 10-7 моль/л I: S: Соответствие между биологической жидкостью и рН L1: сыворотка крови L2: чистый желудочный сок L3: содержимое тонкого кишечника L4: моча L5: R1: 7,4±0,05 R2: 0,9-1,1 R3: 7,0-8,0 R4: 4,8-7,5 R5: 6,35-6,85 |
