Кори дипломи. хидирова м коридипломи. Вазрати маориф ва илми УМурии тоикистон донишгои давлатии омзгории тоикистон ба номи садриддин айнї факултет химия Кафедра химияи органики ва биолог рисолаи хатм дар мавзи Методикаи халли масъалахои мохияти истехсоли дошта.
 Скачать 157.76 Kb. Скачать 157.76 Kb.
|
|
Масъалањои ананави муќарари ва мураккаб Пеш аз њама њалли масъалањои содда ба монанди масъалањои 1-Б-ро боядёд гирифт зеро масъалањои нисбатан мураккаб аз якљоя шудани якчанд масъалањои соддае ки њосил мешаванд яъне миќдори амалњои мантиќи ва њисоби дар масъалањои мураккаби омехта аз як ваду бештар аст. Намунаи чунин як масъалаи камбиниронидашудаи мураккабро дида мебароем, ки иљрои се амали мантиќии мураккабро талаб мекунад. Масъалаи 7 Њисоб кунед ки СаСО3 –и таркиби 200г оњаксанг мављудбуда ( оњаксанге Ки 12% ѓаш дорад) чанд молро ташкил медињад. Д.ш.а m( оњаксанг)= 200г W( ѓаш) = 12%  СаСО3 =? СаСО3 =?Тавре аз матн бар меояд масъала иљрои се амалро талаб мекунад. Муайян кардани m (ѓаш); m А = m (умумии)  WА/100% WА/100%Ёфтани миќдори моли СаСО3 аз рўи массаи он  (СаСО3 )= m (СаСО3 ) 1м (СаСО3) (СаСО3 )= m (СаСО3 ) 1м (СаСО3)Ёфтани массаи тозаи СаСО3 дар оњаксанг m А = m (А+В) - m (В) Яъне барои њалли ин масъала мо бояд аз уњдаи њалли се масъалаи соддаи техники бароем. Ёфтани массаи модда аз рўи Ёфтани компаненти таркиби омехта Њисоби миќдори мол аз рўйи массаи модда Њал: 1. Массаи ѓашеро дар оњаксанги табии њисоб мекунем 200г оњаксанг ______________100%-ро ташкил медињад Хг( ѓаш ) __________________12% Х= 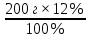 = 24г = 24гМиќдори ѓашро аз рўи формула низ њисоб кардан мумкин аст m( ѓаш ) = m(умуми)  W (ѓаш)/100% = W (ѓаш)/100% =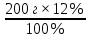 = 24г = 24гЊисоб кардани массаи тозаи СаСо3 аз рўи массаи он m (СаСо3) =m( оњаксанг)- m (ѓаш) = 200-24=176 Ёфтани миќдори моли СаСо3 аз рўи массаи он Мr (СаСо3)= 40+ 12+48= 100 100г________________1мол СаСО3 176г________________ х мол Х = 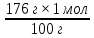 = 1,76 мол СаСО3 –ро ташкил медињад. = 1,76 мол СаСО3 –ро ташкил медињад.Масъалаи 8. масъалаи нисбатан мураккабтарро дида мебароем.Суммаи миќдори атомњои FeваS дар 200г FeS2 ба чанд баробар аст: Д.Ш.А m(FeS2) = 200гр N ( Fe+S)= ? Њал: 1. Массаи оњан ва сулфидро дар пирид њисоб мекунем. FeS2 ____________Fe 120г____________56г Х= 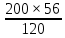 = 93,33гр Fe = 93,33гр Fe200г Х FeS2___________ 2S 120г 64г Х= 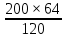 = 106,67 S = 106,67 SМиќдори моли 93,33 гр Fe ва 106,67г атомњои S –ро њисоб мекунем 56г атоми Fe _____________________1 мол аст. 93,33гр__________________________ Хмол Х= 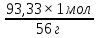 = 1,66 мол Fe = 1,66 мол Fe (S)= (S)= 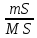 = = 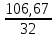 =3,33мол (S) =3,33мол (S)Миќдориатомњои 1,66 мол (Fe) ва 3,33 мол (S) –роњисобмекунем. 1 мол (Fe)_______________6,02  1023 атом дорад. 1023 атом дорад.1,66 мол (Fe) ____________Х атом Х= 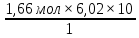 = 9,99 = 9,99  1023 атоми Fe 1023 атоми Fe1мол (S) _____________ 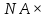 6,02 6,02  1023 10233,33мол _____________ Х Х= 3,33  6,02 6,02  1023 = 200 1023 = 200  1024 атоми (S) 1024 атоми (S) Суммаи атомњои Fe ва S 9,99  1023 +2,00 1023 +2,00 1024 ё 1024 ё 99,9  1023 +20,04 1023 +20,04  1023 = 30,03 1023 = 30,03 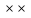 1023 ё 3,09 1023 ё 3,09  1024 атом 1024 атом Њалли масъалањои химияви бо бузургињое ки дар фанни физика истифода мешаванд, алоќаи зич дорад. Барои он ки ин бузургињо дар њисобкунињои химияви низ истифода мешаванд. Яке аз мавзўъњои асосии химия ки бо фанни ин суръати реаксияњои химияви ба њисоб меравад, ки дар он ба фишор њаљм,њарорат ва консентратсияи моддањои бо њам таъсиркунанда диќќати махсус дода мешавад. Ин раванди алоќамандиро кинетикаи химияви меноманд. Кинетикаи химияви гуфта тавсифи сифати ва миќдории таѓиротњое мебошад, ки дар воњиди ваќт њангоми реаксияњои химияви сурат мегиранд. Таѓироти сифати реаксия гуфта мо зинањои гузариши пай дар пай реаксияњоро дар назар дорем. Мисол: њангоми таъсири гази гидроген бо хлор аввал банди байни молекулањои Н2ва CL2 канда мешаванд. Яъне зиннаи аввали ин раванд Н : Н= Н:Н ва CL: CL = CL + CL мебошад. Сипас ин атомњо бо њам бархурда пайваст мешаванд Н + CL = Н: CL Ин ду зинаи раванди химиявиро мо дар намуди умуми чунин ишорат мекунем. Н2+CL2 = 2НCL  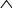 Тавсифи миќдории реаксияи химияви маънои муайян намудани нисбатњои миќдории, бо њам таъсир намудани молекулањо ва мањсули реаксияро дар воњиди ваќт мебошад.Фарз кардем дар давоми 44 сония ( t1 =22 ва t2 =66, t2 -t1= tтаѓирёбии ваќт t =, t2 -t1= 66-22=44) консентратсияи гази гидроген дар реаксия 0,4 мол кам шуд ( С1 = 0,9 мол) ва С2 =0,5мол он гоњ С2 – С1 = С ( 0,4 мол) њам шуд яъне консентратсияи Н2 таѓир ёфт аломати - С ишорат ба камшавии консентратсияи модањои бо њамтаъсиркунанда аст. Тавсифи миќдории реаксияи химияви маънои муайян намудани нисбатњои миќдории, бо њам таъсир намудани молекулањо ва мањсули реаксияро дар воњиди ваќт мебошад.Фарз кардем дар давоми 44 сония ( t1 =22 ва t2 =66, t2 -t1= tтаѓирёбии ваќт t =, t2 -t1= 66-22=44) консентратсияи гази гидроген дар реаксия 0,4 мол кам шуд ( С1 = 0,9 мол) ва С2 =0,5мол он гоњ С2 – С1 = С ( 0,4 мол) њам шуд яъне консентратсияи Н2 таѓир ёфт аломати - С ишорат ба камшавии консентратсияи модањои бо њамтаъсиркунанда аст.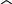 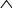 Яъне суръати реаксияи химиявї гуфта таѓирёбии консентратсияи моддањоро дар ягон фосилаи ваќт меноманд.Суръати миёнаи реаксияи Яъне суръати реаксияи химиявї гуфта таѓирёбии консентратсияи моддањоро дар ягон фосилаи ваќт меноманд.Суръати миёнаи реаксияи Н2+CL2 = 2НCL  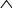 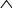 = = 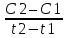 = С/ t мол /сония = С/ t мол /сония = = 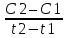 = = 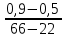 = = 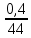 = 0,009 мол/сония = 0,009 мол/сония Реаксия аз бархурии молекулањо оѓоз мегардад ва суръати раксия аз миќдори он бархурдњо вобаста аст, яъне чи ќадаре, ки адади бархурдњои молеклањо зиёд бошад њамон ќадар суръати реаксияњо зиёд бошанд њамон ќадар суръати реаксияњои химияви баландтар мегардад ин аз энергияи фаъолшави (активатсия)-и молекулањо вобастааст. Њар ќадар консентратсияи моддањои бо њамтаъсиркунанда зиёд бошад.Њамон ќадар адади бархурди молекулањо зиёд гардида суръати реаксия низ меафзояд.Ќонуни таъсири масса суръати реаксия ба консентартсияи моддањои бо њам таъсиркунанда мутаносиби роста аст.     = К А = К А  В барои реаксияи боло; В барои реаксияи боло;  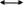 = К Н2 = К Н2 CL2 константаи собитаи реаксия аст. Дар реаксия Н2газ + CL2газ = 2НCLгаз ду молекула бо њам бархурда, пас ин реаксия бимолекулавии ( би –ду) ном дорад.Њарду моддаи бо њам таъсиркунанда ва мањсули реаксия низ модањои газанда аз рўи њолати агрегати реаксияи гомогенї аст. Агар дар реаксия се мода бо њам таъсир кунанд мисол: CL2 константаи собитаи реаксия аст. Дар реаксия Н2газ + CL2газ = 2НCLгаз ду молекула бо њам бархурда, пас ин реаксия бимолекулавии ( би –ду) ном дорад.Њарду моддаи бо њам таъсиркунанда ва мањсули реаксия низ модањои газанда аз рўи њолати агрегати реаксияи гомогенї аст. Агар дар реаксия се мода бо њам таъсир кунанд мисол:  2 газ + 2Н2О + 3О2 = 4 Н 2 газ + 2Н2О + 3О2 = 4 Н 3 моеъ ин реаксияи тримолекуляри меноманд. 3 моеъ ин реаксияи тримолекуляри меноманд.Ќоида: Бо гузаштани ваќт консентратсияи реагентњо ( моддахои бо њам таъсиркунанда) кам шуда консентратсияи мањлули реаксия ( моддаи њосил шуда) зиёд мешавад. Ин нуќтањоро њангоми њалли масъалањо бояд ба назар гирифт. Масъалаи 1 Суръати реаксияи зеринро њангоми ба 2 мол/л баробар будани консентаратсияи реагентњо њисоб кунед. 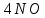 2 газ + 2Н2О + 2О2 = 4 Н 2 газ + 2Н2О + 2О2 = 4 Н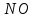 3 моеъ 3 моеъД.ш.аст ( 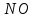 2) = 2мол/л 2) = 2мол/л (Н2О) = 2мол/л ( О2)= 24  22 22  2= 16 2= 16 4 4 2= 128 мол/л 2= 128 мол/лМасъалаи 2 Консентратсияи аммиак дар давоми 15 сония аввали гузаронии реаксия аз 4,25 то 3,5 мол/л кам шуд Суръати реаксияи 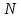 2 +3Н2 = 2 2 +3Н2 = 2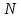 Н3-ро муайян кунед. Н3-ро муайян кунед.Д.ш.аст. С1=4,25мол/л С2=3,5 мол /л t 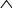 = 15с = 15сЊ 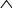 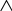 ал: ал: = С/ t тавре мебинем суръат нисбати таѓирёбии консентратсияи мода бар фосилаи ваќт аст пас = С/ t тавре мебинем суръат нисбати таѓирёбии консентратсияи мода бар фосилаи ваќт аст пас  = 4,25 -3,5/15 =0,75/15 =0,05 = 5 = 4,25 -3,5/15 =0,75/15 =0,05 = 5 10-2 мол/литр 10-2 мол/литрМасъалаи 3. Дар реаксияи зер 4 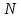 Н3 + 5О2 = 4 Н3 + 5О2 = 4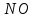 +6 Н2О консентратсияи аввалаи молярии +6 Н2О консентратсияи аввалаи молярии 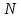 Н3 ба 2мол/л ва О2 ба 2мол/л баробар аст. Консентратсияи молярии реагентњоро њангоми 45% сарф шудани оксиген муайян кунед. Н3 ба 2мол/л ва О2 ба 2мол/л баробар аст. Консентратсияи молярии реагентњоро њангоми 45% сарф шудани оксиген муайян кунед.Д.ш.аст См( 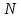 Н3) = 2мол/л Н3) = 2мол/лСм (О2) = 2мол/л W (О2) =45% См( 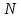 Н3) =? Н3) =?См (О2) =? Њал Фарз мекунем, ки њаљми системаи реаксия ба 1литр баробар аст. 1  (О2) ба реаксия дохил шуда. (О2) ба реаксия дохил шуда. (О2) = (О2) =  (О2) (О2)  45/100= 2 45/100= 2 0,45= 0,9мол 0,45= 0,9мол2) Консентратсияи молярии ( О2) ба реаксия дохил шуда 2-0,9=1,1 мол 3) Консентратсия О2 –и изофа: См (О2) =  О2/ О2/  =1,1 мол /1 =1,1 мол/1 =1,1 мол /1 =1,1 мол/14)  ( (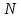 Н3) – бо 0,9 мол О2 ба реаксия дохил шаванда. Н3) – бо 0,9 мол О2 ба реаксия дохил шаванда.4 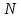 Н3 + 5О2 = 4 Н3 + 5О2 = 4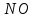 +6 Н2О +6 Н2О 4мол 5мол 4мол 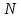 Н3 _________________ 5 мол О2 Н3 _________________ 5 мол О2Х мол 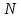 Н3 _________________ 0,9 мол О2 Н3 _________________ 0,9 мол О2Х= 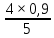 = 0,72 = 0,72 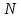 Н3 Н35) миќдори изофаи 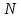 Н3 2- 0,72= 1,28 мол Н3 2- 0,72= 1,28 мол 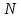 Н3 Н3См(О2 изофа ) См(О2)=  (О2) / (О2) /  = 0,72/1 = 0,72 мол/л = 0,72/1 = 0,72 мол/лМувозинати химиявї:Барои њал намудани чунин масъалањо бояд оиди реаксияи баргарданда, барнагарданда мувозинат системаи гомогени ва константаи мувозинат маълумот дошта бошем. Реаксияи химиявиро шартан ба ду гурўњ људо мекунанд. Реаксияи барнагарданда : реаксияе, ки дар натиљаи модаи катион шуда ё газ ё моддаи душвор њалшаванда њосил мешавад. С + О2= СО2 КМnO4= K2MnO4 + MnO2 + О2 AgNO3 +HCL = AgCL +HNO3 Реаксияи баргарданда: яъне реаксияи , ки дар ду самт мегузарад N 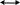 aNO3 + HCLNaCL + HNO3 aNO3 + HCLNaCL + HNO3Агар мо гўем, ки њамаи моддањои бо њам таъсиркунанда бо пурраги сарф шуда ба моддаи мањсули реаксия табдил меёбад метавонем ба хатоги роњ дињем чаро? Олимон исбот карданд, ки реаксияњо танњо ба як тараф мегузаранд ќариб, ки нестанд, зеро дар муодилаи муайяни ваќт мањсулоти байни якдигар таъсир карда метавонад ва ба моддањои аввала табдил шаванд.Мисол реаксияи зеринро дида мебароем.Њангоми таъсири гази гидроген бо J2 дар њолати баланд H2 +J2 = 2HJ газ молекулаи гидроген ва йод пурра ба њосилшави HJдарњамин шароит моддаи њосилшуда ба гидроген ва йод људо мешавад яъне реаксия баракс сурат мегирад. 2 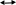 HJH2газ + J2газ реаксияи якум ба охир нарасида реаксияи дуюм сурат мегирад бо ибораи дигар дар як ваќт ду реаксия дар ду самт мегузарад ва онро бо тирчахо ваду самти муќобил ишорт мекунанд. HJH2газ + J2газ реаксияи якум ба охир нарасида реаксияи дуюм сурат мегирад бо ибораи дигар дар як ваќт ду реаксия дар ду самт мегузарад ва онро бо тирчахо ваду самти муќобил ишорт мекунанд. H2 +J2 = 2HJ Њангоми баробар шудани сурати реаксияи якум бо сурати реаксияи дуюм њолати мувозинат ба амал меояд Мувозинати химияви њолатест, ки дар шароити якхелаи реаксияи додашуда якбора дар ду самт мегузарад. Нисбати ифодаи суръати константашон суръати реаксияи якум бор ифодаи суръати реаксияи дуюм бузургии доими буда константаи мувозинат кам дорад. К мувозинат =  К мувозинат = 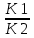 барои реаксияи аА + вВ + сС +дД барои реаксияи аА + вВ + сС +дД К мувозинат чунин навишта мешавад. К     1 Н2 1 Н2  J2 / К2С J2 / К2С Дконстанти мувозинат аз консетратсияи моддањо вобаста набуда тавсифи миќдории мувозинати химияви ба њисоб меравад. Дконстанти мувозинат аз консетратсияи моддањо вобаста набуда тавсифи миќдории мувозинати химияви ба њисоб меравад.Аз таъсири њарорат фишор ва њаљм таѓир ёфтани суръати реаксияњо аз рўи принсипи Ле Шателл муайян карда мешавад, ки чунин ифода меёбад Аз таъсири беруна ба системаи мувозинати гузариши њамаи реаксия –имконпазир аст, ки он таъсири берунаро суст мекунад. Масалан агар фишоро дар реаксияи зерин, ки дар њолати мувозинат аст зиёд намоем 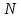 2 +3Н2 = 2 2 +3Н2 = 2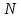 Н3 газ реаксия ба тарафи њосилшавии аммиак мегузарад. Н3 газ реаксия ба тарафи њосилшавии аммиак мегузарад.Аз таъсири баландшавии њарорат ба ин системаи дар мувозинат буда суръати њам реаксияи рост ва њам чап меафзояд. Лекин имконияти реаксияе, ки ба љазби гарми мегузарад зиёдтар аст. N  2 + O2 2NO -180 кг барои он ки реаксия эндотермии аст ва бо љазби гарми мегузарад. 2 + O2 2NO -180 кг барои он ки реаксия эндотермии аст ва бо љазби гарми мегузарад.Масъалаи 1 Ифодаи константаи мувозинатро барои реаксияи зер 2    SO2 + O2 = 2SO3 нависед ва њисоб кунед, ки дар њолати КОН консентаратсия SO2 = 2,8 л/мол SO3 =3 л/мол О2=2,8л/мол баробар будан константаи мувозинати реаксия ба чанд баробар мешавад? SO2 + O2 = 2SO3 нависед ва њисоб кунед, ки дар њолати КОН консентаратсия SO2 = 2,8 л/мол SO3 =3 л/мол О2=2,8л/мол баробар будан константаи мувозинати реаксия ба чанд баробар мешавад?Д  .ш.аст .ш.астS  O2 =2,8 л/мол O2 =2,8 л/молSO3 =3л/мол O2  2,8 л/мол 2,8 л/мол К мувозина =? Њал: К(мувозинат) = SO3 / SO2  O2 O2 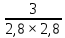 = = 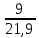 = 0,41 = 0,41Масъалаи 2 Дар реаксияи зерин агар 2СО + O2= 2СO2фишорро баланд кунем мувозинат ба кадом тараф майл хоњад кард. Њал: Њангоми бландшвии фишор мувозинат ба њамонтарафи моил мекунад,ки њаљми моддањо камтар бошад. Дар ин реаксияи додашуда њаљми СO2 2 мол аз њаљми СО2 + O2 ки 3 мол аст камтар пас мувозинат ба тарафи СО2 моеъ мекунад. Яъне суръати реаксияи тарафи рост зиёд мешавад. Масъалаи 3 Дар реаксияи зерин N2+ 3H2= 2NH3 + 92КЉњангоми 2 маротиба зиёд намудани консентратсияи реагентњо суръати реаксияи рост чанд маротиба зиёд мешавад? Њал: 1. Мувофиќи ќандии таъсири масса суръати аввалаи реаксия 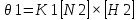 2.Сурати реаксияи охир њангоми 2 маротиба зиёд намудани консентратсияи реагентњо 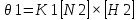 2 2 2 =2 2 =2 8= 16 8= 163. Нисбати суръати реаксияи охир бар суръати реаксияи аввала 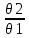 = = 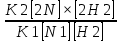 = = 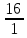 =16 љавоб суръати реаксияи рост 16 маротиба зиёд мешавад. =16 љавоб суръати реаксияи рост 16 маротиба зиёд мешавад.Катализ ва њалли масъалањо аз руи он њодисаи химиявиро, ки дар он бо иштироки катализатор таѓирёбии суръати реаксия ба амал меояд катализ меноманд. Реаксияњои бо иштироки катализтор гузаронидаро реаксияи каталитики меноманд. Бо баланд шудани њарорат дар њар як 100С суръати реаксия ду чор ммаротиба меафзояд. Ќоидаи Вант-Гофф 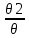 = = 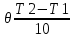  -коэфитсенти њарорат, Т2 –њарорати интихоби, Т1 – њарорати аввала, коэфитсенти њарорат нишон медињад, ки њангоми ба 100 гарм баланд кардани њарорат суръати реаксия чанд маротиба меафзояд. -коэфитсенти њарорат, Т2 –њарорати интихоби, Т1 – њарорати аввала, коэфитсенти њарорат нишон медињад, ки њангоми ба 100 гарм баланд кардани њарорат суръати реаксия чанд маротиба меафзояд.Дар реаксияњои химиявї на њар бархурда молекулањо самаранок аст. Он бархурда малекулањоро, ки дар натиљаи он малекулањо бо њам ба реаксияи дохил мешаванд. Бархурди самаранок ном дорад. Баландшавии харорат мањз ба зиёдшавии молекулањои фаъол оварда мерасонад.Бо зиёдшави њарорат миќдори онњо аз 200-то 400% меафзояд. Масъалаи 1. Дар њарорати 200С реаксия дар давоми 120 сония мегузарад. Давомнокии реаксияи додашуда дар 600С муайян карда шавад. Агар коэфисенти њароратии суръати реаксия ба 2 баробар бошад. Д.Ш.А Т2 = 600С Т1 = 200 С  = 2 = 2t1= 2,5 t2= ? Шарњ: Њароратро метавонем њам бо селсия ва келвин чен кунем. Дар ин мисол мо њаракат бо келвин њисоб карда шудааст, яъне К1= t+273 Т2= 273+60=33К Т1 = 273 +20 = 293 К Њал: Суръати реаксияи химияви бо ваќти гузариши он мутаносиби чаппа аст. Яъне 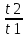 = = 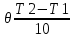 аз ин љо аз ин љо  = = 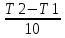 = = 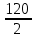 (333-293) = (333-293) = 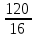 = 7,5 сония = 7,5 сония Масъалаи 2 Суръати реаксия дар њаракати 100С ба 2мол/л.с. баробар аст.Сурати њамин реаксияро дар 400 С њисоб кунед . Агар коэфитсенти њаракати реаксия ба 2 барбар бошад Д.Ш.А Т2 = 273+ 400С= 313 К Т1= 273+10= 283 К 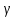 = 2 = 2  = 2мол/лс = 2мол/лс 2= ? 2= ?Њал : 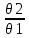 = =  = =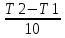 ; ;  2= 2= 1 х 1 х 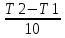 = 2 х 2 (313-283) = 2 х 8 16 мол /л.сония = 2 х 2 (313-283) = 2 х 8 16 мол /л.сония Истењсолоти химия ва њисоббарорињо дар он Мањлулњо вањалли масъалањо вобаста ба он Мањлул гуфта системаи гомогениеро меноманд, ки аз ду компанент иборат аст, њалкунанда ва њалшаванда, ки дар байни онњо ягон сарњад нест масалаи ќандоб намакоб ва ѓайрањо мањлулњо дар навбати худ сахт ва гази низ мешаванд. Мисол њаво мањлули гази њалшавандаи гази њалшавандаи оксиген, гази карбонат, буѓи об газњои асил, дар гази нитроген мебошанд.Хулањо бошанд мањлулњои сахтанд. Таркиби мањлулњо асосан бо њиссаи моддаи њалшаванда консентратсияи моляри, 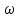 консентратсияи нормали ва титр ифода карда мешавад ва онњоро бо формулањои зерин ифода мекунанд. консентратсияи нормали ва титр ифода карда мешавад ва онњоро бо формулањои зерин ифода мекунанд.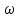 % = % = 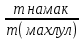 х 100% х 100%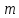 мањ= мањ= 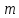 намак + намак + 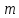 об ё об ё 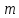 мањлул = мањлул = 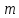 њалкунанда + њалкунанда + 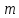 њалшаванда њалшаванда 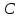 м= м= 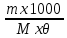  = = 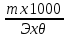 ; ; |
