Кори дипломи. хидирова м коридипломи. Вазрати маориф ва илми УМурии тоикистон донишгои давлатии омзгории тоикистон ба номи садриддин айнї факултет химия Кафедра химияи органики ва биолог рисолаи хатм дар мавзи Методикаи халли масъалахои мохияти истехсоли дошта.
 Скачать 157.76 Kb. Скачать 157.76 Kb.
|
 e2O3 2FeS2 e2O3 2FeS21мол __________2мол ё 160кг ___________2HOкг Пас массаи Fe2O3ба mFe2O3= 700х 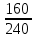 =467 баробар аст. =467 баробар аст.Барои њосил намудани 1 литр мањлул кислотаи сулфати 0,5 нормала чанд мл кислотаи сулфати 96%-и ( Р= 1,84 г/см3) гирифтан лозим аст. ЭH2SO4 = 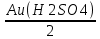 = = 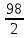 = 49 = 49Барои тайёр намудани 1л мањлули 0,5 гр эквиваленти H2SO4 гирифтан лозим . Аввал массаи кислотаро њисоб мекунем Р= 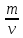 m= PхV= m= PхV= 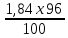 =1,77гH2SO4 =1,77гH2SO4Пас барои тайёр намудани мањлули 0,5 нормала дарњаљми 1 литр 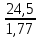 = 13,84 мл обњал мекунем. = 13,84 мл обњал мекунем.Масъала Аз 1 т пирити дорои 75,3% FeS2 , 13,1 % СиFeS2ва 11,6% ѓалињо чанд кг кислотаи сулфати 78,04% њосил кардан мумкин аст. Зимни сўзондани пирит 1,5 % њаљми S2 О –ро ки дар натиљаи реаксия њосил мешавад талаф меёбад. Талафи истењсолоти кислотаи сулфати истењсолот бошад ба 0,2% баробар аст. Њал: 1т пирит 753 кг FeS2( М2= 120) ва 131кг СиFeS2(М2 =184) дорад. 4FeS2 + Н2О = 2Н2О3 + 8 SО2 Аз 480 кг пирит 8 кмол дуоксиди сулфур њосил мешавад. Аз 753 кг пирит Хмол дуоксиди сулфур Х= 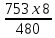 = 12,55 кмол SО2 = 12,55 кмол SО24СиFeS2+2SО313 О2 = 4СиО + 2 Fе2О3+ 8SО2 Аз 736 колчедани мис 8 кмол SО2 Аз 131 кг колчедани мис У кмол SО2 У= 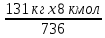 = 1,42кмол SО2 = 1,42кмол SО2Њамаги 12,56 + 1,42 =13,97 кмол SО2њосил мешавад дар шароите, ки талаф 1,5% -ро ташкил медињад. 13,97 х 0,015 = 0,21 кмол пас барои истењсоли кислотаи сулфат 13,97 – 0,21 = 13,76 кмол сарф мешавад. Њосилшавии кислотаи сулфат бо муодилаи зерин мегузарад. SО2+ О2= 2SО3 2SО3 + 2Н2SО4 = Н2S2О7 Н2S2О7 + Н2О = 2Н2 SО4 2    SО2 2SО3 Н2S2О7 2Н2SО4 SО2 2SО3 Н2S2О7 2Н2SО4Аз ин муодила бар меояд , ки 1 мол SО2 ,1 мол Н2SО4 Яъне 13,76 х 0,002 = 0, 0275кмол Н2SО4 баробар аст, пас 13,76 – 0,0275= 13,7325 кмол ё 13,7325 х 98 кг = 1346 кг кислотаи сулфати тозаро њосил кардан мумкин аст. Массаи мањлули 78,04% -и кислотаи сулфат ба Х = 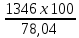 = 1724,8 кг = 1724,8 кгЁ њаљми он бошад. V = 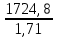 = 100 % 6 литр = 100 % 6 литр Масъала: Муаян кунед, ки барои тайёр кардани 480 гр мањлули 90%-и кислотаи сулфат чанд грамм мањлули 10% -и сеоксиди сулфур дар кислотаи сулфури тоза ва дар мањлули 60%-и кислотаи сулфат лозим аст. Њал : Дар 100 гр омуми 10%-и 10г SО3 ва 90 гр Н2SО4 -и 100% мављуд мебошад. Агар миќдори SО3 – њисоб карда шавад пас дар 90г Н2SО4 Шартан њамаги ( 18/98 х90 = 16,35г Н2О ва 100 – 16,53 = 83,47 г дар омум SО3 мављуд аст. Айнанњамин тавр дар мавриди кислотаи сулфати 60% -а 40 +60 х (18/98 = 40 +11,02 = 51,02 гр об 100 – 51,02 = 48,98 г SО3 мављуд аст. Дар 480 г кислотаи сулфат 90% -а 0,9 х 480 =432 г Н2SО4 ё 80/(98) : 432 = 325,65 SО3 ва 480-352,65)= 127,35 г Н2О мављуд аст.Бигзор Хгр омум гирифта шавад пас тезоби 60-и ба (480 –Х)г баробар мешавад. Дар омум (Х/100 х 83,47г SО3) ва дар кислота 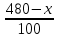 х 48,08г SО3 мављуд аст, ки њосили љамъи он ба 352,65 г SО3 баробар мешавад. х 48,08г SО3 мављуд аст, ки њосили љамъи он ба 352,65 г SО3 баробар мешавад.Аз ин љо 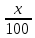 – 83 + – 83 + 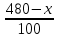 х 48,08 = 352,65 х 48,08 = 352,65Ин муодиларо њал карда меёбем Х= 340,8 омум мувофиќба тезоби 60% 480-340,8 = 139,2г баробар аст. Масъалањо барои њалли мустаќилона 1.Дар анбор омуми 18% мављуд аст.Чи ќадар омум ба 5т кислотаи сулфати 94% -а мувофиќат мекунад? Барои тайёр кардани 1т омуми 24% -а чи ќадар омуми 18% ва оксиди сулфур зарур аст 2.Њиссаињаљми дуоксиди сулфур зимни сўзонидани колчеданињосилшуда дар гази сўзанда њисоб карда шавад. Агарњамаи оксигени барои сўзонидан равонашуда пурра сарф шуда бошад. Мисолњо барои санљиш. 1.Кадоме аз реаксияњои зерин бањаќиќат мувофиќ аст? А. 4FeS2+ 11О2 = 2Fe2О3 + 8 SО2 + 3420кЉ Б. 4FeS2 +11О2 = 2Fe2О3 + 8 SО2 + 3420кЉ С. 4FeS2 + 11О2 = 2Fe2О3 + 8 SО2 + 816 кЉ Д. 4FeS2 + 11О2 = 2Fe2О3 + 8 SО2 + 816 кЉ 2.Барои оксидонии SО2баSО3 дар саноат аз кадом катализатор истифода меаранд. 1Pt 2 V2O5 3 Pdбо Pt 4.Оњани масомадор Истењсоли нурињои минералї Саноати маъдан ин саноатест, ки корхонањои истењсоликунандааш нурињои маъданиро ( нитрогени фосфори калийдор ва ѓайра) мутањид месозад. Нурии маъдании гуфта- намакњои дорои элементњои ѓизоии растанињои зарур бударо меномад, ки дар хок барои баланд бардоштани њосилнокии њамроњ карда мешавад. Вобаста ба тараќиёти техналогиимуосир талабот ба сифат ва миќдори нурињо рўз ба рўз меафзояд. Яке аз сифати муњими нурињои мављудияти элементи ѓизоиро барои нурињои нитрогени аз рўи мављудият нитроген, барои нурињои фосфори аз рўй Р2О5 барои нурињои калийдор аз рўй К2О ва барои нурињои калсийдор бошад аз рўй СаО мегузаронанд. Мисол: Мављудияти элементи ѓизоиро (њиссаи массаи %) дар нитрати калий њисоб кунед. Њал: Пеш аз њама массаи нисбии молии КNO3 –ро дар нитрати калий њисоб кунед . Mr( КNO3)= 101 г/мол . Массаи нисбии элементи ѓизои ба : Mr( К2O )= 94г/мол . Аз инљо К2Oба 2КNO3 мувофиќ меояд. 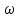 Н2О = Н2О =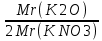 х 100% = х 100% = 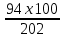 = 46,5% = 46,5%Нурињои нитрогендор – нитроген яке аз элеменњои асосиест, ки барои растанињо нињоят зарур аст. Намудњои гуногуни нурињои нитрогени мављуд аст: Силитраи аммиаки (NH4,NO3) 34,7% нитрати дошта, дар замин ба ионњои NH4 ва NO3 људо шуда ба растанињо љабида мешавад. Селитраи оњаки аммиаки 60%-а ин селитра дар таркибаш 40% СаСО3 дорад онњоро дар хокњои рангашон зарди аз калсий хароб истифода мебаранд. Сулфонитрат –омехтаи NH4NO3 ва (NH4)2SO4 , ки дар онњо 25,5% -26,5% нитроген мављуд аст. Сулфати аммоний (NH4)2SO4 дар таркибаш то 20,5 -21% нитроген дорад. Хлориди аммоний (NH4CL) то 24-25 % нитроген дорад. Селитраи натрий ( NaNO3) дорои 15-16 % нитроген мебошад. Силитраи калий ( К NO3) силитраи калсиё Са (NO3)2 дорои 13% нитроген ки аз 4 –то 10% дар об њалшаванда аст. Карбамит NН2 – С- NН2 аз нитроген бой буда дорои 46% нитроген мебошад. Онро асосан дар соњаи пахтапарвари ва сабзавотпарвари истифода менамоянд. Нурињои фосфордор Нурињои фрсфори нисфи њамаи нурињои маъдани истењсолкунандаро ташкил медињанд. Бе мављудияти фосфор њасилшавии хлорофилл ва гази дулоксиди карбон-ро њазм кунии растанињо имконпазир мебошад. Ба нурињои фосфори дохил мешавад. Фторапатит Са5(РО4)3Ѓ) дар таркиби он моддаи ѓизои Са5(РО4)2 дида мешавад. Супурфосфати оддї Са( Н2РО4)2 ва СаSO4 суперфосфати дучанда Са( Н2РО4)2 Парасипитат (СаНРО4 х 2Н2О) дар об камњалшаванда дар пай узви хуб њалшаванда Аммофое нуриест, ки дар таркибаш нитроген ва фосфордорад. Онро дар натиљаи боњамтаъсиркунии аммиак бо кислотаи фосфат њосил мекунанд таркиби он чуни наст. NH4H2PO4 (NH4)2HPO4 Нурињои калидор Нурињои калийдор дар њосилнокии растанињо хеле зиёд мекунанд. Миќдори зиёди калий барои парвариши, картошка лаблабу офтобпараст, заѓир тамоку ва миќдори ками он барои парвариши гандум љав ва наск истифода мешаванд ба нурињои калийдор мансуб аст. КCL, K2SO4 (хокистар) K3(PO4) KNO3 ва ѓайрањо Њалли масъалањо Масъалаи 1 Сарфшавии мањлули 75% CL ва 93% -и кислотаи сулфатро H2SO4-и барои таљзия 100 кг ашёи ѓализи апатит сарфшаванда бо воситаи ифодаи дар зер овардашуда њисоб карда мешавад. С H2SO4 = 1,75 ωСаО ( α)/ωСаО массаи H2SO4 88,3: 0,93 = 94,9 баробар аст. Масъали 2 Аммофос дар ионнишави таъсири мањлули 50% кислотаи H3PO4 бо аммиак њосил мешавад. Массаи аммиак ва кислотаи ( бо тонна) барои њосилкунии дуюмаш агар талафи моддаи ибтидои 4 %-ро ташкил дињад. Ҳал: Муодилаи њосилшавии амморфое чуни наст. H3PO4 + 2NH3 = (NH4)2HPO4 аз рўи ин реаксия массаи кислотаи 100 % -ро меёбем С H3 PO4 = (6 х98)/132 = 4,455 дар инљо 98 ва 132 массаи моли H3 PO4 ва NH4)2HPO4 аст. Массаи H 3PO4 - 50% -ро меёбем. С H 3PO4 = (4,455 х 100)/50 = 8,91 Барои њосл кардани амафоси массаи 6т миќдори зерин аммиак лозим С NH3= (1,545 х 100)/96 =1,6 Масъалаи 3 Ҳиссаи массаи фосфорро дар Р2О5 –њисоб кунед. 1 Массаи моли Р2О5 –ро њисоб мекунем. Мr (Р2О5 ) = 2 х31 + 5 х 16 = 142 ω (Р) = (2 х 31)/(142 ) х 100 = 0,437 х 100 = 43,7% Масъалаи 4 Массаи зарурии фосфорро барои њосил намудани 200 кг кислотаи H3 PO4 њангоми њиссаи массаи њосилшави тезоб аз нозилшави ба 0,9 баробар будан њисоб кунед. Ҳал: m (H 3PO4 ) = 200кг Н(H 3PO4 ) = 0,3 ___________________ m (р) = ? Мr =98 Мr (р) =31 m = (m амали )/(m назарияви ); n = (m амали )/(m назарияви ); m назарияви = m амали : n m назарияви =(m амали)/( n ) = (200кг )/(0,9 ) = 222,2кг m H3 PO4 = 222,2кг аз ин љо аз рўи реаксияи mр – ро њисоб мекунем 4Р + 5О2 = 2 Р2О5 : 2 Р2О5 + 6Н2 О = 4Н3РО4 ё 4Р + 5О2 = 2 Р2О5 = 4Н3РО4 аз як мол Р 1 мол Н3РО4 дар натиљаи ихтисор намудани њосил мешавад. Пас 98 к Н3РО4 ____________31 кг (р) 222,2 к Н3РО4_________________ х кг (Р) Х= (31х 222,2)/98 = 70,3 кг (Р) Масъалаи 5 Ба корхона 50т фосфорити дорои 35% љинси куњи оварда шуд. Массаи фосфорити калсийи тозаро њисоб кунед. Ҳал: Дар маъдан массаи фосфати калсий тоза ба 100- 35= 65%ташкил медињад. ω ( Са(РО4)2 = 0,65 М Са(РО4)2 = 50 m х 0,65 = 32,5 т Массаи ѓаш ба : m ѓаш = 50т х 0,35 =17,5 т m Са(РО4)2 = 50 m -17,5 = 32,5 т Масъалаи 6 Аз об ва њовво истифода намуда нитрати аммониро њосил кунед. Ҳаворо фишурда аз он нитроген ва оксиген дар њарорати 196 0С ва оксиген дар 1830С мељушад аввал нитроген ва баъд оксинген ба буѓ мубадал мешавад. Обро бошад электролиз намуда, гидроген ва оксиген њосил мекунанд Љараёни электролизи он чуни наст. Дар катод: 2Н+ + 2е_ 2Н ___Н2 Дар анод : 4ОН – 2Н2О + О2 + 4е- Дар саноат аз нитроген ва гидроген дар ишттироки катализатор ( Fe, 500- 5500С ва 200 -300 атм) аммиакро њосил мекунанд. N 2 + H2 2NH3 Зимни оксидшави дар иштироки катлизатор ( рt) ба оксиди NO мубадал мешавад. 4 NH3 + 5О2 4 NО + 6 Н2О 2 NО + О2 2 NО2 NО 2 + 2Н2О + О2 4Н NО3 Дар натиљаи нейтрализатсияи НNО3 бо аммиак нитрати амманий њосил мешавад. НNО3 + NH3 = NH3 NО3 Масъалањоро барои њалли мустаќилона. Барои њосил намудани 18700 кг нитрати аммоний 19724 менер мањлули 57 % кислотаи нитрат ( Р= 1351 кг/м3 ) сарф мешавад. Баромади аммалии селитраи аммонийро муайян намоед. Љавоб 96,96% Аз рўйи мављудияти нитроген ба 1кг карбамид кг сулфати аммоний рост меояд. Супоришњои тестї ( Са(РО4)2 + H2SO4 = ( Са(РО4)2 + СаSO4 Н3РО4 + Са(ОН) 2 = СаНРО4 х 2Н2О Н3РО4 + СаСО3 + Н2О = СаНРО4 + 2Н2О +СО2 ( Са(РО4)2 + H3PO4 = 3Са(Н 2РО4)2 Ҳалли масъалањо оиди техналогияи истењсоли , силикатњо (шиша, семент, хишт) Саноати силикатњо се соњаи асосиашро дар бар мегирад Истењсоли сафол истењсоли шиша ва истењсоли моддањои васлкунанда Истењсоли моддањо ба таркиби химиявии алюмосиликатњо вобаста аст. Таркиби шишаи силикати чунин аст: Моддањои сахт ки панљараи кристаллиашон бетартиб љойгиршудаанд шиша номида мешавад. КR2O × 1R2O × mRO2 дар ин љо К, I m R2O = Na2O K2O RO = CaO, BaO ,MgO, PbO RO2= SiO ( B2O3 , Al2O3) Усулњоиистењсолишишачунинаст: Алюмосиликатњоротоњарорати 11500 С- 12000 Сгармкардандбамоеъмубадалмекунандбаъдтоњарорати 1400 -1520 гармкардагазњояшропуррахориљмекнанд.Зинаидигаринтоњарорати 2000 -3000Схунукнамудамоеъичаспакњосилмекунандбаъдонродарколбањобашишатабдилмедињанд. Истењсолихишташёихомбароиистењсолихиштгиласттаркибигил 3-5% Al2O3 40-50% SiO2 ваазпайвастагињоиоњан, кидарваќтипухтанбаFe2O3 мубадалгаштарангисурхипастромегирад. Барои њисоб кардани истењсоли моддањо аз формулањо мебароранд. Модулаи гидровлеки (m) – ки он нисбати оксиди СаО-ро дар таркиби гил муайн мекунад. m=СаО/((SiO2+Al2O3+Fe2O3 )% ) Муодилаисиликати (m) n=(SiO2%)/((Al2O3+Fe2O3)) Муодилаигилхоњ (Р) Р= Al2O3/Fe2O3 Бузургињоиm, nварбароипортлондиментчунинмешаванд. m = 1,9 -2,4 ; n= 1,7 – 3,5; р= 7,0-3,0 Тавсифи умумии сементро бо формулаи ЗМ= (( СаОумуми-СаО озод )–( 1,65Al2O3+0,3Fe2O3 +0,7 SO2 )/(2,8 (SiO2 умуми- SiO2озод)) Њалли масъалахо оиди истењсоли электро химиявиї Раванди осиду барќароршави ки зимини аз мањлул ё гудохтаи электоролитњо гузаштани љараёни барќ њосил мешавад.Электролиз меноманд. Љаврёни электрохимиявиро ба таври умумии чунин ишорат мекунанд. Љараёни барќ љараёни химияви Гудохтањо 1 электролиз 2 мањлул К(-) Na + + CL- (Анод) (Катод) (-) Na + + CL- (Анод) Na + + 1е CL- 2 CL= CL2 +2е- 2Н2О + 2е- = Н2+ 2 Na 2 CL= CL2 +2е- Раванди натиљавии барќ Раванди натиљавии барќ 2КаCL 2К+ CL2 2КаCL + НОН = CL2 + Н2 + 2КаОН Њолатњои равандњои электородњо ќатори шидатноки филизот (металл) Дар катод Н+, К+, Са+ Na + , Mg+,AL+3,Zu2+,Cr+3,Fe2+,Ni2+,Sn2+,Pb2+ (H) Cu2+,Ag+,Ag 2+,Pt2+, Au3+ ДармахлулиобиэњтимолиятиљудоБарќарорнамешавадшавииМеваН2мешавад. хориљмешавадљойдорадМељудомешавад . Њаллимасъалањоинамунавї Масъалаи 1 ДарнатиљаиэлекторолизимањлулњоиобиNa2SO4NiCL2CuSO4 (анодазангишт) Кадомравандњоиоксидубарќароршавимегузаранд: Њал: Диссотсиатсияи электролити мањлули обии Na2SO4 чунин мешавад. N  a2SO42Na+ + SO42- a2SO42Na+ + SO42-Н  2О Н+ + ОН- 2О Н+ + ОН-Ионњои мувофиќро дар катод ва анод навишта аз рўи ќоидаи безараршавии онњо раванди оксиду барќароршави онњо раванди оксиду барќароршавиро менависем. К  атод (-) 2Na+ 2Н+ +2е- 2Н –Н2 атод (-) 2Na+ 2Н+ +2е- 2Н –Н2Анод (+) SO42- НОН- 4е- 2Н2О + О2 N  a2SO4 + 2Н2О Na2SO4+ 2Н2 + О2 a2SO4 + 2Н2О Na2SO4+ 2Н2 + О2МањлулиNiCL2 N  iCL2 Ni2+ + 2CL2 iCL2 Ni2+ + 2CL2H  OH H+ + OH- OH H+ + OH-Кадод (-) Анод (+) N   i2+ +2е-Ni 2CL2 -2е- 2 CL2 i2+ +2е-Ni 2CL2 -2е- 2 CL2Н+ ОН- N |
