Кори дипломи. хидирова м коридипломи. Вазрати маориф ва илми УМурии тоикистон донишгои давлатии омзгории тоикистон ба номи садриддин айнї факултет химия Кафедра химияи органики ва биолог рисолаи хатм дар мавзи Методикаи халли масъалахои мохияти истехсоли дошта.
 Скачать 157.76 Kb. Скачать 157.76 Kb.
|
|
ВАЗРАТИ МАОРИФ ВА ИЛМИ ЉУМЊУРИИ ТОЉИКИСТОН ДОНИШГОЊИ ДАВЛАТИИ ОМЎЗГОРИИ ТОЉИКИСТОН БА НОМИ САДРИДДИН АЙНЇ Факултет: химия Кафедра: химияи органики ва биологӣ РИСОЛАИ ХАТМ Дар мавзўи «Методикаи халли масъалахои мохияти истехсоли дошта.» Иҷрокунанда: Донишљўи курси 4-уми факултети химия ихтисоси химия шўъбаи рўзона Хидирова Мехрубон Роњбариилмї: Омузгори калон Махмадаминов М Душанбе – 2017 Мундариља Муќаддима 1-2 Боби 1 Шарњи адабиёт 3 Њалли масъалањои њисобї ва наќшаи он дар омўзиши химия 3-6 Алоќаи байни фанни дар њалли масъалањои химиявї 7-21 Моњияти њалли масъалањои њисоби дар интихоби касб 21-28 Боби 2 Њалли масъалањои моњияти иќтисоди дошта дар омўзии химия 29-32 Истењсолоти химияви ва њисоббарорињо дар он 33-38 Бобои 3 Озмоиши педагогии мавзўъ: Номгўи чорабинињое, оиди ин мавзўъ пешнињод шудааст. Интихоби масъалахое, ки ба иќтисод ва истењсолии Љумњури нигаронида шудаанд. 4. Хулоса 5. Адабиётњо Сарсухан Муњимиятиомўзиши мавзўъ: Њалли масъалањои химияви, яке аз методњои хоси омўзиши фанни химия ба њисоб меравад. Он омўзгоре дар соњаи омўзгории химия мувафаќ њисобида мешавад, ки агар методикаи њалли масъалахои њалли масъалањои химиявиро наѓз аз худ карда бошад. Њарчанд, ки ин мавзуъ ќарибки њаматарафа аз худ омўхта шудааст. Лекин як методикаи муайяни њалли масъалањои химияви то ба њол пешнињод нашудааст, барои он, ки ин фан пањлуњои гуногуни омўзиши худро дорад. Чуноне, ки маълум аст Љумњурии мо ба наздики 25 солагии истиќлолияти худро љашн гирифт, ва истењсолотњои химияви низ нав рў ба ташакул нињодаанд.Асоси истењсолоти њозираи Љумњурии мо ин истењсоли семент, алюминий, нурињои минерали, кислотаи сулфат, криолит, ангишт, оњан, ва металњои ранга ба њисоб мераванд.Бинобар ин њалли масъалањои химиявие, ба истењсолот ва иќтисодиёти Љумњурии нигаронида шудаанд, яке аз масъалањои њалталаби рўз ба њисоб меравад. Ин аз як тараф сарфањм рафтан ба моњияти истењсолот бошад аз тарафи дигар ин интихоби касбњои химиви барои довталабон ба њисоб меравад. Маќсад ва вазифањои озмоиши: Маќсади мо дар ин озмоиши ба хонандагон омўзонидани њалли масъалањое, ки моњияти истењсоливу дошта барои интихоби касбњои химияви ёри расонад. Барои расидан ба ин маќсад бояд вазифањои зеринро иљро намуд Интихоби масъалањое, ки моњияти истењсоливу иќтисоди доранд. Аз љињати методи дуруст ва фањмо намудани онњо Ба хонандагон фањмонидани моњияти иќтисодии истењсолоти химияви Дар асоси њалли масъалањои намудани касбњои химиявии њозиразамон ташхисгар, оњангудоз кнт коргар заводи семет оњакпази истењсоли нурињои минерали ва ѓайрањо Ба наќша гирифтанд, ва омода намудани чорабинињое, ки дар рафти озмоиш гузарониа мешавад. Омода намудани супоришњои фарди . Омода наудани виктаринањои химиявии Ташкил намудани вохурињо бо намояндагони корхонањои истехсолотњои химияви ва ѓайрањо мебошанд. Навгони амалии озмоиш: Њар чанд њал намудани масъалањои химияви дар ин ё он намуд навгони набошад њам лекин њалли масъалањо моњияти иќтисоди дошта дар рафти дарс чорабинињои берун азсинфи ё супоришњои мустаќилонаи фарди ин навгони аст. Њаљми кор : Ин рисолаи хатм дар њаљми 80 сањифа дастнавис аз пешгуфтор 2 боб ќисми озмоиши хулоса ва рўйхати адабиётњои истифодашударо дар бар гирифта як маводи хуби омўзиши барои донишљуён ва омўзгорони љавон ба њисоб меравад. Бобои 1 Шарњи адабиёти мавзўъ: Њалли масъалањои химиявї ва наќши он дар омўзиши химия Њар як фанни омўзиши методикаи омўзиши худро дорад умуман калимаи методика аз калимаи юнониmetodos гирифта шуда маънои луѓавиаш роњњои расонидан ба маќсад ба тартиб даровардани фаъолият аст. Дидактикаи муосир њануз таърифи муайни методи таълимро,ки маќбули њама бошад, пешнињод накардааст.Дидактика ин назарияи таълим аст, дар дидактика зери мафњуми методњои таълим ба тартиб даровардани роњњои ба њамдигар алоќаманди фаъолияти муаллим ва хонанда барои расидан ба маќсадњои таълим фањмида мешавад. Дар методикаи таълими химия –низ таърифи ягонаи муайяни аз тарафи њама эътирофшуда вуљуд надоард. Фанни химия њамчун фанни омўзиши методњои хоси таълими худро дорад ба ин методњо дохил мешаванд. 1.Мушоњидаи объектњои химиявї 2.Модулкунонии объектњои химияви 3.Тасвири объектњои химияви 4.Пешгўии далелњо ва њодисањои химиявї 5.Озмоиши (таљриба)-и химияви 6.Њалли масъалањои химияви Дар байни ин методхо “њалли масъалањои химиявї” методи махсус ва ќарибки хоси таълими химия ба њисоб меравад. Аз се маќсад ва се вазифаи асоси ки дар назди таълими химия меистад -Таълими -Тарбияви -Инкишофдињи њалли мсъалањои химияви барои инкишофи ќобилиятњои фикрии хонанда аз њама асоси буда хонандаро руњан инкишоф медињад ва ин боис мешавад, ки хонанда њамчун фард ќобилиятњои фикри худро њис кунад.Яъне дарк мекунад, ки ў чи ќобилият дорад, ва кушиш мекунад, ки ќобилияташ-ро дар амал тадбиќ намояд. Масъалањои химияви њамчун методи хоси таълими химия барои баланд бардоштани сифати таълим, мустањкам намудани дониши гирифташуда ташаккули дониш ва истифодаи он дар мавќеъ ва ваќти зарурї алоќаи дохилифанни ва байни фанни, рушди тафаккур ва дигар хусусиятњои шахсият ёри мерасонад. Мувофиќи барномаи таълими химия талабагон бояд њалли масъалањоро аз рўи формула ва реаксияњо иљро намоянд. Алакай дар синфи њаштум онњо масъалањои њисобиро њал карда тавонанд. Ин масъалањо чунинанд: Њисоби массаи нисбии молекулавии моддањо аз рўи формулањо; Њисоб аз рўи муодилањои химияви, ки миќдори яке аз моддањо дода шудааст ва мањсули реаксия : Њисоб аз рўи муодилањои химияви, ки миќдори яке аз моддањо дода шудааст ва мањсули реаксия: Њисоб аз рўи муодилањои химиявї, ки њаљми газњо дода шудааст ва мањсули реаксия ; Њисоб аз рўйи мол ченаки миќдори модда Њисоб аз рўи зиччи нисби газњо Њисоб аз рўи њиссаи фоизи элемент дар пайвастаги ва аз рўи фоизи элемент тартиб додани формулањои химияви Њисоби миќдори массаи Моддањо дар мањлул ва ѓайрањоро њал карда тавонад. Дар , байни ин методњо “ њалли масъалањои химиявї” методи махсус ва ќариб, ки хоси таълими химия ба њисоб меравад. Аз се маќсад ва се вазифа асосие, ки дар назди таълими химия меноманд. - таълими - тарбиявї - инкишофдињи Њалли масъалањои химияви барои инкишофи ќобилиятњои фикрии хонанда, аз њама асоси буда, хонандаро руњон инкишоф медињад ва ин боис мешавад, ки хонанда њамчун фард, ќобилиятњои фикрии худро њис кунад, яъне дарк мекунад, ки ќобилияташ- ро дар амал тадабиќ менамоем. Масъалањои химияви њамчун методи хоси таълими химия барои баланд бардоштани сифати таълим мустањкамнамудани сифати таълим, мустањкам намудани дониши гирифташуда, ташаккули дониш ва истифодаи он дар мавќеъ ва ваќти зарурї, алоќаи дохилифанни ва баёни фанни, рушди тафаккур ва дигар хусусиятњои шхсият ёри мерасонад. Мувофиќи барномаи таълими химия талабагон бояд њалли масъалањоро аз рўи формула ва реаксияњо иљро намоянд. Алакай дар синфи 8-ум онњо бояд масъалањои њисобиро њал карда тавонанд. Ин масъалањо чунинанд: Њисоби массаи нисбии молклавии моддањо аз рўи формулањо: Њисоб аз руй муодилањои химияви, ки миќдори яке аз моддањо дода шудааст ва мањсули реаксия; Њисоб аз руй муодилањои химияви, ки њаљми газњо дода шудааст ва мањсули реаксия ; Њисоб аз руи мол ченаки миќдори модда; Њисоб аз руи зичии нисбии газњо; Њисоб аз рўи њиссаи фоизии элемент тартиб додани формулаи химияви; Њисоби миќдори массаи моддањо дар мањлул ва ѓайрањоро њал карда тавонанд; Дар ваќти таълими химия ва њалли масъалањои химиявии озмоиши диќќати махсус додан лозим. Хусусиятии хоси онњо ин аст, ки масъалањои озмоишии дар њар як синф озмоишњоеро дар бар мегиранд,ки ба сатњи дониши хонандагон вобаста бошад.Мисол дар синфи 8-ум њамон масъалањои озмоиширо дар бар мегиранд, ки танњо моддахои химияи ѓайриорганики бошанд. Барономаи химияи мактаби чунин навъњои масъалањои (таљрибави) озмоишро дар бар мегирад. Дар асоси озмоиши њосил кардани моддаи муайян. Дар асоси озмоиш баровардани муодилањо Ба амал овардани реаксияњои химиявии ба њолати моддањое; Дар асоси њалли масъала њосил намудани моддаи муайян. Муайян намудани таркиби сифати моддањо Аз руй ду ё се моддаи додашуда муайянкардани њар яки онњо Муайян кардани синфи моддањо ва њодисањо. Дар раванди ин масъалањои озмоишии ташакул дода мешавад.Солњои охир бештар ба супоришњои тести ахамият медињанд барои он ки бо таќозои замон, довталабон тавасути маркази тести, ба донишгоњњо дохил мешаванд инчунин ду соли охир озмунњои фанни яъне олимпиадањои фанни тавассути супоришњои тести мегузаронда. Лекин ин маънои онро надорд, ки барои њалли масъалањо диќќати камтар дињем . Хонанда дониши мукамали химиявиро танњо дар натиљаи њал намудани машќу масъалањои химияви ба даст меорад. Алоќањои байни фанни дар њалли масъалањои химияви Вазифаи нињоят масъулиятноке, ки дар назди мактаб меисад ин ба камол расонидани хонандаи њаматарафа инкишофёфта ба њисоб меравад. Ин вазифа танњо дар натиљаи бо њам омезиш додани фаннњои таълими интихоби равияњои муайни омўзиши, ба даст оварда мешавад. Алоќаи баёни фанни ва дохили фанни элементи асосии ин њамгирои ба њисоб меравад. Дар омўзиши химия њангоми њал намудни масъалањои химияви хонанда бояд, донишњои захиравии худро аз фаннњои математика , физика,биология ва химия истифода намуда њалли ягонаи онро ёбад. Бинобар ин ваќти њалли масъала донишњои захиравиашонро боз як бор аз фикр мегузаронад агар лозим шавад аз адабиётњои мухталиф аз шабакаи интернет истифода намуда масъалаи пешнињод шударо њалменамоянд ва ин имконият медињад хонанда фикрони инкишоф ёбад ва маълумотњои навро аз худ намояд. Њалли масъалањои химияви бештар бо фанни математика ва физика алоќаи зич дорад. Барои он, ки он бузургињое, ки дар ин фанњо истифода мешавад, дар фанни химия низ истифода шавандаанд. Масъалањои химиявиро омўзгор метавонад дар лањзањои гуногуни дарс дар намуди супоришњо пешнињод намоед. Супориши химияви шакли дар амал тадиќ намудани донишу малакаи химияви мебошад, ки бе шубња пешравии зењну идрок таъсири мусби мерасонад. Супоришњои химияви чунин мешаванд. Савол намуди супориш мебошад, ки зењнро ба тариќи оварда чизи наверо ба дониш доштаашон зам менамоед. Масалан саволи “ Чаро офтоб рушнои ва гарми медихад”-ро мегирем. Ваќти хонанда огоњ мешавад, ки дар дохили офтоб, реаксияњои химияви суръат мегиранду дар натиља гарми ва рушнои ба замин пањн мегардад.Онњоро дар њал њисси гуворое фаро мегирад зеро дар њаќиќат њам дарк менамоянд, ки аз як чизи наве огоњ шудаанд. Машќї химияви- машќ супориши нисбатан соддае, ки ба пайдошавии ќобилияту малакањои аввалини химияви мусоидат мекунад. Машќњо якчанд намуд мешавад. Мантиќи, ахбориву амали њисоби ва омехта. Намунаи чунин як машќ;ZnO ва CO2- ро бо њам муќоиса намоем. Њал: а) умумияти њарду пайвастњо ба гуруњи оксидњое дохил мешаванд. Б) фарќияти пайвастњо ZnO -модаи сахт, дорои банди ионї оксиди амфотери буда њам бо кислотањо ва њам бо ишќорњо ба реаксия дохил мешавад. ZnO + 2HCL = ZnCL2 + H2O; ZnO + 2 NaOH = Na2ZnO2 + H2 O; Дарнатиљаиреаксиянамаква об њосилмешавад. CO2 -оксидикислотаги, дорои банди ковалентииќутби, бо об кислота вабоасосњонамаква об њосилмекунад. CO2 + H2O = H2 CO3 , CO2 + 2NaOH = Na2 CO3 + H2O, Њаллимасъалањоихимияви–Супоришинисбатанмураккабемебошад,кидароншароитимушаххас, алоќамандиифунксионалиибайнибузургињоовардашудаастванисбатишартимасълаељавобимушахасроталабмекунад. Иловабаринмасъалаихимиявивоситаикомилшавиидонишихимиявибањисобмеравад, боибораидигармасъалавоситаиистифодаикомплексиидонишљўќобилиятвамалакаихимиявибањисобмеравад.Намунаиякмасъалаихимиявиродидамебароем; Њисобкунед, кибароисухтани 1,5 мол Рчандгр гази оксиген лозиммешавад. Д.ш.а. D (P) = 1,5 mO2 = ? Њал: Ин масъала аз номуайянкарданинисбатимиќдориибайни 1,5 мол Рвамассаиоксигени ба реаксиядохилшудароталабмекунад. Аввалмассаи1,5 мол Р-роњисобмекунем. 1  мол Р= 31 гр х= 1,5мол * 31гр /1 мол= 46,5г/мол мол Р= 31 гр х= 1,5мол * 31гр /1 мол= 46,5г/мол1,5 мол Р= Хгр ДуюмМассаиоксигенибареаксиядохилшудароњисобмекунем. 4Р +5О2 = 2Р2О5 4  *31 ________________10*16гр *31 ________________10*16гр 46,5гр_______________ Хгр х= 46,5гр *160/121= 60гр Љавоб: бароипурра сўхтани 1,5 мол Р 60гр оксиген сарфмешавад. 4.Тести химиявияке аз шаклњои дар замонимопешрафтшудаисанљишидонишиназариявиваамалиявибуда дар се шаклпешнињод карда мешавад. А) Супориши тести боинтихоби як љавоб Б) Муайяннамуданимувофиќат В) Супоришњои тести шакликушода Намунаи мисолињар яки онродидамебароем А) Маъноиномикадом элемент офтоброифодамекунад. А) нитроген, Б) гелий В) алюминий, Г) фтор Б) Мувофиќатробайнимафњумњовааломатуформулањомуайнкунед; А) нитроген, Б) гелий, В) алюминий, Г) фтор. Б) Мувафаќиятробайнимафњумњовааломатуформулањомуайянкунед; 1. атом, 2. Кристалогидрат 3. Молекула 4. Полимер А) CuSO4 * 5H2OALH2O (- CH2 – CH2 -) n. Љавоб 1-б, 2-а, 3-в, н-г В) Миќдориатомњоиметаллро дар 4мол Na натрий њисобкунед. 1мол Na____________________6,02 * 10-23 атом 4мол Nа____________________ Х атом Х= 4 * 6,02 * 1023 = 2,4 *10 24 атом дорад. Чуноне, ки дар болоќайднамудемњаллимасъалањоихимиявибофаннњоиматематикаву физика алоќаи зич дорад ва бе ин фан мисли як дењќонибедастубекаландаст. Метавонњамаќонуниятњоитабиатизиндаробозабони математика ифода кард « Ќонунњоитабиатбозабони математика навишташудаанд» Азбаскитабиатитарзимављудотимоддањоихимиявистуќонунњоибоњамтабдилшавиионњоро химия меомўзад, бинобар ин алоќамандионњоробузургињои физики пуррамесозандонњоро аз якдигарљудо кардан мумкиннест. Барои он, кињамаиќонунњоихимиявитабиати физики дорандваагаробразнок карда гўембашањри химия аз диёриматематикаву физика омадаанд. Магархосиятваќонунњоихимиявиробеаломатунисбатњовуададњовуифодањои математики ќонунњоигузариширеаксияњоробеназарияњовубузургињоифизикавиифодаватасвирдоданмумкинаст? Албата не! Азбас, ки химия фаннитаљрибавист, њар сари ќадамњисобу китоббароихимиконногузираст. Таърихи химия олимонеро медонад, кибо математика он ќадаролимнадоштаанд, вале бовуљуди ин онњо дар илми химия наќшихотирнишонихудрогузоштаад. Математика асбоберо пеши назармеорад, китавасути он мометавонем. Њисобкунињоихудросодавуосонтаргардонем. Аз мо на дараљаиолиидонишиматематики, балки фањмишикофивашарњиќаноатбахшичунинмафњумњое, аз ќабили «таносуб» ќисмибутун «нисбатимассавивањаљми» «Идеали–реали» «ќонуни –тасодуфи»,сабаб-натиља» , «Мутлаќ –нисби» ваѓайрањоталаб карда мешаваду бас. Њар як масъалаихимияви аз дуќисмиборатаст; ќисмихимиявиваќисми математики. Ин дуќисммислитарафњои як танга аз якдигарљудонашавандаанд. Дар расмдеворињисобкунии математики масъалаи сифатиихимиявинињонаст. Ин чимаъно дорадва ќисмихимиявиимасъалачиро дар бар мегирад? Бароиба ин саволљавоб додан масъалањоизеринроњалмекунем; Масъалаи 1. Формулаикупоросимис (дањанифаранг) чуни аст; CuSO4 * 5H2O нисбати массавии оксиген ва гидрогенро дар таркиби купроси мис муайян кунед: Д.Ш.А CuSO4 *5H2О _____________ mO :mH=? Асосиќисмихимиявиимасъалањоимазкурромафњуми формула ванисбатимассавиташкилмекунад. Яънеформулаимоддаронавиштабаъд аз рўи он ба њисобкунињои математики мегузарем. Формула нишонмедињад, ки дар купороси мисатомњоиэлементњобочуниннисбатбоњампайваст шудаанд: mO: mH mCu:mO:mH= 1:1:9:10 яъне ба 9 атоми аксиген 10атоми гидроген рост меояд. Mr( CuSO4* 5H2O)= 64+32+16 *9+10*1=96 +144+10= 250 г/мол аз ин љо mO: mH= 9*16*10*1=144 :10 =72 :5 Читавре, ки мебинем барои њалли дурусти масъала аввал мо бояд ба ќисми њимияви он бояд дуруст сарфањм рафта, баъд ба њисобкунињои математики гузарем яъне аз рўи муодилањои њисоби ќисми матекматикии онро анљом дињем. Муодилаи њисоби барои он лоим аст, ки њисобкунињои химияви ба осони сурат бигиранд. Воќеан њам ќисми душвори њалли масъала тартиб додани муодилаи њисоби ё бо ибораи дигар тартиб додани модели математики масъала ба шумор меравад. Дар навбати худ модели математики масъала вобаста аз шарти масъала метавонад нисбат, таносуб ё муодила бошад. Дар амалия њамаи формулањо дар маљмўъ , ки дар њалли масъалањои химияви истифода бурда мешаванд муодилањои њисоби ба шумор мераванд ва алоќамандии бузургињои додашударо дар масъала инъикос менамоянд. Истифодаи формулаи тайёр маънои истифодаи муодилаи њисобии тайёрро дорад. Ба муодилаи њисоби ба шумор рафта алоќамандии бузургињои додашударо дар масъала инъикос медињад ва аз рўи он бузургии номаълум њисоб карда мешавад. Масалан: Д= m/Mr Д= миќдори модда, m= масса, Mr= массаи нисбии молекулави буда маънои химиявии он нисбати массаи моддаро бар массаи нисбии молекулавии он нишон медињад. Бо истифодаи ин муодила њисоби њалли якчанд масъаларо дида мебароем. Масъалаи 2. Массаи 8 мол обро њисоб кунед. Д.Ш.А. H2О Mr(H2О)= 18 г/мол Vоб= 8мол M= ? Њал : Муодилаи њисоби барои масъалањои мазкур формулаи V= m/ Mr2 ба њисоб меравад. Бояд дар назар дошт, ки формулаи V= m/ Mr2 -ро њамчун таносуб 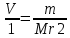 нишон доштан њато намедавад. Пас аз инљо МV= 1×m×m= = нишон доштан њато намедавад. Пас аз инљо МV= 1×m×m= = 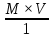 ;m = V× М ; mоб = Моб ×Vоб = 8× 18 = 144 грамм фарз мекунем, ки дар масъала ќиматњои фишор њаљм ва њарорат дар шароити нормали дода шудаанд, ва ќиматњои фишор ва њарорат дар шароити ѓайринормалї дода шудаанд ва шарти масъала талаб мекунад,ки ќимати V њаљми дар шароити ѓайринормали ёфта шавад. яъне : ;m = V× М ; mоб = Моб ×Vоб = 8× 18 = 144 грамм фарз мекунем, ки дар масъала ќиматњои фишор њаљм ва њарорат дар шароити нормали дода шудаанд, ва ќиматњои фишор ва њарорат дар шароити ѓайринормалї дода шудаанд ва шарти масъала талаб мекунад,ки ќимати V њаљми дар шароити ѓайринормали ёфта шавад. яъне :Д.Ш.А V0, Р0, Т0, Р, Т – ќиматњои маълум ва V=? Дар ин њолат аз формулаи ќонуни љамъбастии газњо 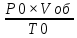 = = 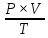 истифода намудан мумкин аст. Т аз ин љо таносуби онњоро чунин менависем. Р0 V0 Т= РV× Т0 аз ин љо V= истифода намудан мумкин аст. Т аз ин љо таносуби онњоро чунин менависем. Р0 V0 Т= РV× Т0 аз ин љо V= 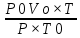 ; ;Яъне барои њалли масъала муодилаи њисоби тартиб медињем, ки аз рўи он бузургии масса, њаљм, миќдори мол, адади заррањо ва ѓайрањо њисоб карда мешаванд.      Маънои математикии њар як муодила ин ёфтани бузургии номаълуме мебошад, ки њангоми ба муодила гузаштани он яъне ќимати ёфташудаи он муодила ба аёният мубадал мешавад. Яъне ба муодилае, ки њарду тарафаш баробар аст мубадал мешавад. Фаќат бояд дуруст андеша намуд, ки кадом формула ё муодилаи њисобиродар куљо ва чи тавр бояд истифода намуд. Пеш аз њалли масъалахо муаян намудани алоќамандии байни бузургињои дар матни масъала овардашударо бояд омўзем. Аз схемаи Маънои математикии њар як муодила ин ёфтани бузургии номаълуме мебошад, ки њангоми ба муодила гузаштани он яъне ќимати ёфташудаи он муодила ба аёният мубадал мешавад. Яъне ба муодилае, ки њарду тарафаш баробар аст мубадал мешавад. Фаќат бояд дуруст андеша намуд, ки кадом формула ё муодилаи њисобиродар куљо ва чи тавр бояд истифода намуд. Пеш аз њалли масъалахо муаян намудани алоќамандии байни бузургињои дар матни масъала овардашударо бояд омўзем. Аз схемаи  mV mV истифода намуда формулањое, ки дар онњо алоќамандии масса, мол, ва њаљм оварда шудаанд менависем. Алоќамандии mVm= М × истифода намуда формулањое, ки дар онњо алоќамандии масса, мол, ва њаљм оварда шудаанд менависем. Алоќамандии mVm= М ×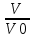 : Алоќамандии масса m бо миќдори модда. m = : Алоќамандии масса m бо миќдори модда. m = 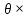 Mr Алоќамандии V Mr Алоќамандии V V = V =  ×V0 ×V0Масъалаи 3. Массаи 48л гази карбонатро њисоб кунед. Дар ин љо аз формулаи алоќаманди њаљм бо масса истифода мекунем. Њал: m= М × 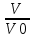 : Ќиматњои лозимаро дар формула гузошта массаи 48 л гази карбонатро њисоб мекунем. m СО2= МСО2 : Ќиматњои лозимаро дар формула гузошта массаи 48 л гази карбонатро њисоб мекунем. m СО2= МСО2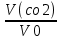 = 44 = 44 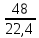 = 44 × 2,14 = 94,1 гр = 44 × 2,14 = 94,1 гр Аз наќшаи дар зер оварда шуда истифода намуда формулањои алоќамандии бузургињои дар наќша оварда шударо муайян менамоем. Q   m      М М m0 NA PN0Vm V Муодилаи њисоби барои њисобкардани а) масса (m) m = m0 ×N, m= V× М, m = 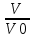 ; m = М ; m = М 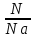 б) V = 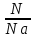 ; ; 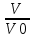 = = 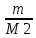 ; Миќдори химиявии модда ; Миќдори химиявии модда  = = 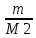 ; ; 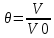 ; ; 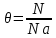 ; ; 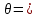 Р×V/ Р Р×V/ Р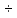 Т Тв) Њаљм V;V= 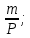 V= V= 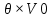 ; V= V0 ; V= V0 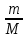 ; ; V = V0 ; ; V = V0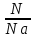 V0 = V 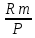 Масъалаи 4 . Њисоб кунед, ки аз 200г кислотаи сулфат бо таъсири оњаксанг чанд грамм гази карбонат њосил кардан мумкин аст. Д.Ш.А 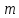 ( Н2SO4) =200гр ( Н2SO4) =200грmCO2 = ? Њал: Н2SO4+ CaCO3 = Н2О + СО2СаSO4 Дар матни масъала аз раванд реаксияи химияви байни кислота ва карбонати калсий сўхта меравад. Яъне ќисми химиявии масъаларо донистани формула номи моддањо , навиштани муодилаи реаксияи химияви ќонуни баќои массави дар реакисия химияви ташкил медињад . Ќисми математикиаш бошад тартиб додани таносуб ва њисобу китобаст. 200гр Х Хгр Н2SO4+ CaCO3 = Н2О + СО2СаSO4 98гр 44г Аз 98гр кислота ____________44гр СО2хориљ мешавад. Аз 200гр кислота ___________ Хгр СО2 Х= 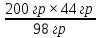 = 98,7гр СО2 = 98,7гр СО2Акнун чи гуна бояд санљид, ки масъала дуруст њал карда шудааст? Инро фаќат бо тартиб додани матни масъалаи баракс санљидан мумкин аст. Масъалаи 5 Њисоб кунед, ки 98,7гр СО2аз таъсири чанд грамм кислотаи сулфат бо оњаксанг њосил мешвад. 89,7 Н2SO4+ CaCO3 = Н2О + СО2СаSO4 98 44 Аз 98гр Н2SO4___________________44гр СO2њосил мешавад. Хгр Н2SO4________________________ 89,7 СO2 Х= 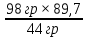 = 200гр Н2SO4 = 200гр Н2SO4Аз њалли масъалаи дар боло овардашуда амиќтар назар андозем ба осони пай мебарем, ки мо матни масъаларо ( бо забони оддиву фањмо оварда шудааст) бо забони математики ифода намоем. Амиќтараш бо тартиб додани муодилаи њисобии мо модели математики маъаларо месозем њамин ки ин кори мушкилтарин ба иљро расид. Мо ба њисобкуни мегузарем модели математики масъалањо метавонад гуногун бошанд. Масъалаи навбатиро дида мебароем. Модели математики он системаи муодилаи дуномаълума ба шумор меравад. Масъалаи 6. Аз таъсири 40гр натрий ва калий бо кислотаи НCL , 92,23гр хлоридхои натрий ва калий њосил шуд. Таркиби массавии омехта муайян карда шавад. Д.ш.а 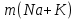 = 40гр = 40гр 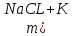 CL) = 92,23гр CL) = 92,23гр 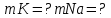 Њал: 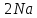 + 2 НCL = 2 + 2 НCL = 2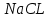 + Н2 + Н22 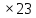 2 2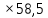 2К + 2 НCL = 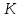 CL + Н2 CL + Н22 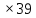 2 2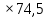 Миќдори моли К-ро бо СL ва миќдори моли 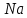 -ро бо у ишора намуда системаи зерини муодиларо њосил мекунем. -ро бо у ишора намуда системаи зерини муодиларо њосил мекунем.39х + 23у= 40 Дар муодилаи дуюм бошад х ва у ифодагари миќдори молњо 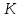 CL ва CL ва 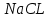 мебошад . мебошад .39К + 23 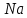 = 40 = 4074,5х + 58,4у = 92,23 Аз муодилаи якум Х-ро меёбем. 39х = 40-23у Х= 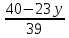 Ќимати Х-ро дар муодилаи (2) гузошта у-ро меёбем 74,5  ( (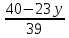 ) + 58,5у = 92,23 у= 1,086 мол ) + 58,5у = 92,23 у= 1,086 мол 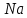 Х= 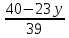 = = 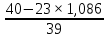 = 0,385 мол К = 0,385 мол КАз рўи молњои ёфташуда массаи К ва 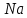 -ро њисоб мекунем -ро њисоб мекунем 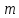 (К) = (К) =  К К  Аr(К) = 0,385 Аr(К) = 0,385  39 = 15 гр 39 = 15 гр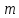 ( (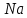 ) = ) = 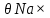 Аr( Аr(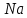 )= 1,086 )= 1,086  23 = 24,987 = 25гр 23 = 24,987 = 25гр Дар њалли масаъалањои химиявї бисёр ваќт дараљаи санљиши љавоби масъалањо ба назар гирифта мешавад. Њисоб ва ченкунињо дар химия одатан тахмини сурат мегиранд. Аз ин рў натиљањои њисобро дуруст яклухт намудан шарт аст. Масалаи њиссаи массаи гидроген дар об ба 2  100/8 баробар аст яъне 11,11%-ро ташкил медињад. Агар масъала њиссаи фоизи Н-ро то дањяк ё садяк талаб кунад пас метавонад вай адади додашударо чунин яклух намуд 11,11% Инљо мебояд ва ададњои ифодакунанда ањамияти махсус дињем фарз кардем миќдори 2-моли 2г сулфати симоб D( HgSO4)=? 100/8 баробар аст яъне 11,11%-ро ташкил медињад. Агар масъала њиссаи фоизи Н-ро то дањяк ё садяк талаб кунад пас метавонад вай адади додашударо чунин яклух намуд 11,11% Инљо мебояд ва ададњои ифодакунанда ањамияти махсус дињем фарз кардем миќдори 2-моли 2г сулфати симоб D( HgSO4)=? D (HgSO4) = 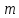 (HgSO4) М (HgSO4 )= 2/297= 0,00673 мешавад, на 0,007 то 0,007 яклухт намудан њангоми њисобкуни метавонад боиси хатоги шавад,зеро мухолифи аст. (HgSO4) М (HgSO4 )= 2/297= 0,00673 мешавад, на 0,007 то 0,007 яклухт намудан њангоми њисобкуни метавонад боиси хатоги шавад,зеро мухолифи аст.Маълумот ва забони химияви ин ахбори химияви ду намуд мешавад. Сифати ва миќдори ваќти мегуем, ки об аз элеметњои гидроген ва оксиген таркиб ёфтааст ё об ба оксиди калсий пайваст шуда оњаки шукуфта хосил мекунад ин ахбори химиявист. Ваќте майян карда мешавад, ки оксиди калсий бо об дар кадом нисбатњои миќдори ба реаксия дохил мешавад ва дар натиља кадом миќдори оњаки шукуфта њосил мешавад ин алоќаи ахбори миќдори ба шумор меравад. СаО + Н2О= Са(ОН)2 СаО: Н2О= 56:18= 3,1 :1 Забони химияви бошад забони формулањо ва реаксияњо ба шумор меравад. Масалан формулаи об Н2О чунин ахбори химиявиро ифода мекунад. Як молекула об Як моли об Молекулаи об аз дуатоми гидроген ва як атоми оксиген таркиб ёфтааст. Молекулаи об аз 2гр атоми гидроен ва 16гр атоми оксиген таркиб ёфтааст. Нисбати моли атомњо ( 2:1) яъне дар формула ба 2моли гидроген як моли оксиген рост меояд. |
