Лекции. Влияние паразитов на организм хозяина
 Скачать 3.28 Mb. Скачать 3.28 Mb.
|
|
Малярийные плазмодии Plasmodium (кл. Споровики) - возбудители малярии. Известны следующие виды малярийных плазмодиев, паразитирующие у человека: P. vivax - возбудитель трехдневной малярии, P. falciparum - возбудитель тропической малярии, P. malariae - возбудитель четырехдневной малярии, P. ovale - возбудитель овале-малярии, близкой к трехдневной. Три первых вида широко распространены в тропических и субтропических климатических поясах, последний - только в тропической Африке. Все виды сходны морфологически и жизненными циклами, отличаясь друг от друга деталями строения и некоторыми особенностями цикла развития, проявляющимися в основном продолжительностью его отдельных периодов. Жизненный цикл малярийных плазмодиев типичен для споровиков, включая стадии бесполого размножения в виде шизогонии, полового процесса и спорогонии. Окончательный хозяин паразитов - комар p. Anopheles В его организме происходит половой процесс и спорогония - многократное клеточное деление с образованием спорозоитов - форм, инвазионных для человека. Промежуточный хозяин - человек. В его организме происходит размножение паразита. Комар - одновременно и переносчик болезни, поэтому малярия - типичное антропонозное трансмиссивное заболевание. Со слюной зараженного комара при укусе плазмодии попадают в кровь человека 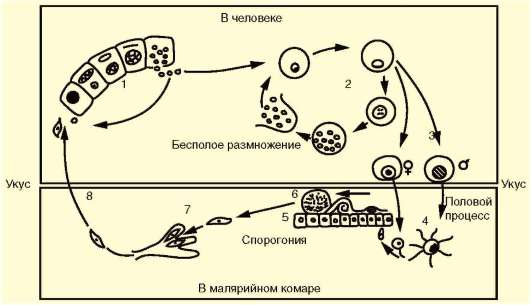 Жизненный цикл малярийного плазмодия: 1 - преэритроцитарная шизогония в клетках печени; 2 - эритроцитарная шизогония; 3 - образование гаметоцитов; 4 - оплодотворение; 5 - спорогония в стенке желудка комара; 6 - ооциста со спорозоитами; 7 - проникновение спорозоита в слюнные железы комара; 8 - заражение человека Развитие паразитов в организме человека происходит синхронно. С током крови они разносятся по организму и поселяются в клетках печени. Здесь они растут и размножаются шизогонией таким образом, что один паразит делится на тысячи дочерних особей. Клетки печени при этом разрушаются, и паразиты, называющиеся на этой стадии мерозоитами, поступают в кровь и внедряются в эритроциты. С этого момента начинается эритроцитарная часть цикла развития плазмодия. Паразит питается гемоглобином, растет и размножается шизогонией. При этом каждый плазмодий делится на 8-24 мерозоита. После разрушения эритроцита мерозоиты попадают в плазму крови и оттуда в новые эритроциты, после чего весь цикл эритроцитарной шизогонии повторяется. Выход большого числа мерозоитов из разрушенных эритроцитов сопровождается выбросом в плазму крови значительного количества токсических продуктов жизнедеятельности Их воздействие на организм приводит к резкому повышению температуры тела, ознобу, слабости и головным болям. Такое состояние возникает внезапно и длится в среднем 1,5-2 ч. Вслед за этим наступают чувство жара, сухость во рту, жажда. Температура тела достигает 40-41 °С. Резко усиливается потоотделение, нарастает слабость, возможна потеря сознания. Перечисленные симптомы облегчают комарам, ориентирующимся с помощью обонятельных и терморецепторов, поиск хозяев-прокормителей и обеспечивает плазмодиям возможность дальнейшего расселения. Через несколько часов все перечисленные симптомы исчезают, и больные обычно засыпают. Весь приступ может продолжаться от 6 до 12 ч. При трехдневной и овале-малярии промежутки между приступами составляют 48 ч, число таких приступов может достигать 10-15, после чего они прекращаются за счет повышения уровня специфического иммунитета, но паразиты в крови еще могут обнаруживаться. В таком случае человек становится паразитоносителем и продолжает представлять опасность для окружающих как возможный источник заражения. Обычно поврежденные эритроциты транспортируются в селезенку и там разрушаются. P. falciparum, находящийся в эритроците, приводит к изменению его метаболизма и свойств оболочки. При этом пораженные эритроциты прикрепляются к внутренней поверхности стенки кровеносных сосудов и перестают циркулировать в крови. Задержка таких эритроцитов надолго в фиксированном состоянии позволяет паразиту проходить эритроцитарную стадию развития без риска быть уничтоженным в селезенке. Плазмодий подавляет иммунную систему хозяина. Из части мерозоитов в эритроцитах образуются незрелые половые клетки - мужские и женские гаметоциты. Они являются инвазионной стадией для комара. Дальнейшее их развитие возможно только в его пищеварительной системе. При укусе больного человека комаром гаметоциты попадают в желудок последнего, где из них образуются зрелые гаметы. В результате оплодотворения в желудке комара образуется подвижная зигота, которая перемещается на наружную поверхность стенки желудка и покрывается оболочкой, формируя ооцисту. С этого момента начинается период спорогонии, когда содержимое ооцисты многократно делится, образуя около 10 тыс. спорозоитов - тонких серповидных клеток, которые после разрыва оболочки поступают в слюнные железы комара. Нахождение огромного числа спорозоитов плазмодия в слюнных железах и передней кишке комара приводит к тому, что комар может одномоментно всосать лишь небольшое количество крови. Это вынуждает его несколько раз менять хозяев-прокормителей, что повышает вероятность заражения малярией большего числа людей. При кровососании спорозоиты поступают в кровяное русло человека. Однако в течение 3-5 лет инвазия может вновь активизироваться за счет находящихся в латентном состоянии в печени экзоэритроцитарных шизонтов, которые могут выходить из печеночных клеток и внедряться в эритроциты. Таким образом, весь процесс болезни может начаться снова. При малярии, вызываемой P. malariae, приступы повторяются через 72 ч. Часто встречается и бессимптомное носительство. Экзоэритроцитарной стадии в цикле развития этого паразита нет, поэтому поздние рецидивы невозможны, хотя инвазия характеризуется упорным течением и длится до 40 лет. При тропической малярии вначале приступы развиваются через разные промежутки времени, а позже - через 24 ч. От осложнений со стороны центральной нервной системы или почек возможна смерть больного. Шизонты в клетках печени не сохраняются, а заболевание может продолжаться до 18 мес. Все виды малярийных плазмодиев могут инвазировать человека и при гемотрансфузии (переливание крови). В этом случае ни у одного из паразитов не формируется экзоэритроцитарной стадии. Поэтому поздних рецидивов в этом случае не бывает. Гемотрансфузионный способ заражения чаще всего встречается при четырехдневной малярии в связи с тем, что при этой форме болезни шизонты в эритроцитах находятся в очень малом количестве и могут не обнаруживаться при исследовании крови доноров. Заражение малярией может происходить и трансплацентарно, когда от больной матери заражается плод. Не исключается и возможность заражения при использовании нестерилизованных хирургических инструментов и шприцов. Иногда человек может быть инвазирован одновременно двумя или тремя видами плазмодиев. В таком случае малярийные приступы не имеют четкой периодичности и клинический диагноз затруднен. Лабораторный диагноз малярии можно поставить только в период, соответствующий стадии эритроцитарной шизогонии, когда в крови удается обнаружить паразитов. Плазмодий, недавно проникший в эритроцит, имеет кольцевидную форму. Его цитоплазма выглядит как ободок, окружающий крупную вакуоль с продуктами диссимиляции. Ядро паразита смещено к краю клетки. Следующая стадия называется амебовидным шизонтом. У паразита появляются ложноножки, а вакуоль увеличивается. Наконец плазмодий занимает почти весь эритроцит. Следующая стадия развития паразита - фрагментация шизонта. На фоне деформированного эритроцита обнаруживаются множественные мерозоиты, в каждом из которых лежит ядро. Кроме бесполых клеток в эритроцитах можно увидеть и гаметоциты. Они отличаются крупными размерами, не имеют псевдоподий и вакуолей 14.02.22 тема. Споровики продолжение Т 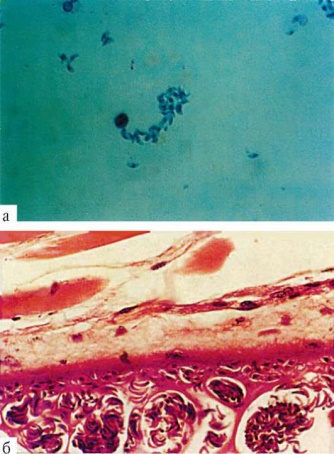 оксоплазма Toxoplasma gondii - возбудитель токсоплазмоза. Имеет форму полумесяца, один конец которого заострен более другого. В центре располагается крупное ядро. Длина паразита 4-7 мкм. оксоплазма Toxoplasma gondii - возбудитель токсоплазмоза. Имеет форму полумесяца, один конец которого заострен более другого. В центре располагается крупное ядро. Длина паразита 4-7 мкм.Споровики, передающиеся нетрансмиссивно: а - токсоплазма; б - саркоцисты в мышечном волокне Токсоплазма поражает огромное количество видов животных и человека. Жизненный цикл токсоплазмы типичен для споровиков: в нем чередуются стадии шизогонии, гаметогонии и спорогонии. Основные хозяева паразита - домашние кошки и дикие виды сем. Кошачьи. Они заражаются, поедая больных грызунов, птиц или инвазированное мясо крупных животных. Паразиты у них сосредоточиваются в клетках кишечника, размножаются шизогонией, а затем образуют гаметы. После копуляции гамет формируются ооцисты, которые выделяются во внешнюю среду. В них происходит спорогония, т.е. деление зиготы под оболочкой. Такие спороцисты со спорозоитами рассеиваются кошками и попадают к промежуточным хозяевам, которыми могут быть человек, почти все млекопитающие, птицы и даже пресмыкающиеся. В клетках большинства их органов происходит бесполое размножение токсоплазм в форме множественного деления. В результате образуются группы, состоящие из многих сотен отдельных паразитов. Эти группы могут распадаться, и тогда отдельные токсоплазмы внедряются с помощью специфической органеллы проникновения - коноида - в непораженные клетки, в которых вновь происходит шизогония. Другие такие группы покрываются плотной оболочкой и формируют цисты. Цисты очень устойчивы и могут длительное время находиться в состоянии покоя в органах хозяев, иногда на протяжении всей их жизни. В окружающую среду они не выделяются. Цикл развития замыкается при поедании кошками органов промежуточных хозяев с цистами. Своеобразной особенностью цикла развития токсоплазм является то, что промежуточные хозяева могут заражаться ими не только от основного хозяина, но и при поедании друг друга. Так, возможно заражение свиней при поедании ими трупов грызунов, погибших от токсоплазмоза, грызуны же заражаются друг от друга при каннибализме. Возможно и внутриутробное заражение плода от больной беременной самки, когда паразиты проникают через плаценту. Этот способ заражения обеспечивает устойчивое существование природных очагов токсоплазмоза и среди мелких грызунов, не склонных к каннибализму. В соответствии с этим и человек как промежуточный хозяин может заразиться токсоплазмозом разными путями: • при поедании мяса инвазированных животных; • с молоком и молочными продуктами; • через кожу и слизистые оболочки при уходе за больными животными, при обработке шкур и разделке животного сырья; • внутриутробно через плаценту; • при медицинских манипуляциях переливания крови и лейкоцитарной массы, при пересадках органов, сопровождающихся приемом иммунодепрессивных препаратов. Последнее свидетельствует о том, что общее снижение иммунитета повышает вероятность заражения токсоплазмозом. Беременность у женщин, больных токсоплазмозом, прерывается существенно чаще, чем у здоровых, причем доля родившихся в таких случаях мальчиков составляет 72%, а девочек - 28%. Это означает разную чувствительность эмбрионов и плодов человека к возбудителю в зависимости от пола. Обычно паразиты обладают весьма низкой патогенностью, но в некоторых условиях они могут вызвать очень тяжелые нарушения, что зависит как от индивидуальной чувствительности хозяев, так и от путей проникновения токсоплазм в организм человека, а главное - от их локализации. Существенное значение имеет также индивидуальная чувствительность хозяина к патогенному действию паразита. В головном мозге токсоплазмы колонизируют средний мозг и гипоталамус, приводит к изменениям эмоционального состояния и поведения зараженного хозяина. Инвазированные токсоплазмой мыши и крысы при этом перестают бояться кошек, активно перемещаются и заселяют новые территории. Повышается вероятность их поедания кошками. У зараженных людей также наблюдаются изменения поведения и психики, причем мужчины и женщины реагируют на паразитов по-разному: женщины становятся более отзывчивыми, радушными, контактными, а мужчины - более грубыми и агрессивными. В остальном у представителей разных полов проявляются и общие симптомы: усиление беспокойства, чувство вины, неуверенность, подозрительность, принятие неадекватных решений, невротизм. Есть данные о том, что шизофрения часто ассоциируется с инвазией токсоплазмой. Поэтому в психиатрической практике пациентов, страдающих шизофренией, необходимо обследовать в отношении возможности инвазии токсоплазмой, и при получении положительных результатов - пролечивать от токсоплазмоза. Больные с синдромом приобретенного иммунодефицита (СПИД) становятся наиболее чувствительными к заражению любыми инфекционными и паразитарными заболеваниями, в частности токсоплазмозом, и если это происходит, то у них также проявляются симптомы нарушения сенсорной, психоэмоциональной и волевой сфер, характерные для шизофрении. Наиболее опасно трансплацентарное заражение токсоплазмозом. При этом возможно рождение детей с множественными врожденными пороками развития, в первую очередь головного мозга. При постановке диагноза используют методы иммунологических реакций, обнаружение токсоплазм при прямом микроскопировании материала, взятого от больного человека или трупа. Для исследования используют плаценту, печень, кровь, лимфатические узлы, головной мозг. Применяют также метод биологических проб. В этом случае лабораторным животным вводят кровь или спинномозговую жидкость больного. Мыши заболевают токсоплазмозом при таком способе заражения в острой форме, и обнаружение возбудителя у них не представляет сложности. Профилактика - термическая обработка животных продуктов питания, санитарный контроль на бойнях и мясокомбинатах, предотвращение тесных контактов детей и беременных женщин с домашними животными. Считается, что в настоящее время токсоплазмами инвазированы не менее 2 млрд человек, но у большинства из них инвазия протекает бессимптомно. Несколько близких к токсоплазме паразитов - саркоцисты (Sarco-cystis hominis, S. suihominis, S. lindemanni) - являются возбудителями саркоцистозов и имеют сходный с ней цикл развития . Человек для этих паразитов - основной хозяин, а животные - промежуточные. Поэтому у человека, как и у кошки при токсоплазмозе, поражается кишечник. Но степень поражения его очень незначительна. По некоторым данным, частота инвазии людей саркоцистами достигает 7-60%, особенно там, где в соответствии с традициями население употребляет в пищу сырое или полусырое мясо. Врачи обычно не ставят правильного диагноза, а заболевание заканчивается быстрым самоизлечением. Pneumocystis carinii (син. Pneumocystis jiroveci) относится к своеобразной группе паразитов, не имеющих полового процесса. Является возбудителем пневмоцистоза. Современные исследования особенностей биохимической и генетической организации позволили отнести этого паразита не к типу простейших, а к особой группе царства Грибов (Furgi). Однако в связи со сходством жизненного цикла пневмоцистиса со многими паразитическими простейшими и с его серьезным медицинским значением авторы сочли уместным поместить его описание в данном разделе . Паразиты имеют неправильную форму, размеры их от 1 до 5 мкм. В цитоплазме содержатся митохондрии, а диссимиляция происходит аэробно. Обитает в альвеолах легких человека и многих млекопитающих. Человек заражается воздушно-капельным путем, вдыхая клетки пневмоцистиса. В легких паразиты располагаются на альвеолярном эпителии, прикрепляясь к нему псевдоподиями. Здесь они размножаются простым делением, увеличиваются в размерах, образуют толстую оболочку и делятся обычно несколько раз, образуя споры. При разрыве оболочки споры паразитов выходят из нее, и начинается следующий цикл размножения в данном организме или в другом хозяине, в случае попадания к нему при вдыхании . У 1-10% здоровых людей отмечены P. carinii. Инвазия протекает обычно бессимптомно, однако в случае ослабления иммунитета хозяина размножение паразитов усиливается, они закупоривают бронхиолы, что приводит в тяжелых случаях к смерти от асфиксии. Имеются сведения о том, что если больных СПИДом удается спасти от пневмоцистоза, то жизнь их значительно продлевается. Обнаружить P. carinii в мокроте больных крайне сложно. Поэтому для диагностики используют иммунологические методы, которые не обладают высокой специфичностью. В настоящее время разработан метод диагностики пневмоцистоза с использованием генетических зондов. У погибших больных диагноз ставят на основании обнаружения паразитов на разных стадиях их жизненного цикла в гистологических срезах легких. Профилактика пневмоцистоза сложна в связи с широкой распространенностью паразита у здоровых людей и домашних животных. Поэтому из мер профилактики эффективна только вакцинация людей с иммунодефицитом специальными вакцинами, получаемыми методами генетической инженерии. Криптоспоридиоз - протозойная инфекция, вызываемая криптоспоридиями и протекающая с преимущественным поражением пищеварительного тракта. Типичные клинические проявления криптоспоридиоза включают профузную водянистую диарею, тошноту, рвоту, спастические боли в животе. У лиц с иммунодефицитом, наряду с тяжелой гастроинтестинальной формой, может развиваться криптоспоридиоз желчевыводящих путей и респираторного тракта. Криптоспоридиоз диагностируется путем выявления ооцист криптоспоридий в пробах испражнений; реже с помощью ИФА, РИФ, ПЦР. Лечение криптоспоридиоза включает диету, регидратацию, ферменты; по показаниям – антибиотики. Риск заболеваемости криптоспоридиозом выше среди детей и иммунокомпрометированных пациентов (т. ч. ВИЧ-инфицированных), у которых инфекция может приобретать тяжелое течение. Возможны внутрибольничные вспышки криптоспоридиоза, случаи группового заражения в детских садах, школах, семьях. Возбудители протозойной инфекции - внутриклеточные паразиты криптоспоридии (Cryptosporidium), принадлежат к классу споровиков (Sporozoasida), подклассу кокцидий (Coccidiasina). Весь жизненный цикл паразита протекает в организме единственного хозяина (животного или человека), который выделяет инвазионные ооцисты с испражнениями. Ооцисты криптоспоридий могут долго сохранять свои патогенные свойства во внешней среде. Заражение криптоспоридиозом происходит по фекально-оральному механизму , реже – при контакте с инфицированными животными или человеком, гомосексуальном половом контакте. Кроме этого, спорозоиты из ооцист могут высвобождаться непосредственно в кишечнике, не покидая организма хозяина, что обусловливает механизм аутоинфекции при криптоспоридиозе. Широкое распространение криптоспоридиоза в популяции отчасти объясняется малой инфицирующей дозой криптоспоридий: заболевание может вызвать даже попадание в ЖКТ 1-10 ооцист; средняя инфицирующая доза составляет около 132 ооцист. Уникальной особенностью ооцист криптоспоридий является их резистентность к дезинфицирующим средствам (в частности, к хлору), а также малый размер (4-7 мкм), что позволяет им свободно проникать через многие фильтры. Большая часть современных технологий очистки воды не позволяет добиться 100%-ной задержки ооцист криптоспоридий, поэтому водный путь заражения криптоспоридиозом рассматривается на сегодняшний день как ведущий. Повышенный риск заражения криптоспоридиозом имеют дети до 10 лет, животноводы, ветеринары, лаборанты, медицинский персонал инфекционных отделений. В пищеварительном тракте человека оболочки ооцисты разрушаются, и из нее высвобождаются спорозоиты, которые проникают в энтероциты, отграничиваясь от цитоплазмы клетки двойной оболочкой. В эпителиальных клетках кишечника спорозоиты превращаются в трофозоиты, а затем, в результате множественного деления – в шизонты и мерозоиты I типа. Последние способны прикрепляться к другим эпителиальным клеткам, увеличивая численность паразитов. Кроме этого, после нескольких циклов бесполого размножения мерозоиты I типа трансформируются в мерозоиты II типа, образующие мужские и женские гаметы. После слияния половых клеток образуется зигота, которая затем развивается в ооцисту. Примерно 80% ооцист криптоспоридий имеют толстую клеточную стенку и выделяются во внешнюю среду с фекалиями или глоточной слизью. Остальные ооцисты являются тонкостенными; их них в просвет кишечника высвобождаются спорозоиты, запускающие новый цикл развития паразита в результате эндогенной инвазии. Весь цикл развития паразитов в организме одного хозяина (от проникновения до выделения во внешнюю среду) занимает 4-7 дней. Паразитируя в эпителии кишечника, возбудители криптоспоридиоза вызывают замедление всасывания воды и электролитов, угнетением ферментативной деятельности кишечника, что находит клиническое выражение в возникновении профузного водянистого поноса. При криптоспоридиозе также возможно поражение эпителия глотки, гортани, пищевода, желудка, толстой кишки, а при аспирации рвотных масс – трахеи и бронхов. При тяжелом течении криптоспоридиоза отмечается гематогенное распространение криптоспоридий в различные внутренние органы. Длительность инкубационного периода при криптоспоридиозе в среднем составляет 4-14 дней. Диарея, схваткообразные боли в мезогастрии, тошнота, повторная рвота. Стул водянистый, обильный, частый (от 5-10 до 20 и более раз в сутки), со зловонным запахом. Признаки дегидратации могут быть выражены в различной степени: от чувства жажды и сухости кожи до снижения тургора тканей и тонических судорог. Возможно повышение температуры до субфебрильных или фебрильных показателей. У пациентов с нормальной иммунной системой диарейный синдром продолжается 5-12 дней, после чего проявления криптоспоридиоза купируются, и наступает выздоровление. Из внекишечных форм криптоспоридиоза обычно встречается поражение респираторного тракта, желчевыводящих путей, редко - поджелудочной железы. Респираторный (бронхолегочный) криптоспоридиоз сопровождается одышкой, кашлем со скудной мокротой слизистого характера, дыхательной недостаточностью, лихорадкой, лимфаденитом. У больных СПИДом часто возникает криптоспоридиозная пневмония, приводящая к летальному исходу. При поражении желчных путей развивается холецистит, склерозирующий холангит или гепатит. Больных беспокоит лихорадка, тошнота, боль в правом подреберье, желтуха, диарея. Дифференциальная диагностика острых кишечных инфекций и подтверждение криптоспоридиоза основано на обнаружении ооцист возбудителя в испражнениях. Возможно обнаружение антигена криптоспоридий в кале методами ИФА, РЛА, ПЦР, а также в крови с помощью иммунофлюоресцентного или иммуноферментного анализа. При бронхолегочной форме криптоспоридиоза проводится бронхоскопия. Рентгенологическое исследование легких позволяет увидеть картину двухсторонней интерстициальной пневмонии. Для подтверждения криптоспоридиоза желчных путей прибегают к чрескожной пункции желчного пузыря и внутрипеченочных желчных протоков У иммунокомпетентных лиц криптоспоридиоз протекает в легкой или среднетяжелой форме и обычно заканчивается самопроизвольным выздоровлением. Наибольшую опасность криптоспоридиоз представляет для детей до 2-х лет, пациентов с иммунодефицитными состояниями и получающих длительную иммуносупрессивную терапию. Предотвратить или минимизировать риск заражения криптоспоридиозом позволит обеззараживание сточных вод, кипячение водопроводной воды, установка дополнительных фильтров для очистки воды, санитарное просвещение, соблюдение противоэпидемического режима в детских и лечебных учреждениях, а также мер личной гигиены. 15.02. Тема.Гельминты |
