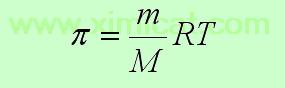|
|
Вопрос Белки. Разнообразие. Функции
ВОПРОС № 5. Форма белков. Молекулярная масса.
По форме молекул все белки делятся на глобулярные и фибриллярные.
Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру, в которой отношение поперечной оси к продольной больше 1:10. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу и высоко регулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Это коллаген, эластин, кератин, миозин, фибрин.
Глобулярные белки — белки, имеющие вытянутую нитевидную структуру, в которой отношение поперечной оси к продольной менее 1:10.белки. Часто, в их молекулах полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы (третичные структуры белка). Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями. К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции. Большинство белков организма. Миоглобин и гемоглобин.
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 Да и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка.
Поскольку аминокислотный состав и последовательность аминокислот выяснены для многих белков (более 2500), стало возможным вычисление химическим путем их молекулярной массы с высокой точностью. Однако для огромного количества разнообразных белков, встречающихся в природе, химическое строение не выяснено, поэтому основными методами определения молекулярной массы все еще остаются физико-химические методы (гравиметрические, осмометрические, вискозиметрические, электрофоретические, оптические и др.). Из них практически наиболее часто используются методы седиментационного анализа, гель-хроматографии и электрофореза
Наиболее проверенным и теоретически обоснованным методом определения молекулярной массы ВМС, а также размеров частиц суспензий и золей является метод ультрацентрифугирования. Современная ультрацентрифуга - сложное устройство, приводящееся во вращение с помощью электрического привода. Для ускорения оседания необходимо создать силовое поле в сотни тысяч раз больше, чем поле земного притяжения. Такое поле создается при быстром вращении ротора центрифуги. При сравнительно небольших скоростях (
20 000 об/мин) в растворе, помещенном в кювету, происходит распределение частиц по высоте, т.е. устанавливается седиментационное равновесие. При этом концентрация вещества от дна сосуда к верхним слоям системы постепенно уменьшается. В полидисперсных системах при седиментационном равновесии у крупных частиц наблюдается более сильное изменение концентрации по высоте, чем у мелких.
Изучая седиментационное равновесие (определяя по высоте раствора плотность, коэффициент преломления или какие-либо другие физические величины), можно сделать заключение о фракционном составе суспензии или ВМС, определить среднюю молекулярную массу растворенного вещества. При большем числе оборотов происходит оседание (седиментация) частиц. Так осуществляют разделение высокомолекулярных соединений, содержащих макромолекулы данного вещества разной длины, на отдельные фракции. С помощью ультрацентрифуги удалось доказать однородность молекул большинства природных белков, исследовать свойства ферментов, гормонов, вирусов, установить молекулярную степень дисперсности частиц в растворах ВМС и решить ряд других важных для развития науки вопросов. Методом ультрацентрифугирования можно исследовать также растворы низкомолекулярных веществ.
Осмотический метод заключается в следующем: по величине гидростатического давления, при котором прекращается переход растворителя в раствор, измеряют осмотическое давление раствора ВМС, а затем используют уравнение Вант-Гоффа:
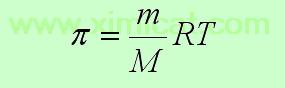
ВОПРОС № 6. Аминокислоты. Пептиды.
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатсякарбоксильные и аминные группы.
В составе белков – только альфа-аминокислоты виде L-изомеров. В составе белков в организме человека встречают только 20 альфа-аминокислот. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
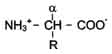
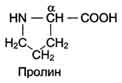
Пролин – иминоксилота, молекула имеет циклическую форму
. 
19 из 20 аминокислот содержат в альфа-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного альфа-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к альфа-углеродному атому.
По химическому строению аминокислоты можно разделить на алифатические (Гли, Ала, Вал), ароматические (Фен, Тир) и гетероциклические (Три, Гис), иминокислоты (Про). В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (Асп, Глу), амино (Лиз), серу (Цис, Мет), амидная (Асн, Глн), гидроксильная (Сер, Тре) , гуанидиновую (Арг).
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными. Неполярные радикалы - гидрофобные (Фен, Три, Ала, Вал, Про, Мет), полярные незаряженные (Сер, Тре, Тир, Асн, Глн, Цис), полярные положительные (Лиз, Арг, Гис) и отрицательные (Асп, Глу).
В зависимости от того, могут ли аминокислоты синтезироваться в организме или должны поступать в составе пищи, различают:
заменимые;
незаменимые – только с пищей (лейцин, изолейцин, валин, лизин, гистидин, метионин, фенилаланин, треонин, триптофан). В детском возрасте также незаменимой является аминокислота аргинин.
Для человека Арг, Тир − полузаменимые, а для курицы − незаменимые.
Альфа-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между альфа-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды.
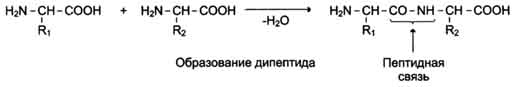
Пептиды — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Пептиды, содержащие более 10 аминокислот, называют "полипептиды", а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин "белок" часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Мономеры аминокислот, входящих в состав белков, называют "аминокислотные остатки". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную ?-карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название "пептидный остов". Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Эта связь образуется в результате выделения молекул воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь — пептидной связью. Она образуется только между альфа-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой. Это прочная ковалентная связь. Все атомы пептидной группировки лежат в одной плоскости. Связь C-N частично одинарная, частично двойная. Способность к образованию водородных связей.
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы.
Связь между альфа-углеродным атомом и альфа-аминогруппой или альфа-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. альфа-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве
ВОПРОС № 7. Первичная структура.
Первичная структура белка – генетически запрограммированная линейная последовательность аминокислотных остатков (альфа-аминокислот в виде L-стереоизомеров), связанных пептидными связями. Не является случайной. Изменение первичной структуры ведет к изменению и других структур и изменению свойств белка.
Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
Серповидноклеточная анемия — это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение — так называемыйгемоглобин S. Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, поэтому у больных с серповидноклеточной анемией повышено разрушение эритроцитов в селезенке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Изучение первичной структуры белков имеет важное общебиологическое и медицинское значение. Кроме того, многие генетические болезни - результат нарушения в аминокислотной последовательности белков. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания.
Установление первичной структуры белков включает 2 основных этапа:
определение аминокислотного состава изучаемого белка;
определение аминокислотной последовательности в белке.
Определение аминокислотного состава белка
Кислотный гидролиз белка
Для определения аминокислотного состава необходимо провести разрушение всех пептидных связей в белке. Анализируемый белок гидролизуют в 6 мол/л НС1 при температуре около 110 °С в течение 24 ч. В результате такой обработки разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты.
Разделение аминокислот с помощью ионообменной хроматографии
Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой. Такая синтетическая смола содержит прочно связанные с ней отрицательно заряженные группы (например, остатки сульфоновой кислоты -SO3-), к которым присоединены ионы Na+ . В катионообменник вносят смесь аминокислот в кислой среде (рН 3,0), где аминокислоты в основном представляют катионы, т.е. несут положительный заряд. Положительно заряженные аминокислоты присоединяются к отрицательно заряженным частицам смолы.
Количественный анализ полученных фракций
Количество каждой из аминокислот в данном белке определяют, нагревая отдельные фракции аминокислот с нингидрином, образующим соединение красно-фиолетового цвета. Интенсивность окраски в пробе пропорциональна количеству находящейся в ней аминокислоты, поэтому по спектрофотометрическому измерению света, поглощённого нингидриновыми производными, можно определить содержание каждой аминокислоты в гидролизате данного белка.
В настоящее время процесс разделения и количественного определения аминокислот в гидролизате белка полностью автоматизирован и осуществляется в специальном приборе - аминокислотном анализаторе.
Определение аминокислотной последовательности в белке
Определение N-концевой аминокислоты в белке и последовательности аминокислот в олигопептидах
Фенилизотиоционат (ФИТЦ) - реагент, используемый для определения N-концевой аминокислоты в пептиде. Он способен реагировать с ?-аминогруппой и ?-карбоксильной группой свободных аминокислот, а также с N-концевой аминокислотой в пептидах.
В результате взаимодействия с N-концевой аминокислотой полипептида образуется фенил-тиогидантионовое производное, в котором дестабилизирована пептидная связь между ?-карбоксильной группой N-концевой аминокислоты и а-аминогруппой второй аминокислоты в пептиде. Эта связь избирательно гидролизуется без повреждения других пептидных связей.
После реакции выделяют комплекс ФИТЦ-АК1 идентифицируют его хроматографическими методами. ФИТЦ можно использовать вновь с укороченным пептидом, полученным в предыдущем цикле, для определения следующей аминокислоты. Этот процесс ступенчатого расщепления пептида с N-конца был автоматизирован и реализован в приборе - секвенаторе, с помощью которого можно определять последовательность аминокислотных остатков в олигопептидах, состоящих из 10-20 аминокислот.
Многие полипептиды имеют первичную структуру, состоящую более чем из 100 аминокислот. Так как с помощью секвенаторов наиболее продуктивно определяют аминокислотную последовательность лишь небольших пептидов, молекулы полипептида расщепляют по специфическим местам на фрагменты.
Используя несколько разных расщепляющих агентов (ими могут быть ферменты или химические вещества) в разных пробах очищенного полипептида, можно получить частично перекрывающие друг друга фрагменты с установленной аминокислотной последовательностью. С их помощью можно воссоздать правильный порядок фрагментов и получить полную последовательность аминокислот в полипептидной цепи.
Ферментативное расщепление полипептида по специфическим участкам
Для специфического расщепления пептидных связей в белке можно использовать несколько разных ферментов. Наиболее широко используют ферментативный гидролиз полипептида протеолитическим ферментом - трипсином Он расщепляет пептидные связи, в образовании которых участвует карбоксильная группа остатков лизин.
Химическое расщепление полипептида по специфическим участкам
В некоторых случаях предпочтителен не ферментативный, а химический гидролиз. Так, реагент бромциан расщепляет только пептидные связи, в которых карбоксильная группа принадлежит остатку метионина. Зная количество остатков метионина в полипептидной цепи, легко установить количество получаемых фрагментов. Далее для каждого фрагмента в секвенаторе также устанавливают аминокислотную последовательность.
Получение аминокислотной последовательности полипептида с помощью перекрывающихся фрагментов
Для успешного установления последовательности полученных фрагментов полипептида необходимо получить пептиды с перекрывающимися аминокислотными последовательностями. Это достигают обработкой отдельных проб данного полипептида разными реагентами, расщепляющими белок в разных местах. Необходимо провести столько расщеплений, чтобы получить набор пептидов, обеспечивающих перекрывание всех участков, необходимых для определения последовательности исходного полипептида.
|
|
|
 Скачать 362.81 Kb.
Скачать 362.81 Kb.