Вопрос Белки. Разнообразие. Функции
 Скачать 362.81 Kb. Скачать 362.81 Kb.
|
|
ВОПРОС № 32 Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров. Протеинкиназы - группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А.
Гликогенфосфорилаза катализирует лимитирующую скорость гликогенолиза реакцию: фосфоролитическое расщепление (фосфоролиз) (1->4)-связей гликогена, продуктом является глюкозо-1-фосфат .Активная форма фосфолирирована благодаря кальмодулин-зависимой киназе. Комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы, связываясь с ней и таким образом выступая в качестве ее интегральной единицы. ВОПРОС № 33 Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента. Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина (рис. 2-34). Трипсиноген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы. Следует напомнить, что трипсин относят к семейству "сериновых" протеаз - активный центр фермента содержит функционально важный остаток Сер. Пепсин в желудке под действием соляной кислоты в небольшом количестве образуется из пепсиногена. Далее образовавшийся пепсин сам осуществляет частичный протеолиз, то есть активирует пепсин из пепсиногена. Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов. Профермент → Активная форма Е + пептид (АкЦ не сформирован) энтеропептидаза Трипсиноген трипсин + гексапептид (зимоген, профермент) (активный фермент) Примеры:
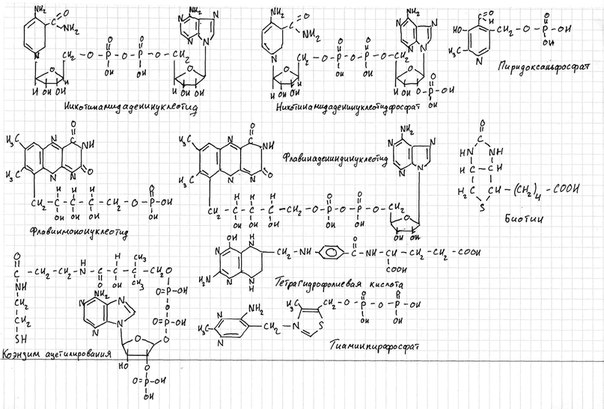
ВОПРОС № 34 Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в неорганических частицах – обычно ионах металлов (кофакторах). Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе. Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. Ионы металлов - стабилизаторы молекулы субстрата Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-ATФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента. Ионы металла - стабилизаторы активного центра фермента В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы К металлоэнзимам относят, например, фермент пируваткиназу (нужен магний). Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы. Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа. Участие в электрофильном катализе Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fe2+, Mn2+, Cu2+ Карбоангидраза - цинксодержащий фермент, катализирующий реакцию образования угольной кислоты. Ион Zn2+ в результате электрофильной атаки участвует в образовании Н+ и ОН- ионов из молекулы воды. Участие в окислительно-восстановительных реакциях Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков. Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. К коферментам относят:
ВОПРОС № 35 Нередко в качестве коферментов выступают производные витаминов. Например, витамин B6 – во всех своих формах используется для синтеза коферментов – пиридоксальфосфата и пиридоксаминофосфата. Ферменты, имеющие в своем составе эти коферменты, играют ключевую роль в обмене аминоксилот: катализируют реакции трансаминирования и декарбоксилирования аминокислот, участвуют в специфических реакциях метаболизма отдельных аминокислот: серина, треонина, триптофана, серосодержащих аминокислот, а также в синтезе гемма. Среди этих ферментов – трансаминазы. Витамин РР – никотиновая кислота, никотинамид. Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ (группа ферментов из класса оксидоредуктаз, катализирующих перенос протонов от субстрата (органических веществ) и пары электронов — к акцептору). Витамин В2 (рибофлавин). В слизистой оболочке кишечника после всасывания витамина происходит образование коферментов FMN и FAD. Коферменты FAD и FMN входят в состав флавиновых ферментов, принимающих участие в окислительно-восстановительных реакциях. ВОПРОС № 36
 ВОПРОС № 37 Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента. В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, липаза, или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза. Есть и тривиальные названия – песин, трипсин. Систематическая (рациональная) номенклатура – название S или субстратов, тип катализируемой реакции и окончание «аза». Например, D-глицеральдегид-3-фосфат: NAD-оксидоредуктаза (рабочее название - глицеральдегидфосфат дегидрогеназа). Из названия фермента следует, что субстратом этого фермента служит D-глицеральдегид-3-фосфат, тип катализируемой реакции - окислительно-восстановительная в присутствии кофермента NAD+. Каждый фермент имеет кодовый номер (шифр) по классификации ферментов (КФ). Код каждого Е имеет 4 цифры, разделенные точками.
Классы ферментов
ВОПРОС № 38 Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра. Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало. Другой пример фермента с абсолютной субстратной специфичностью - уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака. Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам. Стереоспецифичность к D-сахарам. Стереоспецифичность к L-аминокислотам. Стереоспецифичносгь к α- и β-гликозидным связям. Фермент амилаза действует только на а-гликозидные связи, что позволяет гидролизотать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями. Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов; фос-фоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов. Если стерерокаталитическая специфичность – субстрат просто не должен иметь стереоизомеры. ВОПРОС № 39 Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения изменения энергетики химических реакций и с точки зрения событий в активном центре.
Чем больше молекул обладает энергией, превышающей уровень Еа, тем выше скорость химической реакции. Ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путём понижения уровня Еа. Точнее, она разбивается на несколько низких значений, которые легче преодолеть Таким образом, ферменты снижают высоту энергетического барьера, в результате возрастает количество реакционно-способных молекул, следовательно, увеличивается скорость реакции. В механизме ферментативного катализа решающее значение имеет образование нестойких промежуточных соединений - фермент-субстратный комплекс ES, подвергающийся превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции. Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов. Сходство ферментов с небиологическими катализаторами заключается в том, что:
Отличия ферментов от небиологических катализаторов заключаются в том, что:
Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента в химической реакции превращения субстрата в продукт.
Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра фермента; II - образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия; III - деформация субстрата и образование нестабильного комплекса фермент-продукт (ЕР); IV- распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента 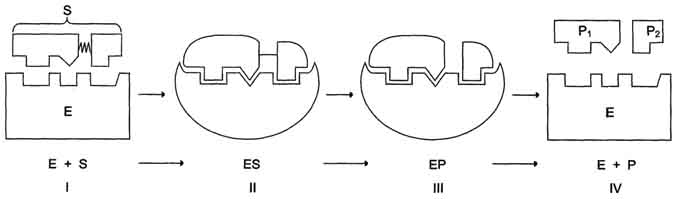 |
