|
|
Вопрос Белки. Разнообразие. Функции
ВОПРОС № 28
Под термином "ингибирование ферментативной активности" понимают снижение каталитической активности в присутствии определённых веществ - ингибиторов.
Реакция в общем виде: Е + I ↔ ЕI
Константа ингибирования: [E] [I]
Кi = ————
[EI]
Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные.
А. Обратимое ингибирование
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
Неконкурентное ингибирование
К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется.
Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования.
Классический пример конкурентного ингибирования - ингибирование сукцинатдегидрогеназной реакции малоновой кислотой .
При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Эффективные антихолинэстеразные препараты - прозерин, эндрофоний и др.
В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой - могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний, аналоги нуклеотидов для лечения онкологических заболеваний.
Неконкурентное ингибирование
Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата.
Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и неизменением сродства субстрата к ферменту, т.е. Кm.
Бесконкурентное ингибирование
— по схеме:
Е + S ↔ ЕS + I ↔ ЕSI
↓
Е + Р
I связывается с Е также не в каталитическом центре, однако не со свободным Е, а с комплексом ЕS, т.е. центр, связывающий I, становится доступным для I только после того, как свяжется S.
Б. Необратимое ингибирование
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению
Использование необратимых ингибиторов представляет большой интерес для выяснения механизма действия ферментов. С этой целью применяют вещества, блокирующие определённые группы активного центра ферментов. Такие ингибиторы называют специфическими. Ряд соединений легко вступает в реакции с определенными химическими группами. Если эти группы участвуют в катализе, то происходит полная инактивация фермента.
Роль гидроксильных групп серина в механизме катализа исследуют с помощью фторфосфатов, например диизопропилфторфосфата.
Ацетат йода, п-хлормеркурибензоат легко вступают в реакции с SH-группами остатков цистеина белков. Эти ингибиторы не относят к специфичным, так как они реагируют с любыми свободными SH-группами белков и называются неспецифическими ингибиторами.
Денатурирующие агенты – неспецифическое ингибирование.
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы .
Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
Активность трипсина угнетается большим числом природных белковых ингибиторов, называемых иногда антитрипсинами, к-рые предохраняют ткани от разрушения трипсина. Препараты ингибиторов трипсина, выделенные из поджелудочной железы или легких, - контрикал, трасилол - используют в мед. практике в качестве лекарственных средств. При панкреатитах.
ВОПРОС № 29
Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы. Наличие E-S-комплекса повышает для некоторых молекул фермента температуру денатурации
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Важный параметр, контролирующий протекание метаболического пути, - наличие субстратов, и главным образом - наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. Но здесь нудно помнить о насыщении фермента.
Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму. Есть прочно связанные коферменты (ФАД) и относительно свободные – как второй субстрат (НАД).
При катализе необратимых реакций концентрация продукта не влияет на активность ферментов. У обратимых – активность фермента зависит от концентрации продукта. Это связано со смещением химического равновесия
ВОПРОС № 30
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют.
Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызьгоаюший повышение (активацию) активности ферментов, называют положительным эффектором, или активатором.
Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты метаболического пути - часто ингибиторы аллостерических ферментов, а исходные вещества - активаторы. Это так называемая гетеротропная регуляция. Такой вид аллостерической регуляции очень распространён в биологических системах.
Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат - одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата.
Особенности строения и функционирования аллостерических ферментов:
обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента;
регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Локализация аллостерических ферментов в метаболическом пути. Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:
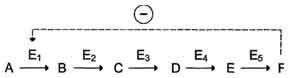
Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибированием. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке.
В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:
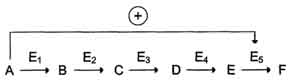
В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы . Один из конечных продуктов распада глюкозы - молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.
ВОПРОС № 31
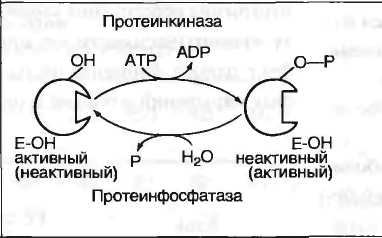
В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фос-форилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки.
Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов.
В зависимости от источника энергии различают два вида фосфорилирования: субстратное и окислительное.
При субстратном фосфорилировании АТФ образуется при переносе богатого энергией фосфата с макроэргического субстрата (например, с креатинфосфата или с фосфоенолпирувата) на АДФ. Для такого фосфорилирования не требуется участия мембранных структур.
S
P + АДФ = S + АТФ
Окислительное (или мембранное) фосфорилирование происходит при участии мембран митохондрий, в которых происходит преобразование химической энергии в энергию электрохимического потенциала ионов водорода на мембране. Затем эта энергия вновь преобразуется в химическую энергию связей АТФ.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путем фосфорилирования остатков аминокислот, имеющих гидроксильные группы (серин, треонин и ьтирозин) или гетероциклической аминогруппы гистидина. Протеинкиназы регулируют клеточный цикл, рост и дифференцировку клеток, апоптоз. Нарушения работы протеинкиназ приводят к различным патологиям, в том числе, к возникновению некоторых видов рака
Циклический гуанозинмонофосфат и Циклический аденозинмонофосфат – циклические формы нуклеотидов (производные ГТФ и АТФ.
цАМФ - производное АТФ, выполняющее в организме роль вторичного посредника, использующегося для внутриклеточного распространения сигналов некоторых гормонов (например, глюкагона или адреналина), которые не могут проходить через клеточную мембрану. Гормон с рецептором, изменение G-белка, его альфа-субъединица теряет ГДФ и увеличивает сродство к ГТФ, полученное активирует аденилатциклазу и синтез цАМФ, которая действует на протеинкиназу А и активирует ее.
цГМФ действует как вторичный посредник и его действие подобно цАМФ, в основном активируя внутриклеточные протеинкиназы G в ответ на связывание с клеточной мембраной пептидных гормонов (для которых мембрана непроницаема) с внешней стороны клетки. Гуанилатциклаза сама как рецептор. Ее внутриклеточный домен изменяется по конформации и этот фермент активируется. Цитозольная форма этого фермента активируется оксидом азота. |
|
|
 Скачать 362.81 Kb.
Скачать 362.81 Kb.