Вирусология. Вирусология ответы. Вопросы к экзамену по дисциплине Вирусология
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
История открытия и классификация бактериофагов. 1. Краткая история изучения бактериофагов. Ф.Туорт описал в 1915 г. «остекленение» (лизис) колоний белого стафилококка, фильтрат биомассы которых, полученный после прохождения через фарфоровые фильтры, вызывал аналогичный эффект у свежевыросших нормальных колоний, а на газоне агаровых культур стафилококка точечные прозрачные (стерильные) участки. Целостное учение о бактериофагах как о вирусах связано с именем канадского ученого Феликса д'Эрелля, работавшим в Париже в Институте Пастера. Феликс Д'Эрелль задумался над вопросом: почему возбудитель дизентерии, высевающийся в ее начале в большом количестве, в конце заболевания очень часто перестает выделяться? Ученый к свежей бульонной культуре дизентерийной палочки стал добавлять по нескольку капель фильтрата испражнений больного. После одного из таких посевов Д'Эрелль обнаружил агент, способный разрушать дизентерийные бактерии. При добавлении к мутной бульонной культуре он вызвал ее просветление, а при добавлении к культуре, засеянной на плотную среду, появлялись прозрачные (стерильные) пятна колонии. Способность вызывать такие пятна и размножаться при повторных посевах дали основание считать его живым корпускулярным агентом. Д'Эрелль назвал его Bacteriophagumintestinale, т.е. выделенный из кишечника пожиратель бактерий. Бактериофаги поначалу вызвали интерес как потенциальное средство борьбы с патогенными бактериями, однако вскоре отошли на задний план, поскольку магистральным направлением вирусологии было изучение вирусов животных. И только с расцветом генетики в 1940-1960-х годах они, в первую очередь фаги Е. coli («колифаги»), заняли достойное место в ряду ключевых объектов, на которых проводились исследования основ строения, воспроизведения, передачи и функционирования генов. Позднее, в 1970-1980-х годах, с зарождением, а затем быстрым прогрессом молекулярной биологии бактериофагов стали широко использовать при клонировании генов и анализе их инфраструктуры. Сперва интерес исследователей привлекли бактериофаги Т1-Т7, размножающиеся в клетках E.coli штамм В и обозначенные как «четные» (Т2, Т4 и Т6) и «нечетные» (Т1, ТЗ, Т5 и Т7). Они различаются по свойствам и объединены в Т-серию (сокр. от англ. type) только согласно хронологической последовательности их выделения. Выбор в качестве модельных объектов именно Т-фагов, которые осуществляют литическую инфекцию, на время отвлек внимание исследователей от такого исключительно важного феномена, как вирусная лизогения. Он был открыт в 1921 г. Жюлем Борде (J.Bordet) у Salmonella typhi и подробно изучен на примере фага лямбда в 19301950-х годах. Тем не менее, при изучении инфекционного цикла Т-фагов были совершены крупнейшие открытия в области молекулярной генетики. Помимо представителей Т-серии, молекулярно-генетические исследования проводят еще с тремя типами бактериофагов. Во-первых, это умеренные бактериофаги, которые способны развиваться по двум сценариям литическому и лизогенному. В первом случае при заражении бактерии они осуществляют продуктивный цикл, во втором интегрируются в хозяйскую хромосому и переходят к скрытому существованию в качестве профага. При определенных условиях, в частности при УФ-облучении, происходит индукция профага с переходом к литическому сценарию. Наиболее известным умеренным бактериофагом является фаг лямбда, инфицирующий Е. coli. Он широко используется при изучении механизмов регуляции генной активности, а также в качестве вектора для клонирования генов. Наряду с ним к числу умеренных относятся фаги P1, Р4, Р22 и мю. Во-вторых, это бактериофаги, которые содержат ssДHK, однако размножаются с использованием dsДНК-репликативных интермедиатов. К ним относятся сферические фаги G4, S13 и Х174(PhiХ), а также нитчатые фаги fd, flи М13. Геном сферического фага Х174 был первым секвенированным геномом. На примере данного бактериофага было также впервые обнаружено явление взаимного перекрывания генов. Особенностью нитчатых бактериофагов является то, что они избирательно инфицируют «мужские» клеткиЕ. coli,поскольку вирионы адсорбируются на половых F-фимбриях. В-третьих, это бактериофаги, содержащие РНК. К ним относятся фаги f2, MS2, R17 и Qb(Q-beta). Во всех четырех случаях геномной нуклеиновой кислотой является линейная ssPHK. Поэтому такие фаги используются в качестве модельных объектов при изучении механизмов трансляции и регуляторных процессов, опосредованных РНК. Таким образом, бактериофаги в свое время были и, видимо, надолго останутся объектами фундаментальных исследований в области молекулярной биологии и пограничных с ней дисциплин. Велика их роль в экосистемах и глобальной эволюции, а также в микроэволюционных процессах. Необходимо в очередной раз отметить, что бактериофаги могут использоваться в качестве агентов борьбы с болезнетворными бактериями (при фаготерапии). В то же время они могут наносить урон тем биотехнологическим процессам, где продуцентами служат бактерии. 2. Классификация и систематика бактериофагов. Бактериофаги (или просто фаги) вирусы бактерий. Бактериофагия процесс взаимодействия фагов с бактериями, заканчивающийся очень часто их разрушением (от лат. bacteriophaga пожирающий бактерии). Бактериофаги распространены повсеместно. Они встречаются всюду, где есть бактерии в почве, воде, кишечном тракте человека и животных, гнойных выделениях и т.п. Особенно много фагов в сточных водах; из этого источника можно выделить практически любой фаг. Фагам присущи все биологические особенности, которые свойственны вирусам.Они устойчивы в пределах рН от 5,0 до 8,0, большинство из них не инактивируется холодными водными растворами глицерина и этилового спирта. На них не действуют такие ферментные яды, как цианид, фторид, динитрофенол, а также хлороформ и фенол. Фаги хорошо сохраняются в запаянных ампулах и в лиофилизированном состоянии, но легко разрушаются при кипячении, действии кислот, химических дезинфектантов, при УФ облучении. В основу классификации бактериофагов положен тип генома, морфология фагов, спектр действия, химический состав и др. Фаги, как и вирусы позвоночных, беспозвоночных и растений, по содержанию нуклеиновых кислот подразделяются на ДНК-и РНК-содержащие. По способности вызывать инфекцию различают фаги: инфекционные, т. е. способные вызвать разные формы фаговой инфекции; неинфекционные(вегетативные) или незрелые фаги, находящиеся еще в стадии размножения. В свою очередь инфекционные фаги разделяютна: покоящиеся– находящиеся вне клетки; вирулентные – способные вызвать продуктивную форму инфекции; умеренныефаги – способные вызывать не только продуктивную, но и редуктивную фаговую инфекцию. Среди умеренных фагов различаютфаги с полноценным и дефектным геном. Умеренные фаги характеризуются способностью существовать в состоянии профага, когда фаг вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды (вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки). В состоянии профага литические функции фага подавлены. Таким образом, типичный бактериофаг может существовать в трех состояниях (слайд): профага, вегетативного фага и зрелого фага. По спектру действия на бактерии фаги подразделяются на поливалентные, лизирующие бактерии нескольких видов; монофаги, лизирующие бактерии только одного вида, и типоспецифические фаги (типовые, Т-фаги),которые избирательно лизируют отдельные варианты бактерий внутри вида. С помощью таких фагов производится наиболее тонкая дифференциация бактерий внутри вида, с разделением их на фаговарианты. Например, с помощью набора фагов Vi-H возбудитель брюшного тифа делится более чем на 100 фаговариантов. Поскольку чувствительность бактерий к фагам является относительно стабильным признаком, связанным наличием соответствующих рецепторов, фаготипирование имеет важное диагностическое и эпидемиологическое значение. Бактериофаги обладают разнообразным, нередко сложным строением, что позволяет использовать их морфологию в качестве одного из критериев семейства или рода. Напомним, что в 1962 г. Андре Львов предложил классифицировать вирусы на основе особенностей морфологии вириона и по типу геномной нуклеиновой кислоты. В 1967 г. английский вирусолог Дэвид Брэдли (D.Е.Bradley) применил этот алгоритм к бактериофагам, подразделив их на шесть основных групп, или морфотипов. В группу А вошли dsДНК-фаги с сократимым хвостовым отростком, в группу В dsДНК-фаги с длинным несократимым хвостовым отростком; в группу С dsДHK- фаги с коротким несократимым хвостовым отростком; в группу DssДHК-фаги без хвостового отростка, с крупными капсомерами; в группу Е ssPHK-фаги без хвостового отростка, с мелкими капсомерами; в группу F ssДНК-фаги с нитевидным капсидом. Принадлежность к той или иной группе, по Брэдли, не коррелирует с таким важным признаком, как клеточная специфичность бактериофага. В частности, Escherichia sp. инфицируется фагами всех шести групп; Pseudomonas sp. бактериофагами пяти групп (за исключением группы D); Bacillus sp. четырех групп (кроме групп Dи F); Staphylococcus sp. только бактериофагами групп А и В. Упрощенная и уже устаревшая классификация Брэдли время от времени применяется до сих пор. Хотя для нетаксономической классификации вирусов в основном используется генетическая система Дэвида Балтимора, применительно к бактериофагам по-прежнему актуален морфологический критерий. Даже в тех случаях, когда они содержат один и тот же тип нуклеиновой кислоты и используют одинаковую стратегию генома, их относят к разным семействам в соответствии со строением хвостового отростка. Общие критерии рода у бактериофагов не разработаны, и в данном случае эта таксономическая категория носит условный характер. Внутри рода бактериофаги различаются по кругу хозяев, по чувствительности к абиотическим факторам (температуре, солености и т.д.), по модификации генов (вставки, делеции и т.д.), по вторичной структуре нуклеиновой кислоты (линейная, кольцевая, суперспирализованная и т.д.), а также по инфраструктуре генома. Официально признанные названия видов бактериофагов включают в себя названия хозяев и, как правило, наборы цифр, а также сочетания латинских или греческих букв, отражающие рабочие обозначения штаммов-изолятов. Эти названия пишутся курсивом, например Enterobacteriaphage Р22. Тривиальные названия бактериофагов, а также их аббревиатуры курсивом не обозначаются, например фаг , фаг Р22 и т.д. В отличие от симптомов вирусной инфекции растений и животных, внешние признаки инфекции у бактериофагов не имеют таксономического значения. За исключением феномена лизогенной конверсии единственным фенотипическим «проявлением» инфекции служат зоны лизиса или участки угнетения роста на газоне чувствительной бактерии, а также просветление суспензионной культуры, обусловленное лизисом клеток. Развитие иммунного ответа при вирусной инфекции. Механизмы противовирусного иммунитета имеют особенности, определяемые природой вирусов, паразитизмом на уровне молекулярных и субмолекулярных структур. Внеклеточный вирус не проявляет своего патогенного действия, а иммунные реакции против внеклеточных вирионов сходны с реакциями на другие микроорганизмы. Защитные реакции, направленные на внутриклеточные стадии развития вируса, действуют не на вирус, а на инфицированную вирусом клетку. Только таким путем происходит подавление репродукции вируса и освобождение от него. Кардинальные особенности противовирусной защиты защита клетки от проникшей в нее генетически чужеродной информации и подавление репродукции вируса. Несмотря на особенности, иммунные реакции в отношении вируса подчиняются тем же закономерностям, что и иммунные реакции в отношении других антигенов. Механизмы противовирусной защиты можно разделить на факторы резистентности организма, в норме невосприимчивого к определенному виду вируса (обладающего видовой невосприимчивостью), факторы неспецифической защиты восприимчивого организма и факторы приобретенного иммунитета. Факторы врожденной (естественной, видовой) резистентности невосприимчивого организма обусловливают врожденное состояние невосприимчивости к данной вирусной инфекции. Видовая резистентность определяется не иммунологическими реакциями организма, а неспецифическими механизмами. Имеют значение анатомические барьеры (кожа, слизистые респираторного тракта с мощным ресничными аппаратом, секреты слизистых, желудочный сок). Главную роль играет клеточная резистентость, обусловленная неспособностью вируса адсорбироваться и проникнуть в клетку, вирус не может быть депротеинизирован. Это обеспечивает абсолютную видовую невосприимчивость. Факторы неспецифической резистентности восприимчивого организма способны на первых этапах взаимодействия вируса с организмом подавить дальнейшее размножение и генерализацию вируса задолго до включения механизмов иммунитета. Наиболее изученными являются белковые вещества плазмы и секретов слизистых человека ингибиторы вирусной активности. Это термостабильные и термолабильные вируснейтрализующие факторы, которые могут нейтрализовать вирус за счет антигемагглютинирующего действия, активации комплекса вирус-антитело (как кофактор). Вирусные ингибиторы играют существенную роль в защите организма от вируса на первых этапах инфекции, их активность может быть соизмерима с титром антител. Поэтому при серодиагностике вирусных инфекций необходимо дифференцировать выявляемые антитела от вирусных ингибиторов, часто приходится для этого обрабатывать сыворотку для удаления ингибиторов. Фагоцитоз, играющий очень важную роль в противобактериальной защите, малоэффективен против вируса. Фагоцитированные вирусы не погибают в фагоците, могут быть защищены от действия других противовирусных факторов и транспортироваться внутрь организма в фагоците. Тем не менее, имеются данные об участии фагоцитарной системы в борьбе против вируса, особенно в очаге воспаления. Роль фагоцитоза в противовирусном иммунитете опосредованная, фагоцитоз включается в уничтожение клеток, пораженных вирусом, на этапе взаимодействия такой клетки с антителами против вируса. Различна роль микрофагов и макрфагов. Лейкоциты не играют существенной роли в защите против вирусных инфекций. Фактически, большинство вирусных заболеваний характеризуется полиморфнонуклеарной лейкопенией. С другой стороны, макрофаги фагоцитируют вирусы и пораженные вирусами клетки и играют важную роль в освобождении кровотока от вирусов. Температурный фактор. Повышение температуры тела при вирусной инфекции имеет существенное значение в защите, так как не только активирует многие защитные механизмы, но и обеспечивает термоинактивацию вирусов. Поэтому при вирусных инфекциях активность вирусов подавляется при температуре более 39С и не рекомендуют назначать жаропонижающие средства. Интерферон. Семейство кодируемых хозяином белков, продуцируемых клетками при стимуляции вирусными или невирусными индукторами. Интерферон сам по себе не обладает прямым действием на вирусы, но он воздействует на другие клетки того же вида, обеспечивая им невосприимчивость к вирусной инфекции. Интерфероны видоспецифичны. Интерферон, образованный одним видом может защищать от вирусной инфекции только клетки того же или родственного вида, но не клетки неродственных видов. Таким образом, в клетках человека проявляется антивирусный эффект человеческого интерферона, и, до некоторой степени, интерферона обезьяны, но не интерферона мыши или цыпленка. Активность не является вирусспецифической. Интерферон, индуцированный одним вирусом (или даже невирусными индукторами) может обеспечивать защиту против инфекции как тем же, так и неродственным вирусом. Однако, вирусы варьируют по их чувствительности к интерферону. Вирусы также варьируют по способности индуцировать интерферон, цитоцидные и вирулентные вирусы – плохие индукторы, а слабо вирулентные вирусы – хорошие индукторы интерферона. РНК–содержащие вирусы являются лучшими индукторами, чем ДНК-содержащие. Многие свойства интерферона делают его идеальным кандидатом на использование в профилактике и лечении вирусных инфекций; он нетоксичен, неантигенен, свободно распространяется по телу и обладает широким спектром антивирусной активности. Местное применение высоких доз интерферона показало некоторую полезность его применения против инфекций верхних дыхательных путей, герпетического кератита и бородавок гениталий. Иммунологические механизмы противовирусной защиты. Факторы специфического иммунитета при вирусных инфекциях те же, что и при инфекциях другой этиологии: антигенреактивные молекулы (антитела) и клетки (антигенреактивные Т-лимфоциты), обеспечивающие соответственно гуморальный и клеточный иммунитет. Вирусы как антигены принципиально не отличаются от других возбудителей. Стимуляция иммунной системы организма вирусными антигенами приводит к формированию иммунитета, который при многих вирусных заболеваниях настолько прочен, что сохраняется пожизненно (после натуральной и ветряной оспы, полиомиелита, кори, эпидемического паротита). При бактериальных инфекциях это наблюдается редко. Следует, однако, отметить, что сохранение пожизненного иммунитета может быть следствием пожизненной персистенции вируса в организме. Антигены вирусов различны, их роль в иммунных реакциях неодинакова. Например, антитела к нейраминидазе вируса гриппа в меньшей мере нейтрализуют инфекционные свойства вируса, чем антитела к гемагглютинину. Антитела к нуклеиновым кислотам вируса имеют малое значение. Главную роль играют оболочечные антигены, блокада которых антителами препятствует проникновению вируса в клетку. Вирионы стимулируют, и гуморальные и клеточные иммунные реакции. Размножение вируса в теле во время инфекции вызывает не только количественно большую иммунную реакцию, но также и освобождает и делает доступным для иммунной системы целый диапазон вирусных антигенов, включая поверхностные и внутренние антигены, а также неструктурные антигены типа ранних белков. В осуществлении гуморального антивирусного иммунитета наиболее важную роль играют антитела классов IgG, IgM и IgA. IgG и IgM играют главную роль в крови и тканевом пространстве, в то время как IgA более важны на поверхностях слизистых оболочек. Антитела осуществляют нейтрализацию вируса несколькими механизмами. Они могут предотвращать адсорбцию вируса на клеточных рецепторах, увеличивая деградацию вирусов, или предотвращать выход вирусного потомства из инфицированных клеток. Комплемент может реагировать вместе с антителами, вызывая повреждение поверхностей оболочечных вирионов, а также цитолиз инфицированных вирусом клеток. Антивирусная активность гуморального иммунитета наглядно проявляется в эффективности материнских антител и пассивно введенного иммуноглобулина для предупреждения многих вирусных инфекций. Защитный эффект убитых вирусных вакцин опирается на их способность стимулировать гуморальные антитела. Самым ранним признаком клеточного иммунитета при вирусных инфекциях было проявление повышенной чувствительности после прививки у иммунных лиц. Клеточный иммунитет реализуется за счет действия Т-киллеров на пораженную вирусом клетку за счет взаимодействия рецепторов Т-киллера с вирусными или вирусиндуцированными антигенами на поверхности пораженной клетки. В результате клетка погибает, цикл репродукции вируса прерывается. Вообще, вирусные инфекции сопровождаются прочным иммунитетом к реинфекции, который может в некоторых случаях быть пожизненным. Кажущиеся исключения, подобные вирусному насморку и гриппу, обусловлены не недостаточностью иммунитета, а результатом повторной инфекции, вызываемой антигенно различающимися вирусами. Живые вирусные вакцины также стимулируют более длительную защиту, чем бактериальные вакцины. Форма, строение, свойства фагов. Геном фагов заключен в капсид, структурные субъединицы которой уложены по типу либо спиральной, либо кубической симметрии. Крупные фаги, имеющие хвостик, устроены по типу двойной симметрии (головка икосаэдр, хвостик спиральная симметрия). Фаги различаются: по форме нитевидные, сферические; фаги, имеющие головку и хвостик; по размерам мелкие, среднего размера и крупные. Чем крупнее фаги, тем больше у них генов и сложнее их жизненный цикл. К самым маленьким относятся фаги М13 и X174. Морфологическая классификация бактериофагов: I тип – нитевидные ДНК-содержащие фаги, лизируют бактерии, имеющие F-плазмиды; II тип – фаги с аналогом отростка, мелкие РНК-содержащие фаги; III тип – фаги с коротким отростком (Т3,Т7); IV тип – фаги с несокращающимся чехлом отростка и двунитевой ДНК (Т1, Т5 и др.); V тип – ДНК-содержащие фаги с сокращающимся чехлом отростка, заканчивающимся базальной пластинкой (Т2, Т4, Т6). Фаг М13 нитевидный, геном однонитевая кольцевидная молекула ДНК с м.м. 2МД, содержит 8 генов. Оболочка в виде нити, состоит из 3000 белковых субъединиц, уложенных по спирали. Длина вириона1000 нм, его диаметр 6 нм. Фаг X174 икосаэдр с м.м. 6,2 МД, диаметр 25 нм. Геном однонитевая кольцевидная молекула ДНК, состоящая из 5400 нуклеотидов, несет 9 генов. Простые по строению головчатые и нитевидные фаги содержат одноцепочечную кольцевую ДНК (φХ174, fl и fd) или одноцепочечную линейную РНК (MS-2 и f2).Наиболее сложно устроены крупные фаги, состоящие из головки и хвостика. Сперматозоидной формы (двойной тип симметрии) фаги состоят из 40-50% спирально скрученной двухцепочечной ДНК, находящейся в полости головки фага, и 50-60% белка, из которого построены оболочка головки и отросток фага(колифаги группы Т1-Т7). У наиболее изученного сложного фага Т2, паразитирующего у Е. coli (кишечная палочка) различают следующие структуры: головка – икосаэдр, геном представлен двунитевой линейной ДНК, несущей около 200 генов. Головка с помощью воротника и зонтика связана с хвостиком, который имеет сложное строение – полый внутри стержень, заканчивающийся шестиугольной пластинкой с шестью шипами. Хвостик имеет белковый чехол, который состоит из 144 субъединиц, образующих 24 витка спирали; каждая белковая молекула содержит одну молекулу АТФ-азы и ион Са2+. Белок актиноподобный и способен сокращаться. В пластинке и шипах содержится лизоцим. Хвостик имеет 6 ворсинок. У неактивного фага они свернуты и сложноэфирными связями прикреплены к белкам чехла. В момент адсорбции ворсинки раскрываются и обеспечивают плотное прикрепление фага к бактериальной клетке. Основное назначение хвостика – обеспечение адсорбции фага на клетке. Если хвостик содержит белковый чехол, последний, благодаря своему сокращению, обеспечивает проникновение стержня через клеточную стенку и цитоплазматическую мембрану. 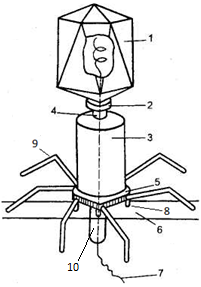 Рисунок 2 – Строение бактериофага Т2 (инъекция ДНК в бактерию): 1 – головка (капсид); 2 – «воротничок»; 3 – хвост (белковый чехол хвоста) нуклеиновая кислота 4 – шейка; 5 – базальная пластинка; 6 – оболочка бактерии; 7 – фаговая ДНК; 8 – шип; 9 – фибрилла (ворсинка) хвоста; 10 – полый стержень Фаг λ (лямбда) состоит из головки и хвостика. Его геном представлен двунитевой линейной ДНК, имеющей «липкие» концы (избыточные нуклеотидные последовательности на противоположных концах нитей, комплементарные друг другу), поэтому она может переходить в кольцевую структуру, необходимую для ее включения в хромосому клетки-хозяина. ДНК фага λ, имеет молекулярную массу около 30 МД, содержит 46 500 нуклеотидных пар и несет 32 гена, 7 из которых кодируют головку, 11– хвостик, а остальные играют регуляторную роль. Неканонические вирусы: прионы. Прионы составляют отдельный класс инфекционных агентов; они имеют белковую основу и не содержат генома, состоящего из нуклеиновых кислот. Концепция существования прионов включает в себя идею о новой, белковой наследственности — измененных формах белков в организме-хозяине, которые при переносе в новый организм могут вызвать в получателе нейродегенеративные заболевания. Большинство прионов являются патогенами, но по сравнению с другими классами патогенов (например, вирусами, бактериями, грибами, паразитами) они уникальны тем, что распространяются внутри и между хозяевами без переноса или репликации собственных ДНК или РНК. Молекула приона в «нормальной» форме имеется на поверхности нервных клеток у каждого человека. Обычные молекулы белка, вступая в контакт с патологическими, сами превращаются в них, изменяя при этом собственную пространственную структуру. Что является пусковым механизмом подобной трансформации, до конца не известно. Из этого следует, что прион, выступая в роли инфекционного агента, заражает нормальные молекулы, вызывая «молекулярную эпидемию». Токсичные белковые бляшки на клетке приводят к её гибели, а на месте погибшей клетки образуется пустота, которая заполняется жидкостью. Количество пустот в головном мозге с течением времени будет увеличиваться, пока он не превратится в «губку». Как можно заразиться прионами? На сегодняшний день выделяют следующие основные пути заражения инфекционным белком-прионом: 1. Трансмиссивный. В этом случае молекулы белка передаются от одного вида млекопитающего к другому - например, от инфицированной коровы или овцы человеку. Заражение происходит при употреблении в пищу мяса или молока заражённого животного, либо использовании его тканей (роговицы, препаратов крови и т.п.), применении во время оперативных вмешательств биологического шовного материала. 2. Наследственный. Заболевание развивается на фоне генетической мутации, затрагивающей область 20-й хромосомы. Несмотря на слабую изученность функционирования этого участка генома, достоверно известно его участие в синтезе нормального прионного белка. В случае генных мутаций вместо здорового приона образуется патологический, а это приводит к развитию болезней. 3. Спорадический. При этом аномальный белок появляется в организме спонтанно, без видимых причин. Вне зависимости от способа появления аномальный белок может стать причиной заражения других людей. Прионные заболевания: особенности течения, лечения, прогноз Отличительной особенностью болезней, вызываемых прионами, является длительный инкубационный период - от 2-3 месяцев до нескольких десятилетий. Подавляющее большинство прионных заболеваний человека являются спорадическими и имеют семейный характер наследования. Куру, синдром Герстманна-Штреусслера-Шейнкера, болезнь Крейтцфельдта-Якоба, скрэпи – прионы вызывают заболевания, сопровождаемые поражением центральной нервной системы. Для них характерны такие признаки как деменция (слабоумие), зрительные и мозжечковые нарушения. При этом у больного могут отмечаться двигательные расстройства, бессонница, галлюцинации, нарушение речи. К сожалению, эффективных методов лечения прионных болезней на сегодняшний день нет, хотя учёные пытаются предотвращать переход нормального белка в аномальный. Пациентам назначается симптоматическая терапия с использованием родолжение https://postnauka.ru/faq/79570 Вирусные инфекции растений: пути передачи вирусных инфекций у растений, особенности репликации вирусов растений, методы борьбы с вирусными инфекциями растений. противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом. П Вирусы растений - это вирусы , поражающие растения . Как и все другие вирусы, вирусы растений являются облигатными внутриклеточными паразитами , у которых нет молекулярного механизма для репликации без хозяина . Вирусы растений могут быть патогенными для высших растений Структура Вирусы чрезвычайно малы, и их можно наблюдать только под электронным микроскопом . Структура вируса определяется его слоем белков , которые окружают вирусный геном . Сборка вирусных частиц происходит спонтанно . Более 50% известных вирусов растений имеют стержнеобразную форму ( гибкую или жесткую). Длина частицы обычно зависит от генома, но обычно составляет от 300 до 500 нм при диаметре от 15 до 20 нм. Белковые субъединицы можно разместить по окружности круга, чтобы сформировать диск. При наличии вирусного генома диски складываются друг в друга, затем создается пробирка с местом для генома нуклеиновой кислоты посередине. Вторая по распространенности структура среди вирусов растений - изометрические частицы. Их диаметр составляет 25–50 нм. В случаях, когда имеется только один белок оболочки, основная структура состоит из 60 субъединиц Т, где Т - целое число . Некоторые вирусы могут иметь 2 белка оболочки, которые объединяются, образуя частицу икосаэдрической формы. Есть три рода Geminiviridae, которые состоят из частиц, которые похожи на две изометрические частицы, склеенные вместе. У очень небольшого числа вирусов растений, помимо белков оболочки, есть липидная оболочка . Это происходит из растительной клетки мембраны в качестве вирусной частицы почки отходящей от клетки . Передача вирусов растений Через сок Вирусы могут распространяться путем прямой передачи сока при контакте поврежденного растения со здоровым. Такой контакт может происходить во время сельскохозяйственных работ, например, в результате повреждения инструментами или руками, или естественным образом, например, когда животное питается растением. Обычно TMV, вирусы картофеля и вирусы мозаики огурца передаются через сока. Насекомые Стратегии передачи вируса растений среди насекомых-переносчиков. Вирусы растений должны передаваться переносчиками , чаще всего такими насекомыми , как цикадка . Было высказано предположение, что один класс вирусов, Rhabdoviridae , на самом деле представляет собой вирусы насекомых, которые в процессе эволюции размножаются в растениях. Выбранный насекомый-вектор вируса растений часто является определяющим фактором в диапазоне хозяев этого вируса: он может инфицировать только те растения, которыми питается насекомое-переносчик. Частично это было продемонстрировано, когда старая белая муха добралась до Соединенных Штатов, где перенесла многие вирусы растений в новых хозяев. В зависимости от способа передачи вирусы растений подразделяются на непостоянные, полупостоянные и стойкие. При непостоянной передаче вирусы прикрепляются к дистальному концу стилета насекомого, и на следующем растении, которым оно питается, оно заражает его вирусом. Полупостоянная передача вируса включает проникновение вируса в переднюю кишку насекомого. Те вирусы, которым удается пройти через кишечник в гемолимфу, а затем в слюнные железы , известны как стойкие. Существует два подкласса стойких вирусов: распространяющиеся и циркулирующие. Размножающиеся вирусы способны размножаться как в растении, так и в насекомых (и, возможно, изначально были вирусами насекомых), тогда как циркулирующие - нет. Циркуляционные вирусы внутри тли защищены симбионином белка- шаперона , продуцируемым бактериальными симбионтами . Многие вирусы растений кодируют в своем геноме полипептиды с доменами, необходимыми для передачи насекомыми. У непостоянных и полупостоянных вирусов эти домены находятся в белке оболочки и другом белке, известном как вспомогательный компонент. Была предложена промежуточная гипотеза , чтобы объяснить, как эти белки способствуют передаче вируса через насекомых. Компонент-помощник будет связываться со специфическим доменом белка оболочки, а затем с ротовым аппаратом насекомых, создавая мостик. В стойких размножающихся вирусах, таких как вирус пятнистого увядания томатов (TSWV), часто существует липидная оболочка, окружающая белки, которая не наблюдается в других классах вирусов растений. В случае TSWV в этой липидной оболочке экспрессируются 2 вирусных белка. Было высказано предположение, что вирусы связываются через эти белки, а затем попадают в клетку насекомых посредством рецепторно-опосредованного эндоцитоза . Нематоды Также было показано, что почвенные нематоды передают вирусы. Они приобретают и передают их, питаясь зараженными корнями . Вирусы могут передаваться как непостоянно, так и постоянно, но нет никаких доказательств того, что вирусы способны реплицироваться в нематодах. В вирионах прикрепляются к стилету (подавая орган) или в кишечник , когда они питаются на зараженном растение и затем могут отделяться при дальнейшем кормлении , чтобы заразить другие растения. Примеры вирусов, которые могут передаваться нематодами, включают вирус кольцевой пятнистости табака и вирус табачной погремушки . Плазмодиофориды Ряд родов вирусов передается устойчиво и непостоянно через почвенные зооспорические простейшие . Эти простейшие сами по себе не являются фитопатогенами, а паразитируют . Передача вируса происходит, когда они становятся связанными с корнями растений. Примеры включают Polymyxa graminis , которая, как было показано, передает вирусные заболевания растений зерновых культур, и Polymyxa betae, которая передает вирус некротической желтой жилки свеклы . Плазмодиофориды также создают раны в корне растения, через которые могут проникнуть другие вирусы. Вирусы, передаваемые через семена и пыльцу Передача вирусов растений из поколения в поколение происходит примерно у 20% вирусов растений. Когда вирусы передаются семенами, семена заражаются в генеративных клетках, и вирус сохраняется в зародышевых клетках, а иногда, но реже, в семенной оболочке. Когда рост и развитие растений задерживаются из-за таких ситуаций, как неблагоприятная погода, увеличивается количество вирусных инфекций в семенах. Кажется, что нет корреляции между расположением семени на растении и его шансами на заражение. [5] Мало что известно о механизмах передачи вирусов растений через семена, хотя известно, что это зависит от окружающей среды и что передача через семена происходит из-за прямого проникновения в зародыш через семяпочку или косвенным путем с атака на эмбрион, опосредованная инфицированными гаметами. [5] [6] Эти процессы могут происходить одновременно или по отдельности в зависимости от растения-хозяина. Неизвестно, каким образом вирус может напрямую вторгаться в эмбрион и пересекать его, а также границу между родительским и дочерним поколениями в яйцеклетке. [6] Многие виды растений могут быть инфицированы через семена, включая, помимо прочего, семейства Leguminosae , Solanaceae , Compositae , Rosaceae , Cucurbitaceae , Gramineae . [5] Вирус мозаики фасоли передается через семена. Прямая передача от растения к человеку Исследователи из Средиземноморского университета в Марселе, Франция, обнаружили незначительные доказательства того, что вирус, общий для перца, вирус легкой крапчатости перца (PMMoV), возможно, перешел к заражению людей. Это очень редкое и весьма маловероятное событие, поскольку для проникновения в клетку и репликации вирус должен «связываться с рецептором на своей поверхности, и маловероятно, что вирус растения распознает рецептор в клетке человека. что вирус не заражает клетки человека напрямую. Вместо этого голая вирусная РНК может изменять функцию клеток по механизму, аналогичному РНК-интерференции, при котором присутствие определенных последовательностей РНК может включать и выключать гены », - считает вирусолог Роберт Гарри из Тулейнского университета в Новом Орлеане, штат Луизиана. Основную роль в предотвращении распространения вирусных заболеваний имеют профилактические мероприятия: 1. Внешний карантин – предотвращение ввоза в страну особо патогенных вирусов, объектов внешнего карантина. 2. Внутренний карантин – предупреждение дальнейшего распространения уже имеющихся на территории страны вирусов. 3. Создание оздоровительных насаждений. 4. Постоянный мониторинг маточных насаждений. 5. Использование и получение оздоровительного от вирусов посадочного материала. 6. Преиммунизация – искусственное заражение слабо-агрессивными штаммами вируса, после чего растения становится менее восприимчивыми к агрессивным штаммам того же вируса. 7. Терапевтические мероприятия: термо- и хемотерапия, метод апикальной меристемы. 8. Селекционный метод – выведение устойчивых сортов. 9. Борьба с переносчиками. 10. Агрохимические мероприятия. 11. Фитопатологический мониторинг диких и одичавших насаждений культур, имеющих общие вирусы с сельскохозяйственными растениями. 12. Организационно-хозяйственные мероприятия – дезинфекция орудий труда, помещений, тары и субстратов для хранения посадочного материала. |
