Медицинская микробиология и вирусология ч1 (1). Т. П. Гажеева, Т. Х. Гордеева, Е. И. Хорошавина Медицинская микробиология и вирусология Часть 1
 Скачать 5.4 Mb. Скачать 5.4 Mb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «Марийский государственный университет» Институт естественных наук и фармации Т.П. Гажеева, Т.Х. Гордеева, Е.И. Хорошавина Медицинская микробиология и вирусология Часть 1 Йошкар-Ола, 2019 УДК 579.61 (0.6) Составители: Т.П. Гажеева, Т.Х. Гордеева, Е.И. Хорошавина Рецензенты: Малюта О.В., канд. биол. наук, доцент ПГТУ, Трубачев В.В., доктор биол. наук, доцент МарГУ Учебно-методическое пособие подготовлено в соответствии с базовой учебной программой по медицинской микробиологии для студентов 2 – 3 курсов. В данном пособии содержатся основные сведения о морфологии, физиологии, культивировании и генетике микроорганизмов. Общие вопросы вирусологии, классификация, биологические особенности вирусов и бактериофагов. Пособие предназначено для студентов медицинских специальностей «Лечебное дело», «Педиатрия» ПредисловиеОсновной задачей клинико-диагностических микробиологических исследований служит выявление в исследуемом материале этиологического агента, вызвавшего инфекционное заболевание. В связи с этим при изучении медицинской микробиологии особое внимание уделяется: знанию основных морфологических и структурных особенностей возбудителя, анализу современных методов выделения и культивирования микроорганизма, четкой формулировке целей и задач на каждом этапе лабораторного исследования, использованию современных методов диагностики.Задачами практикума являются: Овладение микроскопическими методами исследования и изучения морфологических признаков микроорганизмов, необходимых для их идентификации. Овладение студентами правил техники безопасности при работе в микробиологических лабораториях с микробными культурами, реактивами, приборами, лабораторными животными; Изучение студентами этиологии и патогенеза наиболее актуальных инфекционных заболеваний; Обучение студентов принципам и методам лабораторной диагностики и профилактики инфекционных заболеваний; Обучение студентов принципам и методам дезинфекции и стерилизации, основным дезинфицирующим средствам и правилам их использования; ЗАНЯТИЕ 1. Микробиологическая лаборатория. Методы изучения микроорганизмов. Морфология микроорганизмов. Простые методы окраски.Цель занятия: Ознакомиться с правилами работы в микробиологической лаборатории. Овладеть микроскопическим методом исследования с применением иммерсионной системы. Изучить морфологические особенности различных микроорганизмов, освоить технику приготовления простых методов окраски мазков-препаратов. Материалы и оборудование: Микроскопы. Набор готовых растворов красок во флаконах. Черная тушь. Бактериологические петли и иглы. Предметные стекла, покровные стекла, стеклянный мостик в ванночке для окраски препаратов. Дезинфицирующая жидкость, вата, фланелевая салфетка, карандаш по стеклу, иммерсионное масло, фильтровальная бумага, спички. Чистые культуры микроорганизмов, выращенные на агаровой среде. План занятия 1. Микробиологическая лаборатория. Оборудование, организация рабочего места. Правила работы с культурами микроорганизмов. 2. Методы изучения микроорганизмов. Микроскопический метод исследования. Виды современных микроскопов. Иммерсионная микроскопия. 3. Принципы классификации микроорганизмов. Классификация микроорганизмов по морфологическим и тинкториальным признакам. 4. Этапы приготовления мазков-препаратов, их фиксация. Простые способы окраски. Задание: 1. Научиться настраивать микроскоп и микроскопировать с иммерсионным объективом. 2. Провести самостоятельную микроскопию готовых окрашенных препаратов микрококков, кишечных палочек и бацилл. Изучить морфологию микроорганизмов. 3. Приготовить препарат дрожжей. Промикроскопировать и зарисовать. 4. Приготовить препараты-мазки из следующих бактериальных культур: а) Micrococcus lisodecticus; б) Escherichia coli; в) Bacillus antracoides; г) Bacillus megatherium. 5. Окрасить простым способом – фуксином, метиленовой синькой или генцианвиолетом. 6. Приготовить препарат из зубного налета. Окрасить по Бурри. 7. Промикроскопировать и зарисовать приготовленные и окрашенные мазки. Методические указания к практическому занятию: 1. Правила поведения и работы в микробиологической лаборатории 1. В микробиологической лаборатории студенты работают только в спецодежде (халаты, медицинская шапочка или косынка, сменная обувь), в необходимых случаях надевают медицинскую мазку; 2. В помещении микробиологической лаборатории не разрешается принимать пищу, курить. Не вносить в лабораторию посторонних вещей. 3. Категорически запрещается зажигать спиртовку от пламени другой спиртовки, используйте для этой цели спички. 4. С бактериальными культурами работают только с помощью инструментов (бактериологическая петля, скальпель, пинцет), которые после каждого соприкосновения с культурами прожигают в пламени спиртовки. 5. Растворы, содержащие патогенные микроорганизмы, забирают пастеровской пипеткой или с помощью пипетки-микродозатора; 6. Зараженный материал и использованные патогенные культуры подлежат обязательному уничтожению по возможности в тот же день; 7. При попадании исследуемого материала на стол, одежду, обувь и т.д. необходимо провести дезинфекцию; 8. При работе с электроприборами нельзя отключать прибор мокрыми руками. В случае неисправности прибора (нагревание, искрение, замыкание) его необходимо тотчас же обесточить и сообщить о случившемся преподавателю; 9. Студент должен иметь тетрадь для ведения протокола практического занятия, цветные карандаши. 10. В конце занятия студент обязан привести в порядок рабочее место, сдать материалы дежурному, вымыть руки, представить альбом с зарисовками и протоколами на подпись преподавателю. II. Основное оборудование микробиологических лабораторий Микробиологическая лаборатория располагает следующим оборудованием: микроскопы, сушильные шкафы, центрифуги, холодильники, бактерицидные лампы, термостаты, сухожаровые шкафы, автоклавы, дистиллятор, облучатели ОБН, инструменты и посуда для культивирования и манипуляций с микроорганизмами. Микроскоп – оптический прибор для получения сильно увеличенных изображений объектов (или деталей их структуры), невидимых невооружённым глазом. Для микробиологических исследований используют несколько типов микроскопов (световой, люминесцентный, электронный) и специальные методы микроскопии (фазово-контрастный и темнопольный). Световая микроскопия. Световой микроскоп – сложный оптический прибор, предназначенный для изучения в сильно увеличенном изображении мельчайших организмов (микроорганизмов) и структур тканей, невидимых невооруженным глазом. Микроскоп называется световым, т.к. он обеспечивает возможность изучать объект в проходящем свете в светлом и темном поле зрения, проводить фазово-контрастную, люминесцентную и другие виды микроскопии.  фото 1. (ссылка 8110bdc.jpg) В микроскопе различают механическую и оптическую части (фото1). Механическая часть включает: 1) штатив; 2) тубусодержатель, 3) устройство для макро- и микронаводки; 4) тубус; 5) револьвер объектива; 6) предметный столик. Оптическая часть микроскопа включает: 1) объектив; 2) окуляры; 3) осветительное устройство. Объективы являются средством определения полезного увеличения. Они состоят из сложной центрированной системы линз, дающей возможность получить увеличенное обратное изображение предмета. Увеличительные возможности указаны цифрами на его поверхности(8, 10, 20, 40, 60, 90, 100). Все объективы по способу употребления делят на сухие и иммерсионные. В сухих между фронтальной линзой и рассматриваемым препаратом находится воздух. Эти объективы характеризуются слабым увеличением и относительно большим фокусным расстоянием. Для иммерсионных объективов характерно короткое фокусное расстояние и большое увеличение. В иммерсионных объективах пространство между фронтальной линзой и препаратом заполнено кедровым или вазелиновым маслом, которое обладает показателем преломления n = 1,510, близким к показателю преломления стекла. В связи с этим световой пучок, вышедший из предметного стекла, не рассеивается и, не меняя своего направления, попадает в объектив, обеспечивая хорошую освещенность. Увеличение окуляров обозначено на оправе цифрами 5, 7, 10, 15, 20. Общий показатель увеличительных способностей прибора определяется путем перемножения показателя увеличения объектива на увеличение окуляра. Конденсор – система линз, собирающих лучи, отраженные зеркалом. Окрашенные препараты лучше просматривать при открытой почти полностью диафрагме. Неокрашенные объекты следует изучать при суженном отверстии диафрагмы, причем необходимо тем сильнее уменьшать отверстие, чем нежнее структура изучаемого объекта. Фазово-контрастная микроскопия позволяет изучать живые и неокрашенные объекты за счет повышения их контрастности. В основе метода лежит превращение фазовых невидимых изменений светового луча в амплитудные, контрастные, видимые. Достигается это с помощью фазово-контрастных приспособлений, которые монтируются в обычном оптическом микроскопе. Люминесцентная микроскопия – микроскопия светящегося на темном фоне объекта. Люминесценция (или флюоресценция) – это явление, когда некоторые вещества под влиянием падающего на них света испускают лучи с другой (обычно большей) длиной волны. Различают собственную (первичную) и наведенную (вторичную) флюоресценцию. При первичной флюоресценции исследуемый объект содержит вещества, способные флюоресцировать при освещении их ультрафиолетовыми лучами. Большая часть объектов не обладает собственной флюоресценцией, поэтому при люминесцентной микроскопии их обрабатывают красителями (флюорохромами), способными флюоресцировать. Кроме того, вещества, имеющие определенный цвет при обычном освещении, при освещении ультрафиолетовыми лучами приобретают совершенно другой цвет. Объект невидимый в ультрафиолетовом свете, может приобрести яркий блеск после обработки его флюорохромом. Флюорохромы связываются с нуклеиновыми кислотами или белками и образуют прочные комплексы, которые светятся в люминесцентном микроскопе желто-зеленным, оранжево-красным, коричнево-красным цветом. Сила их света бывает различной, но чаще всего она невелика, поэтому люминесцентную микроскопию следует проводить в затемненном помещении. В качестве флюорохромов используют аурамин, акридин желтый, корифосфин, флюоресцеинизотиоцианат (ФИТЦ). Люминесцентная микроскопия нашла широкое применение для визуализации результатов иммунохимических реакций, основанных на специфическом взаимодействии меченных флюоресцирующими красителями антител с антигенами изучаемого объекта. Антитела метят различными способами: флюорохромами (флюоресцеин, родамин и др.), при помощи ферментной реакции (пероксидаза хрена) или электронно-плотными частицами (ферретин, коллоидное золото). Электронная микроскопия используется для изучения структуры клеток на субклеточном и молекулярном уровнях, а также для изучения вирусов. Электро́нный микроско́п позволяет получать изображение объектов с максимальным увеличением до 106 раз, благодаря использованию, в отличие от оптического микроскопа, вместо светового потока пучка электронов с энергиями 200 В ÷ 400 кэВ и более (например,просвечивающие электронные микроскопы высокого разрешения с ускоряющим напряжением 1 МВ). Чтобы увеличить разрешающую способность микроскопа, нужно уменьшить длину волны, освещающей исследуемый объект. Поэтому вместо световых лучей в электронном микроскопе используются электроны, длина волны которых в тысячи раз меньше длины волны фотонов. Разрешающая способность электронного микроскопа превосходит разрешение оптического микроскопа в 1000 - 10000 раз. Принцип получения изображения в электронном микроскопе такой же, как и у оптического. Но в отличие от оптического микроскопа, где световым лучом управляют линзы, находящиеся в объективе и окуляре, в электронном микроскопе это делается с помощью магнитных линз.  фото 2. Электронный сканирующий микроскоп (ссылка pulson.ru) 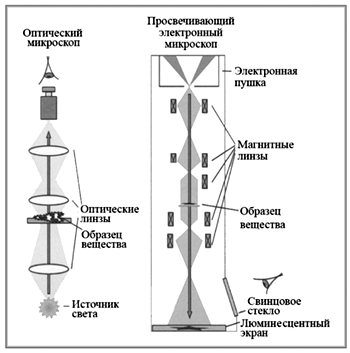 Рис 1. Схема электронного микроскопа (ссылка 12-1.jpg) В электронном микроскопе поток электронов падает на образец сверху, а изображение получается внизу. Корпус электронного микроскопа представляет собой металлическую трубу. В её верхней части расположен источник электронов. Это вольфрамовая нить накала, называемая катодом. На неё подаётся высокое напряжение, и начинается излучение электронов с поверхности катода. Пучок электронов ускоряется с помощью высокой разности потенциалов между катодом и анодом. Для этой цели используется напряжение от 20 кВ до 1 мВ. Далее ускоренный поток фокусируется и направляется системой магнитных линз на исследуемый образец. Пройдя через него, он попадает в систему увеличивающих магнитных линз. Вся эта система называется электронной колонной. Так как наш глаз не может воспринимать электронные пучки, то изображение создается на люминесцентном экране либо фиксируется на фотопластинке или цифровой камере. Чтобы электроны не рассеивались в результате столкновений с молекулами воздуха, внутри колонны создаётся вакуум. Различают два типа электронных микроскопов: трансмиссионный (просвечивающий) электронный микроскоп и сканирующий (растровый) электронный микроскоп. III. Приготовление мазка из чистых культур микроорганизмов Основное требование при работе с микроорганизмами – соблюдение асептики, т.е. таких условий, при которых в пробирку с изучаемой культурой не смогли бы попасть другие микроорганизмы (например, из воздуха, с предметов, используемых в процессе выполнения работы). Кроме того, нужно иметь в виду, что среди микроорганизмов многие условно патогенные, что требует повышенного внимания и аккуратности в работе. Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели. Бактериологические петли изготовляют из проволоки, которую закрепляют в специальных металлических держателях или впаивают в стеклянные палочки. Толщина игл и петель не должна превышать 0,5 мм. Приготовление бактериальных препаратов. На чистое обезжиренное предметное стекло пипеткой или бактериологической петлей наносят каплю водопроводной воды или физиологического раствора. Пробирку с культурой, из которой необходимо приготовить мазок, в наклонном положении помещают на указательном и среднем пальцах левой руки и сверху прижимают большим пальцем так, чтобы хорошо была видна вся поверхность питательной среды с выросшими на ней микроорганизмами. Прежде чем взять материал из культуры, необходимо прокалить бактериологическую петлю в пламени горелки до покраснения. При этом петля должна находиться в вертикальном положении, чтобы пламя охватывало не только всю петлю, но и часть иглодержателя. При работе петлю держат в правой руке, как карандаш или ручку. Если в работе используются суспензии микроорганизмов или культуры, выращенные на жидких средах, они берутся предварительно простерилизованной пипеткой, у которой широкий конец закрыт ватой. Взятие материала проводят следующим образом: зажав пробку между мизинцем и ладонью правой руки (в ней уже находится подготовленная петля, вынимают ее из пробирки и держат концом вниз). Открытый конец пробирки обжигают на пламени, затем вводят в пробирку петлю, охлаждают прикосновением к стенке пробирки и набирают небольшое количество материала, слегка прикасаясь к культуре. После взятия материала пробирку тотчас закрывают той же ватной пробкой, предварительно обжигая конец ватной пробки и края пробирки над пламенем спиртовки. Взятый материал эмульгируют в имеющейся на предметном стекле капле и равномерно тонким слоем петлей распределяют по поверхности. После нанесения капли культуры на предметное стекло и распределения ее, пипетку опускают в сосуд с дезинфицирующим раствором. Затем препарат высушивают на воздухе при комнатной температуре, для ускорения процесса можно подсушить препарат высоко над пламенем спиртовки. Подсушивание надо проводить очень осторожно, не допуская перегрева мазка, так как при этом может произойти быстрое свертывание белков бактериальной клетки, что нарушает ее структуру. Фиксация мазка. После подсушивания препарат фиксируют. Фиксация ставит своей целью убить микроорганизмы, обеспечить лучшее прикрепление мазка к стеклу, сделать мазок более восприимчивым к краске. Существует несколько методов фиксации мазка. Наиболее простой и распространенный среди них – фиксация над пламенем спиртовки. Для этого препарат несколько раз проводят в средней части пламени спиртовки, каждый раз при этом прикладывая стекло к коже руки. Ощущение жжения свидетельствует о том, что мазок зафиксирован. Длительная фиксация не рекомендуется, так как может изменить структуру бактериальной клетки и ее форму. Этот способ фиксации нельзя применять при исследовании строения клетки. Можно вместо термической проводить химическую фиксацию, которую применяют при изучении структуры клетки. В этом случае она осуществляется с помощью определенных химических веществ: Этиловый спирт в течение 10–15 минут. В отдельных случаях также используется абсолютный спирт. Смесь равных объемов этилового спирта и серного эфира (смесь Никифорова), фиксация в течение 10–15 минут. Ацетон (в течение 5 минут). Метиловый спирт (2–3 минуты). Жидкость Карнуа (10 минут) Простые методы окраски. При простом методе окраски используется один какой-нибудь красящий раствор, чаще всего фуксин Пфейффера (спиртоводный раствор 1:10) или метиленовая синька. Техника окраски заключается в следующем: на высушенный и фиксированный препарат пипеткой наносят краситель в таком количестве, чтобы он покрывал весь мазок. Фуксином красят 1–2 минуты, а метиленовым синим 3-5 минут. Затем смывают краску водой, а мазок подсушивают промоканием фильтровальной бумагой или на воздухе. При окраске мазков концентрированными растворами красителей (карболовый фуксин Циля, карболовый генциановый или кристаллический фиолетовый) окрашивание производят через фильтровальную бумагу, задерживающую частицы красителя: на фиксированный мазок кладут полоску фильтровальной бумаги и на нее наливают раствор красителя. Окраска мазков красящей бумагой. На высушенный и фиксированный препарат наносят несколько капель воды, кладут окрашенные бумажки величиной 22 см. В течение всего времени прокрашивания бумага должна оставаться влажной и плотно прилегать к поверхности стекла. При подсыхании бумагу дополнительно смачивают водой. Продолжительность окрашивания мазка определяется методом окраски. По окончании окраски бумагу осторожно снимают пинцетом, а мазок промывают водопроводной водой и подсушивают на воздухе или фильтровальной бумагой. Мазок после обсушивания фильтровальной бумагой должен быть совершенно сухим, в противном случае при соприкосновении оставшейся влаги с кедровым маслом образуется эмульсия и при микроскопии получится неясное изображение. Микроскопическое исследование зубного налета. Окраска по Бурри. На предметное стекло наносят каплю 3% раствора краски (хорошо отцентрифугированная тушь), в эту каплю вносят исследуемый материал и слегка смешивают. Затем при помощи шлифовального стекла постепенно под углом 45о делается мазок (также как мазок крови). Мазок высушивают на воздухе, не фиксируют и рассматривают под иммерсионной системой микроскопа. На черном фоне хорошо видны неокрашенные формы микроорганизмов. Приготовление прижизненных препаратов Для прижизненных наблюдений наиболее часто готовят препараты «раздавленная капля» или «висячая капля». Работу проводят в следующем порядке: 1) приготовить предметное и покровное стекла; 2) зажечь спиртовку; 3) взять пробирку со стерильной водой в левую руку и поместить её наклонно между большим и указательным пальцем на расстоянии 3–5 см от пламени; 4) в правую руку взять петлю простерилизовать ее в пламени спиртовки, включая часть петледержателя, которая при работе помещается в пробирку; 5) мизинцем правой руки зажать пробку пробирки, повернуть, вынуть ее и держать, не касаясь окружающих предметов; 6) обжечь края пробирки и взять петлей каплю воды, поместить её на предметное стекло; 7) обжечь края пробирки и пробку. Закрыть пробирку и поставить в штатив; 8) прожечь петлю; 9) открыть пробирку с культурой так же, как в п.5; 10) стерильную петлю ввести в пробирку с культурой, охладить, прикоснувшись к внутренней поверхности пробирки, а затем взять ею небольшое количество микроорганизмов; 11) петлей с микроорганизмами сделать штрих на стекле внутри капли воды. После этого петлю прожечь и охладить, прикоснувшись к стеклу; 12) растереть штрих петлей круговыми движениями, чтобы получилась слегка опалесцирущая суспензия; 13) петлю прожечь; 14) полученную суспензию микроорганизмов накрыть покровным стеклом и микроскопировать. Чтобы избежать в поле зрения пузырьков воздуха, нужно, расположив покровное стекло под углом 40–45°, прикоснуться им к краю капли и, когда она распределится вдоль грани, осторожно накрыть каплю. Препарат можно подкрасить метиленовым синим (в концентрации 0,01-0,001), капнув непосредственно в препарат или поместив каплю красителя у края покровного отекла, с противоположное стороны полоску фильтровальной бумаги. При изготовлении препарата нужно учитывать размер капли, который должен быть равен приблизительно объему двух рисовых зерен. Маленькая капля быстро высыхает, при большой капле – покровное стекло плавает на поверхности капли, что мешает качественному изображению объекта при микроскопировании. IV.Техника микроскопирования окрашенных микропрепаратов с иммерсионной системой Под малым увеличением микроскопа (объектив ×8,×10) наводят свет и определяют на препарате участок микроскопирования. На выбранное место наносят каплю кедрового масла и осторожно погружают в него фронтальную линзу иммерсионного объектива (×90). Иммерсионные объективы имеют короткое фокусное расстояние (до 1–3 мм), поэтому наводить на резкость следует путем поднимания объектива, а не опускания, так как, в противном случае можно раздавить препарат или повредить фронтальную линзу. Используя макровинт, осуществляют грубую наводку на препарат. Затем руки переводят на микровинт и осуществляют более точную наводку на резкость. По окончании работы поднимают тубус, убирают препарат, а с фронтальной линзы снимают масло фланелевой тряпочкой. Оставлять надолго систему в масле не рекомендуется. Если масло засохло, нужно ватой, слегка смоченной чистым бензином или ксилолом, увлажнить поверхность линзы и тотчас же протереть сухой тряпочкой. Однако следует помнить, что эфир, спирт и особенно ксилол способны растворять вещество, которым склеены линзы объектива. Если необходимо сохранить препарат, иммерсионное масло осторожно снимают ваткой, смоченной в ксилоле. Ксилол удаляют, накладывая на препарат полоску фильтровальной бумаги. По окончании работы микроскоп тщательно вытирают чистой салфеткой и закрывают колпаком. V. Изучение морфологии микроорганизмов Традиционно считают, что по форме большинство микроорганизмов бывают шаровидными (сферическими), палочковидными (цилиндрическими) и извитыми. Кроме того, существуют нитчатые формы бактерий, а также бактерии необычной (неправильной) формы. 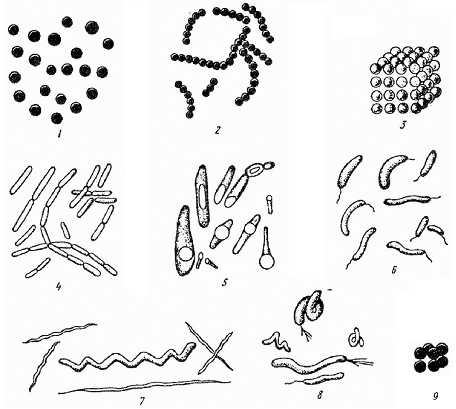 1 – микрококки; 2 – стрептококки; 3 – сарцины; 4 – бесспоровые палочки; 5 – споровые палочки (бациллы); 6 – вибрионы; 7 – спирохеты; 8 – жгутиковые спириллы; 9 – стафилококки. Шаровидные бактерии, или кокки (гр. kokkos – зерно), по форме сферические. Помимо правильной шаровидной формы, клетки могут иметь овальную или ланцетовидную форму (пневмококки) или бобовидную форму кофейного зерна (гонококки, менингококки). Шаровидные бактерии, как правило, не имеют жгутиков, неподвижны и спор не образуют. Исключение составляет мочевая сарцина (Sporosarcina ureae). Диаметр кокков 0,5–1,2 мкм. Шаровидные формы образуются в результате деления клеток в одной, двух, трех взаимно перпендикулярных или разных плоскостях. Моно- или микрококки (род Micrococcus). Их клетки делятся в любой плоскости и сразу после деления обособляются, располагаясь одиночно. При делении клеток в одной плоскости клетки могут располагаться попарно, в связи с чем, такие формы получили название диплококков (род Diplococcus). Если деление происходит последовательно в одной плоскости и клетки соединены в виде цепочки, – это стрептококки (род Streptococcus). Деление кокка в двух взаимно перпендикулярных плоскостях ведет к образованию четырех клеток, или тетракокки. Пакетообразные кокки, или сарцины (род Sarcina), – результат деления кокков в трех взаимно перпендикулярных плоскостях. При этом образуются пакеты из 8-16 клеток и более. Беспорядочное расположение клеток или образование скоплений, напоминающих гроздья винограда, происходит при делении кокков в разных плоскостях; такие формы называются стафилококками (род Staphylococcus). Палочковидные, или цилиндрические формы – это самая многочисленная и разнообразная группа бактерий. Их различают по величине клеток, расположению, очертанию концов клетки, по наличию или отсутствию жгутиков. Длина клетки палочковидных бактерий колеблется от десятых долей микрометра до 10–15 мкм и более, диаметр клетки от 0,5 до 1,0 мкм. Размер клеток зависит от условий выращивания культуры (состава среды, значения рН, аэрации, температуры) и возраста культуры. Большинство палочковидных микроорганизмов неспорообразующие, они получили название бактерий (гр. bacteria – палочка). Палочковидные бактерии, способные при неблагоприятных условиях формировать споры, принято называть бациллами (лат. bacillum – палочка). У мелких бактерий разница между длиной и шириной невелика; по внешнему виду они напоминают кокки, в связи, с чем такие формы получили название коккобактерии (возбудитель бруцеллеза). Среди палочковидных форм, образующих споры, различают бациллы (род Bacillus) и клостридии (род Clostridium). Бациллы – аэробы, у них споры не превышают толщины вегетативной клетки. Клостридии – анаэробы, их споры толще вегетативной клетки. Такие формы напоминают веретено, ракетку, лимон, барабанную палочку. Клостридии принимают участие во многих процессах в природе: вызывают аммонификацию белковых веществ, мочевины, разлагают фосфорорганические соединения, фиксируют молекулярный азот. Некоторые клостридии являются возбудителями анаэробных инфекций – газовой гангрены (Clostridium perfringens, Cl. oedematiens, Cl. septicum, Cl. histolyticura и др.), палочка столбняка (Cl. tetani) и возбудитель ботулизма (Clostridium botulinum). Палочки, как и кокки, могут располагаться попарно или цепочкой. При соединении бактерий попарно образуются диплобактерии, при таком же соединении бацилл – диплобациллы. Соответственно образуются стрептобактерии и стрептобациллы, если клетки располагаются цепочкой. Извитые формы микробов определяют не только по длине и диаметру, но и по числу завитков. Их делят на три типа клеток: Вибрионы (лат. vibrare – колебаться, дрожать) имеют вид изогнутой палочки или запятой. Длина клетки составляет 1-3 мкм. К вибрионам относится, например, Vibrio cholerae – возбудитель холеры. Спириллы (лат. spiro – изгиб) – это спирально изогнутые клетки с малым числом завитков (3–5) и имеют форму латинской буквы S. Размеры клетки по сравнению с вибрионами значительно крупнее – 15–20 мкм. Среди спирилл встречаются патогенные и сапротрофные представители. Spirillum volutans – типовой вид, встречается в стоячей пресной воде. S. minus – патогенная спирилла, у человека вызывает лихорадку от укуса крыс. Спирохеты (лат. spiro – изгиб, гр. chaite – хохол, грива) представлены очень тонкими длинными клетками штопорообразной формы с большим числом мелких витков. Длина клетки превосходит ширину в 5–200 раз. Число витков спирали является одним из систематических признаков при определении вида. Бактерии рода Spirochaeta – непатогенные, встречаются в пресных и морских водах, а также могут обнаруживаться в зубном налете. Среди патогенных для человека спирохет известны представители родов Borrelia recurrentis (вызывают возвратный тиф) и Treponemapallidum(возбудители сифилиса), Leptospira interrogans (возбудитель лептоспироза) Оформление лабораторной тетради: Зарисовать схему хода лучей в сухой и иммерсионной системах. Зарисовать демонстрационные и приготовленные препараты микрококка, кишечной палочки, антракоидной палочки. Зарисовать препарат дрожжей и препарат с зубного налета. Записать увеличение микроскопа. Заполнить таблицу (зарисуйте основные формы микроорганизмов). Таблица 1 Морфологические формы микроорганизмов
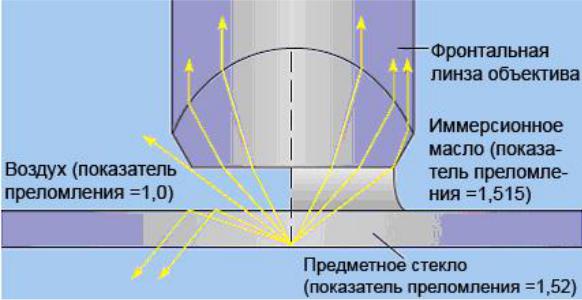 Рисунок 1. Ход лучей в сухой и иммерсионной системах Контрольные вопросы по теме занятия: 1. Как организована учебная микробиологическая лаборатория и рабочее место в ней? 2. Каковы правила техники безопасности и пожарной безопасности при работе в микробиологической лаборатории? 3. Какие действия запрещаются в микробиологической лаборатории? 4. Какие типы микроскопов используют в микробиологических исследованиях? 5. Из каких частей состоит микроскоп и каково их назначение? 6. Какими показателями характеризуются объективы? 7. Как определить оптимальную величину увеличения окуляра? 8. Что такое разрешающая способность микроскопа? 9. Для чего используется иммерсионная микроскопия? 10. Что такое стерилизация, дезинфекция, асептика? 11. Какая посуда используется для выращивания микроорганизмов? 12. Какие свойства микроорганизмов исследуются на прижизненных и постоянных препаратах? 13. Как приготовить препарат «раздавленная капля»? 14. Какими методами проводится фиксация микроорганизмов на предметном стекле? 15. Какие красители используют для окраски микроорганизмов? Для каких целей используют сложные методы окраски? 16. Сколько времени требуется для окрашивания мазка фуксином или метиленовым синим? 17. Как приготовить и зафиксировать мазок из культуры микроорганизмов? 18. Почему необходимо хорошо просушить мазок для иммерсионной микроскопии? Тесты: 1.Шарообразные бактерии называются… а) спирохетами б) бациллами в) вибрионами г) кокками 2.Самыми крупными среди бактерий являются… а) серобактерии б) микоплазмы в) риккетсии г) стафилококки 3.Палочковидную форму имеют бактерии… а) сарцины б) стрептококки в) бациллы г) микрококки 4.Извитую форму имеют бактерии… а) спириллы б) кишечные палочки в) микоплазмы г) псевдомонады 5.Бактерии, способные образовывать разные формы в различных условиях обитания, называются… а) полиморфными б) диморфными в) мономорфными г) псевдоморфными 6.Бактерии, имеющие форму запятой, называются… а) спирохетами б) спириллами в) вибрионами г) коккобациллами 7.Бактерии, образующие после деления в трёх взаимно перпендикулярных плоскостях пакеты правильной формы, относят к… а) сарцинам б) бациллам в) микрококкам г) диплококкам 8.Бактерии, образующие скопления неправильной формы в виде виноградной грозди, называются… а) стафилококками б) тетракокками в) диплококками г) микрококками 9.Образования кубической формы в результате деления кокков в трех взаимно перпендикулярных плоскостях – это… а) бациллы б) стафилококки в) сарцины г) тетракокки 10.Длинные тонкие клетки с большим числом (от 6 до 15 и более) мелких витков – это… а)спирохеты б) спириллы в) сарцины г) стрептобациллы 11.Бактерии, не имеющие клеточной стенки и постоянной формы, называются … а) микоплазмами б) актиномицетами в) спирохетами г) сарцинами 12.Размер бактериальной клетки обычно выражается в … а) мкм б) нм в) мм г) пм 13.Бактерия – возбудитель холеры по форме клетки является … а) спириллой б) вибрионом в) спирохетой г) сарциной |
