Медицинская микробиология и вирусология ч1 (1). Т. П. Гажеева, Т. Х. Гордеева, Е. И. Хорошавина Медицинская микробиология и вирусология Часть 1
 Скачать 5.4 Mb. Скачать 5.4 Mb.
|
ЗАНЯТИЕ 8. Физиология микроорганизмов. Рост и размножение микроорганизмов. Методы стерилизации и дезинфекции.Цель занятия: Изучить культуральные свойства выделенных микроорганизмов. Ознакомиться с методами стерилизации и дезинфекции. Материалы и оборудование: посевы предыдущего занятия, МПА на скошенном агаре. Стерильная среда (МПА) – скошенный питательный агар. Набор красителей для окраски по Граму, предметные стекла, фильтровальная бумага, лупы, линейки, пастеровские пипетки. Демонстрационный материал: Подготовленная для стерилизации посуда (пробирки, пипетки, чашки Петри, колбы), автоклав, сушильный шкаф, таблицы. План занятия: Рост и размножение микроорганизмов. Кривая роста и размножения бактериальной популяции в периодической культуре. Непрерывное культивирование. Идентификация микроорганизмов по культуральным признакам. Стерилизация. Методы и аппаратура. Дезинфекция, асептика и антисептика. Задание: Учесть результаты первого дня выделения чистой культуры микроорганизмов. И продолжить ее выделения (второй день): а) описать морфологию колоний на чашках с МПА; б) отобрать изолированную колонию; в) из части колонии сделать мазки и окрасить по Граму; г) пересеять исследуемую колонию на скошенный агар. Изучить культуральные свойства колоний микроорганизмов, выращенных на плотной питательной среде. Записать методы стерилизации, охарактеризовать их условия, полноту, аппаратуру, режим, используемый материал в табл. Записать методы дезинфекции, асептики и антисептики. Методические рекомендации к практическому занятию: Рост микробов на плотной питательной средеДля изучения культуральных свойств колоний микробы выращивают на плотных питательных средах в чашках Петри. При посеве материала стараются получить изолированный рост колоний. Чашки с посевом просматривают сначала невооруженным глазом или через лупу, затем помещают их на столик микроскопа вверх дном и просматривают колонии в проходящем свете с объективом малого увеличения. Колонии характеризуют по следующим признакам: Величина колонии определяется ее диаметром. В зависимости от диаметра различают колонии точечные (диаметр меньше 1 мм), мелкие (диаметр 1-2 мм), средние (диаметр 2-4 мм) и крупные (диаметр 4-6 мм и более). Форма колонии – правильная – круглая, неправильная – амебовидная, ризоидная – корневидная, напоминающая переплетающиеся корни деревьев. Характер контура края определяют при рассмотрении колонии под лупой или микроскопом с малым увеличением. Различают ровные края в виде четко выраженной линии и неровные. В некоторых случаях четко выраженная линия, отграничивающая колонию от поверхности среды, отсутствует. Такой край колонии называется расплывчатым. Рельеф колонии характеризуется приподнятостью ее над поверхностью питательной среды и контуром формы в вертикальном разрезе. Определяется рельеф колонии невооруженным глазом или с лупой при рассматривании сверху и сбоку. Различают: каплеобразные и куполообразные колонии правильной круглой формы; колонии с приподнятой в виде соска серединой и валиком по периферии; колонии с вдавленным центром; колонии плоские, стелющиеся по поверхности среды. Поверхность колонии изучают с помощью лупы или под микроскопом при малом увеличении. Поверхность колоний бывает матовая или блестящая с глянцем, сухая или влажная, гладкая или шероховатая. Гладкие колонии обозначают буквой S (smooth), шероховатые – буквой R (rough), что означает соответственно «гладкий» и «шероховатый. Цвет колонии определяется пигментом, который продуцирует микроб. В проходящем свете такие колонии в большей или меньшей степени прозрачны. Пигментообразующие виды бактерий дают колонии различных цветов: кремовые, желтые, золотисто-оранжевые, синие, красные, сиреневые, черные и др. Внутренняя структура колоний определяется в проходящем свете при слабом увеличении микроскопа, суженой диафрагме или при несколько опущенном конденсоре. У пигментированных колоний и колоний, не пропускающих света, она не определяется. Внутренняя структура может быть гомогенная, зернистая, волокнистая, характеризующиеся наличием длинных, густо переплетающихся нитей в толще колонии. Консистенция колонии определяет ее физическое состояние, исследуют посредством прикосновения или взятия из нее части материала бактериальной петлей. По характеру консистенции колонии бывают: пастообразные, легко снимающиеся и размывающиеся по поверхности питательной среды наподобие сливочного масла; вязкие или слизистые, прилипающие и тянущиеся за петлей; волокнистые или кожистые, плотные, снимающиеся с поверхности питательной среды в виде упругой пленки, соответствующей величине и форме колонии; хрупкие, сухие, рассыпающиеся при прикосновении петли. 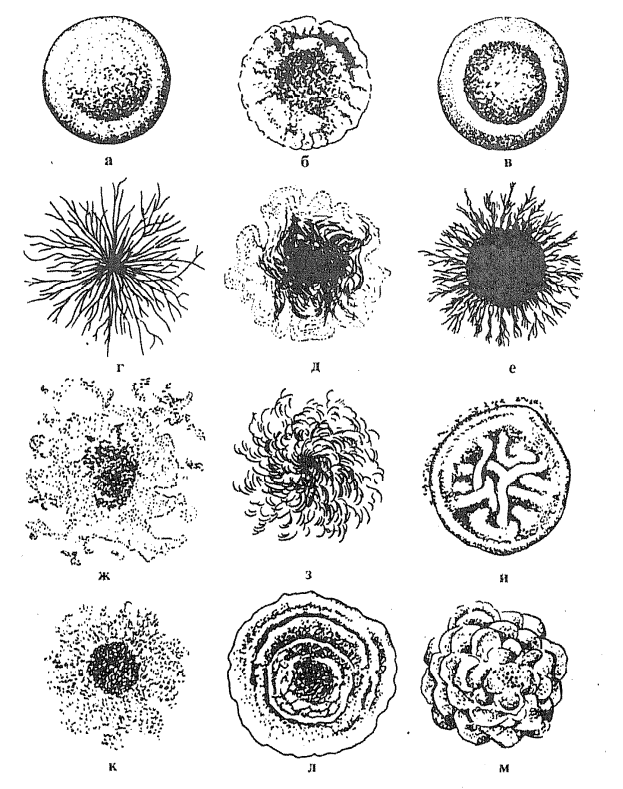 Рис.1.Формы колоний (по Е.З.Тепперу,1993). а – круглая, б – круглая с фестончатым краем, в – круглая с валиком по краям, г, д – ризоидная, е – круглая с ризоидными краями, ж – амебоидная, з – нитевидная, и – складчатая, к – неправильная, л – концентрическая, м – концентрическая сложная. Особенности микробного роста на жидких питательных средах На жидких питательных средах характер роста зависит от физиологических свойств бактерий. Рост бактерий в виде поверхностной пленки характерен для аэробных микробов. Для факультативно анаэробных бактерий характерен рост с равномерным помутнением среды, цвет которой остается неизмененным или изменяется в соответствии с цветом водорастворимого пигмента, образующегося в культуре микроба. Придонный рост бактерий характеризуется образованием осадка на дне пробирки с жидкой питательной средой и является специфичным для бактерий с анаэробным типом дыхания. Рост на полужидкой питательной среде Для выявления особенностей микробного роста на полужидкой питательной среде исследуемую культуру засевают в столбик 0,2-0,5% полужидкого агара. Подвижные микробы в столбике полужидкого агара вызывают выраженное помутнение, распространяющееся более или менее равномерно по всей толщине среды. Неподвижные формы микробов растут только по ходу прокола среды. Стерилизация (лат. sterilis – бесплодный) – полное уничтожение или удаление микроорганизмов, содержащихся в различных веществах, предметах, пищевых продуктах. В результате стерилизации объект становится свободным от всех микробов, как сапрофитов, так и патогенов. Объекты стерилизации: микробиологическая посуда (пробирки, пипетки, колбы и др), питательные среды для выращивания микробов, отработанные материалы, боксы и помещения в которых ведут работу с микроорганизмами. Дезинфекция – уничтожение патогенных микроорганизмов на объектах внешней среды. Основная цель дезинфекции – не допустить распространения инфекционных заболеваний. Асептика – система профилактических мер, обеспечивающих предупреждение попадания микробов в раны при хирургических вмешательствах. Асептика включает стерилизацию хирургических инструментов, медицинской одежды, перевязочного материала, а также обеззараживание поверхностей операционного стола. Антисептика – комплекс лечебно-профилактических мероприятий, направленных на уничтожение микроорганизмов в ране или в организме в целом, на предупреждение и ликвидацию воспалительного процесса. К антисептическим препаратам относятся: препараты йода (раствор Люголя, йодинол), соединения тяжелых металлов (соли ртути, серебра, цинка), окислители (перекись водорода, перманганат калия), вещества нитрофуранового ряда (фурациллин), кислоты и их соли (борная, салициловая), красители (метиленовый синий, бриллиантовый зеленый), антибиотики. Асептика и антисептика – это разные понятия. Если асептика направлена на недопущение попадания микробов в рану, то антисептика на уничтожение микробов уже попавших в рану. Методы стерилизации: Термические (паровой, воздушный, гласперленовый); Химические (газовый, растворы химических соединений) Радиационный; Плазменный и озоновый; Механическая стерилизация (фильтрующая) Термические методы Стерилизация насыщенным паром под давлением. Стерилизацию паром под давлением осуществляют в специальных герметически закрывающихся аппаратах с толстыми стенками – автоклавах. При автоклавировании происходит полное уничтожение всех видов микроорганизмов и их спор. Споры микроорганизмов погибают в течение 5-10 минут, вегетативные клетки от 1 до 4 минут. Высокая бактерицидная деятельность насыщенного водяного пара под давлением определяется тем, что белки микробной клетки денатурируются, свертываются, в результате происходит их гибель. Стерилизацию в автоклаве проводят при разных режимах. Температура насыщенного пара при разных давлениях
Строение и принцип работы автоклава. Автоклав состоит из стерилизационной камеры, снабженной краном для выхода воздуха, манометром для измерения давления пара, предохранительным клапаном для выхода пара при повышении давления выше необходимого, термометра для измерения температуры внутри камеры. Имеется паровой котел с нагревателем воды. При кипячении воды пар поступает в камеру автоклава. Автоклав герметически закрывают крышкой или дверью с плотной резиновой прокладкой. Автоклавирование проводит специально подготовленный специалист, так как работа по обслуживанию аппарата, работающего под давлением, требует подготовки и строгого соблюдения правил техники безопасности. Стерилизация текучим паром. Стерилизация текучим паром производится в аппарате Коха или в автоклаве при не завинченной крышке и открытом выпускном кране. В текучем паровом аппарате стерилизуют главным образом питательные среды, свойства, которых изменяются при температуре выше 100°С. Стерилизацию текучим паром можно проводить дробно, в этом случае обработку стерилизуемого материала проводят по 30 мин ежедневно в течение 3 дней. В промежутках между стерилизациями материал выдерживают при комнатной температуре для прорастания спор в вегетативные формы, которые погибают в последующих нагреваниях. Тиндализация. Тиндализация – дробная стерилизация с применением температуры ниже 100°С, предложенная в 1877 году Дж.Тиндалем. Метод заключается в дробном нагревании стерилизуемoгo материала в водяной бане, снабженной терморегулятором (как правило в течение 1 часа), кратность от 3 до 5 раз с промежутками в течение 24 час. За это время споры бактерий, выжившие при первой нагревании, прорастают в вегетативные клетки и погибают при последующем нагревании. Тиндализация пользуется для обеспложивания питательных сред, содержащих белок. Стерилизация сухим жаром. Стерилизация сухим жаром производится в печи Пастера. Подготовленный к стерилизации материал кладут на полки так, чтобы он не соприкасался со стенками. Шкаф закрывают и после этого включают обогрев. Продолжительность стерилизации при температуре 150°С 2 ч, при 165°С – 1 ч, при 180°С – 40 мин, при 200°С – 10-15 мин (при 170°С бумага и вата желтеют, а при более высокой температуре обугливаются). Началом стерилизации считается тот момент, когда температура в печи достигнет нужной высоты. По окончании срока стерилизации печь выключают, но дверцы шкафа не открывают до полного охлаждения, так как холодный воздух, поступающий внутрь шкафа, может вызвать образование трещин на горячей посуде. Гласперленовый метод или стерилизация нагретых стеклянных шариков. Принцип метода – стерилизуемые изделия погружаются в среду мелких стеклянных шариков, нагретых до температуры 190–2400С на 5–15 секунд, в зависимости от размера и массы инструмента. Этот метод используется в стоматологии для экспресс-стерилизации мелких инструментов (боров, корневых игл, алмазных головок и др). Химические виды стерилизации. Данный метод применяют для стерилизации изделий, в конструкцию которых входят термолабильные материалы. Для стерилизации растворами химических средств используют альдегид содержащие средства, перекись водорода 6%, дезоксон 1 – 1% раствор и др. Стерилизацию проводят при полном погружении изделий в раствор, свободно их раскладывая. При большой длине изделия его укладывают по спирали. Разъемные изделия стерилизуют в разобранном виде. Каналы и полости заполняют раствором. Во избежание разбавления рабочих растворов, используемых для стерилизации, погружаемые в них изделия должны быть сухими. После стерилизации изделия извлекают из раствора с помощью стерильных пинцетов (корнцангов), удаляют раствор из каналов и полостей, а затем промывают в стерильной жидкости, налитой в стерильные емкости, согласно рекомендациям методического документа по применению конкретного средства. Промытые стерильные изделия после удаления остатков жидкости из каналов и полостей используют сразу по назначению или помещают (с помощью стерильных пинцетов, корнцангов) на хранение в стерильную стерилизационную коробку. Газовая стерилизация. Газовую стерилизацию применяют для обеспложивания объектов, которые нельзя подвергать термической обработке. Это хирургические инструменты, имеющие зеркальные поверхности, оптическое и радиоэлектронное оборудование, режущие и колющие инструменты с микронной заточкой, кетгут, предметы одноразового пользования и различные изделия из термонеустойчивых синтетических пластмасс (зонды, катетеры и др.), не выдерживающие паровую, воздушную и химическую (с помощью растворов) стерилизацию. Иногда газовую стерилизацию применяют и для стерилизации некоторых термостойких предметов. Для газового метода используют: окись этилена (оксид этилена), метил-бромид и их смеси (ОБ, ОКЭБМ), формальдегид и др. Плазменная стерилизация. Принцип этого метода стерилизации состоит в том, что стерилизуемый материал обрабатывают парами пероксида водорода и его плазмой от 36°С до 60°С. Данный метод стерилизации применяют как альтернативу газовой стерилизации окисью этилена и стерилизации в парах формальдегида. В плазменном стерилизаторе можно стерилизовать практически всю номенклатуру инструментов и изделий медицинского назначения, Плазменная стерилизация инструментов с тонкими и острыми рабочими частями позволяет уменьшить их износ и сохранить работоспособность на более длительный срок по сравнению с инструментами, стерилизуемыми в автоклавах. Использование этого метода дает возможность стерилизовать внутренние поверхности каналов медицинских изделий, например эндоскопов, диаметром до 1 мм и длиной до 3000 мм. Плазменная стерилизация не вредит окружающей среде, поскольку перекись водорода после использования распадается на нетоксичные составляющие (кислород и воду). Озоновая стерилизация. Озон является сильным окислителем и сильным природным дезинфектантом. Стерилизация производится в специальных аппаратах с озоно-воздушной смесью, озон синтезируется из воздуха в газоразрядном реакторе. Преимущество озоновой стерилизации заключается в низкотемпературном режиме (температура 40°С) и короткого времени экспозиции, используется для стерилизации хирургических инструментов. Радиационная(лучевая) стерилизация – это физический процесс, связанный с облучением изделий медицинского назначения ионизирующим излучением. Используется для стерилизации термолабильных материалов. Изделия облучают на специализированных радиационно-технологических установках с использованием источников γ-излучения и β-излучения. При правильном проведении радиационная стерилизация является безопасным и надежным промышленным процессом. Механическая стерилизация (фильтрование). Этот метод применяют для обработки сред, компоненты который легко разлагаются при нагревании. Принцип метода состоит в пропускании стерилизуемого материала через бактериальные фильтры, при этом происходит механическое задерживание клеток микроорганизмов и адсорбция их в порах фильтра. Вирусы бактериальными фильтрами не задерживаются, и поэтому ультрафильтрацию нельзя рассматривать как стерилизацию в принятом значении этого слова. В микробиологической практике часто используют асбестовые фильтры (фильтры Зейтца, Шамберлана). Фильтры Зейтца представляют собой асбестовые пластинки толщиной 3–5 мм и диаметром 35 и 140 мм для фильтрации малых и больших объемов жидкости. Перед употреблением асбестовые фильтры монтируют в фильтровальные аппараты и вместе с ними стерилизуют в автоклаве. Асбестовые фильтры используются однократно. Мембранные ультрафильтры изготавливают из нитроклетчатки и представляют собой диски белого цвета диаметром 35 мм и толщиной 0,1 мм. Бактериальные фильтры различаются по величине пор и обозначаются порядковыми номерами. Непосредственно перед употреблением мембранные фильтры стерилизуют кипячением. Виды дезинфекции: - профилактическая, которая проводится регулярно, независимо от наличия инфекционного очага: мытье рук, уборка окружающих поверхностей с применением чистящих и моющих средств, имеющих в составе бактерицидные добавки; - текущая, которую проводят у постели заболевшего, в лечебных учреждениях, в изоляторах медпунктов, чтобы не допустить распространение инфекции; - заключительная, которую производят после госпитализации больного, изоляции, выздоровления либо смерти больного для освобождения эпидемического очага от рассеянных им возбудителей. Современная дезинфектология различает три уровня дезинфекции в зависимости от количества и вида уничтожаемых микроорганизмов. Дезинфекция высокого уровня (ДВУ) - уничтожение вегетативных форм микроорганизмов, микобактерий туберкулеза и мелких простых вирусов, некоторого количества споровых форм микробов. Дезинфекция среднего уровня (ДСУ) - уничтожение вегетативных форм микроорганизмов, микобактерий туберкулеза и мелких нелипидных вирусов. Дезинфекция низкого уровня (ДНУ) - уничтожение вегетативных форм микроорганизмов, кроме микобактерий туберкулеза. Методы дезинфекции: Механический – основу механического метода составляют: чистка предметов, влажная уборка, стирка, фильтрация, вентиляция и др. Этими методами можно освободить объекты от пыли и грязи и вместе с последними от значительного количества микробов. Так, с помощью пылесоса вместе с пылью удаляется до 98% микробов. При проветривании помещения в течение 15 минут резко уменьшается количество микробов. Хорошие результаты дает кондиционирование воздуха. При помощи кондиционера в помещение подается воздух определенной температуры и влажности. Достоинством механического метода дезинфекции является его простота и доступность для выполнения, однако этим методом можно лишь снизить микробную контаминацию объекта, но полного обеззараживания достичь невозможно. Физический – воздействие ультрафиолетом, высокими или низкими температурами. Целесообразность и надежность метода происходит в случае точного соблюдения режима и экспозиции времени. Ультрафиолетовое облучение применяют для обеззараживания воздуха помещений инфекционных стационаров, детских больниц, родильных домов, операционных, боксов и других помещений в целях предупреждения возникновения внутрибольничных заражений. Облучение может освободить от патогенных микроорганизмов воздух и снизить обсемененность его другими микроорганизмами на 80–90%. Химический – в основе лежит разрушение токсинов и уничтожение болезнетворных микроорганизмов с помощью химических веществ, которые оказывают на микроорганизмы бактерицидное, спороцидное и фунгицидное действие. Для дезинфекции используют вещества, различающиеся по механизму действия. Чаще всего используют окислители, галоидные препараты (например, хлорсодержащие),спирты (этанол, изопропанол, пропанол) и альдегиды, катионные поверхностно-активные вещества (четвертичные аммониевые соединения). Биологический – данный метод основывается на антагонистическом действии между разными микроорганизмами, а также действии средств биологической природы. Используется при очистке сточных вод, на биологических станциях. Бактерицидные облучатели предназначены для обеззараживания воздуха в медицинских центрах, детских и спортивных учреждениях, производственных цехах. В пищевой промышленности проводят обеззараживание продуктов и тары. Бактерицидные облучатели бывают открытого, закрытого и комбинированного типа. Открытый тип используют исключительно в отсутствии людей. Закрытый тип применяют в присутствии людей и животных, в обрабатываемом помещении. Основные методы стерилизации
Основные методы дезинфекции
Оформление лабораторной тетради. Описать морфологию колонии, дать характеристику методам стерилизации, заполнить табл. Зарисовать кривую роста и размножения бактериальной популяции, обозначить и охарактеризовать основные периоды на кривой. Контрольные вопросы по теме занятия: Что обозначает термин «стерилизация»? Перечислите методы стерилизации. От чего зависит выбор метода? В чем состоит отличие стерилизации от дезинфекции? Охарактеризуйте устройство и принцип работы автоклава. На чем основана тиндализация? Какие материалы и как стерилизуют фильтрованием? Почему необходимо, чтобы среды были стерильными? Какие материалы можно стерилизовать дробными методами теплового воздействия? Почему при дробных методах стерилизации материал оставляют на сутки не в холодильнике, а в термостате? Дайте определение асептики, антисептики. Тесты: 1.Культивирование микроорганизмов в замкнутой системе без дополнительного внесения субстратов и удаления продуктов обмена называют _______________ культивированием. а) периодическим б) непрерывным в) проточным г) хемостатным 2. Для получения плотных питательных сред к жидким средам добавляют уплотнитель, в качестве которого используют… а) агар-агар б) желатин в) казеин г) дрожжевой экстракт 3. На плотных питательных средах бактерии растут, образуя … а) осадок б) колонии в) пленку г) пятна 4. Для стерилизации материалов, не переносящих повышенные температуры, используют метод … а) фильтрования б) прокаливания в) фламбирования г) дробной стерилизации 5. Для стерилизации перевязочного материала применяют … а) пастерилизацию б) тиндализацию в) автоклавирование г) фильтрование 6. Комплекс мер по обработке помещений с целью уничтожения возбудителей инфекционных заболеваний человека и животных с применением антимикробных средств, называется … а) дезинфекцией б) антисептикой в) дезинсекцией г) дератизацией 7. Химические вещества, применяемые для воздействия на микроорганизмы, контактирующие с поверхностью кожных покровов, слизистых оболочек и соприкасающихся с ними тканей (раны, полости тела), обладающие антимикробным действием, называются … а) антибиотиками б) антисептиками в) фитонцидами г) фитогормонами 8. Способ уничтожения вегетативных форм микроорганизмов в пищевых продуктах путем однократного и непродолжительного нагревания при 60-80°С в течение 10-40 минут, относится к … а) автоклавированию б) кипячению в) пастеризации г) тиндализации |
