Медицинская микробиология и вирусология ч1 (1). Т. П. Гажеева, Т. Х. Гордеева, Е. И. Хорошавина Медицинская микробиология и вирусология Часть 1
 Скачать 5.4 Mb. Скачать 5.4 Mb.
|
ЗАНЯТИЕ 7. Физиология бактерий. Питание микроорганизмов. Питательные среды. Методы культивирования бактерий. Выделение чистой культуры.Цель занятия: Оценить разнообразие типов питания и потребностей в питательных веществах микроорганизмами. Ознакомиться с основными и наиболее часто употребляемыми питательными средами, методами их приготовления. Материалы и оборудование: сухой агар, сухой пептон, чашки Петри с МПА, чашки Петри с голодным агаром, скошенный агар в пробирках, «столбики», смесь микроорганизмов в МПБ, красители для окраски по Граму, спирт, дистиллированная вода в колбах, спиртовки, предметные стекла, пастеровские пипетки, градуированные пипетки, фильтровальная бумага, спички. Демонстрационные препараты и таблицы: рост кишечной палочки на среде Эндо, рост стафилококка на среде Чистовича. Выделение чистой культуры аэробов. План занятия Источники питания микроорганизмов. Типы питания в зависимости от источника энергии, углерода и природы окисляемого субстрата. Механизмы проникновения питательных веществ через оболочку бактерий: пассивный и активный транспорт. Питательные среды, их классификация, этапы приготовления. Требования, предъявляемые к питательным средам. Понятие о чистой культуре. Выделение чистой культуры аэробных микроорганизмов. Задание: Познакомиться с основными питательными средами. Записать схему их классификации по происхождению, консистенции, составу, назначению. Посмотреть и зарисовать демонстрационные посевы культур различных микроорганизмов на элективных питательных средах. Сделать пересев микроорганизмов: А) с плотной среды на плотную; Б) с плотной на жидкую; В) с жидкой на жидкую. Познакомиться со схемой выделения чистой культуры микроорганизмов. Начать выделение чистой культуры (1 этап): А) из исследуемого материала для предварительного ознакомления с микроорганизмами смеси приготовить мазок, покрасить по Граму, промикроскопировать и зарисовать. Б) исследуемый материал посеять на чашку Петри с МПА по секторам для получения изолированных колоний. Методические рекомендации к практическому занятию: Техника посева культуры микроорганизмов на питательные среды. Посев из пробирки в пробирку. Пробирку с посевным материалом и пробирку со средой держат слегка наклонно в левой руке между большим и указательным пальцами так, чтобы края пробирок были на одном уровне, а их основания находились поверх кисти. В правой руке, как ручку или карандаш, держат бактериальную петлю. Петлю вертикально прокаливают в пламени горелки до покраснения (стерилизуют). Пробки из пробирок вынимают правой рукой, зажимая их между мизинцем и ладонью. Извлекают пробки не рывком, а плавно – легкими винтовыми движениями. Вынув пробки, края пробирок сразу же обжигают в пламени горелки. Прокаленную петлю вводят через пламя горелки в пробирку с посевным материалом, охлаждают и, набрав небольшое количество посевного материала, осторожно переносят в пробирку со средой. 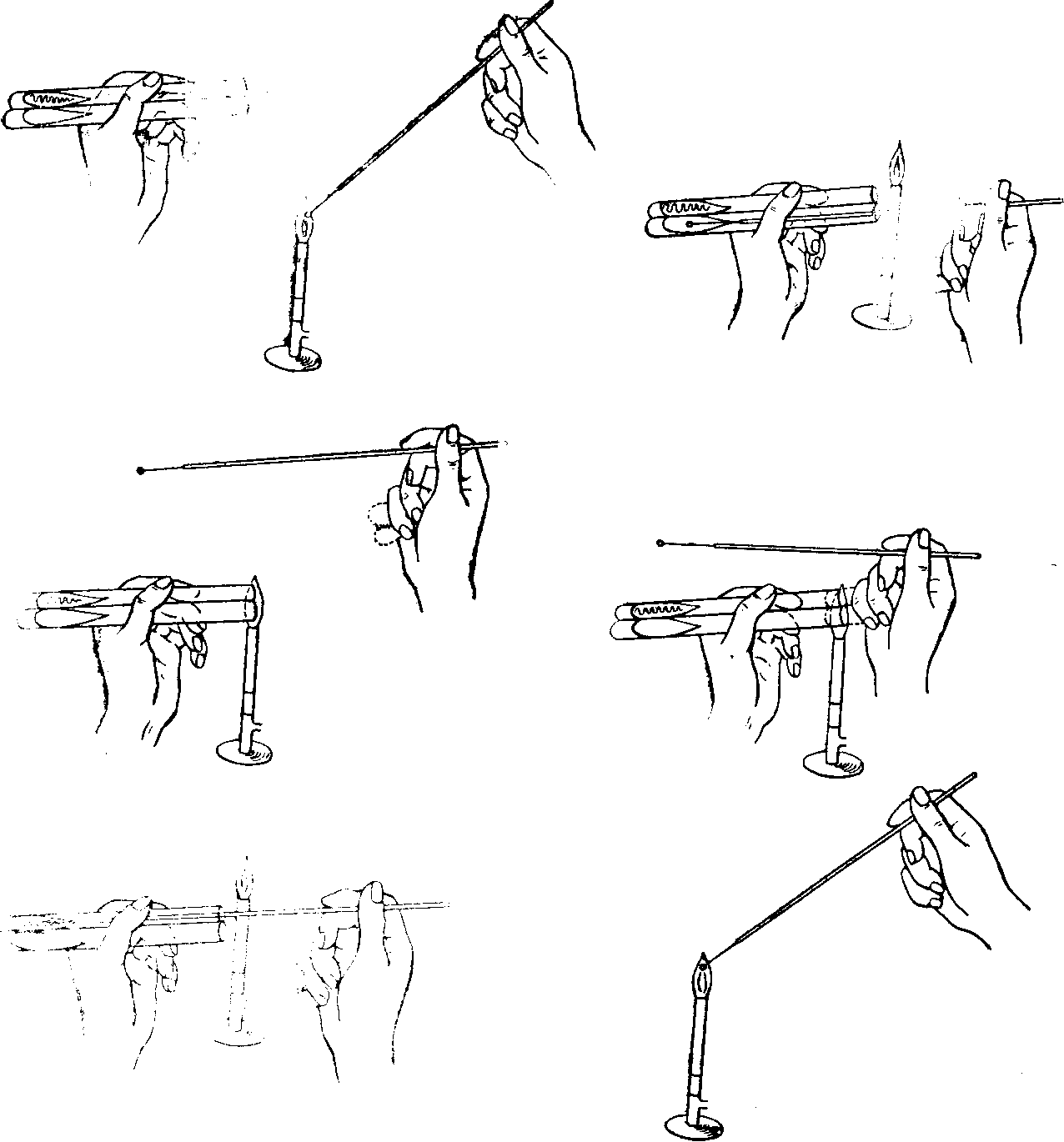 Рис. 1 Схема пересева микроорганизмов из пробирки в пробирку. При посеве на скошенный агар посевной материал растирают на поверхности среды зигзагообразными движениями снизу вверх, начиная от границы конденсационной воды. Посев уколом производят на агаровые и желатиновые среды, разлитые в пробирки «столбиком». Петлей с посевным материалом прокалывают столбик до дна. После посева петлю извлекают из пробирки, края пробирок обжигают и, проводя пробки через пламя горелки, пробирки закрывают, а петлю прокаливают. Посев жидкого материала производят стерильными пастеровскими или градуированными пипетками. Кроме того, для посева можно использовать тампон с исследуемым материалом. При посеве на жидкие среды тампон погружают в среду и несколько секунд ополаскивают в ней. При посеве на плотные среды материал с тампоном тщательно втирают в поверхность среды, вращая тампон. Посев на пробирки с чашки Петри. Чашку с посевным материалом ставят перед собой крышкой вверх. Большим и указательным пальцами левой руки слегка приоткрывают крышку и вводят под нее обожженную петлю. Набрав посевной материал, петлю вынимают из чашки и закрывают крышку. В левую руку берут пробирку со средой. Посев производят так же, как с пробирки на пробирку. После посева чашку поворачивают вверх дном. 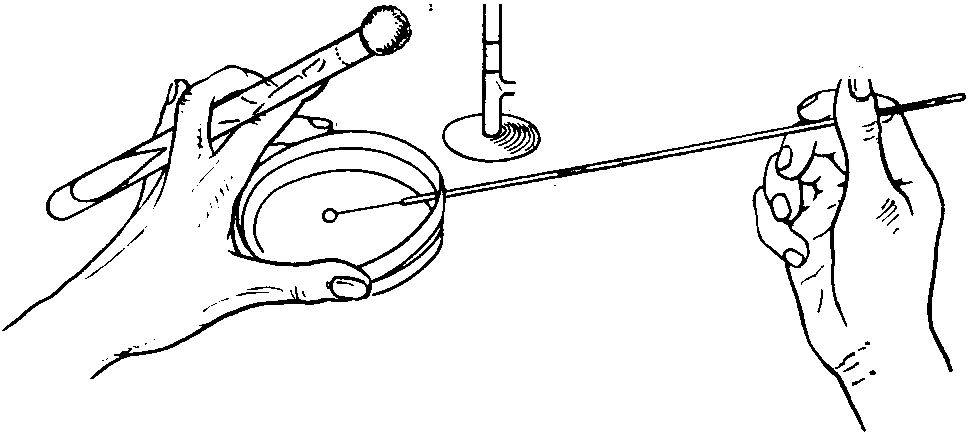 Рис. 2 Посев микроорганизмов на чашку Петри с питательной средой Посев шпателем на чашку Петри с агаром. Шпатель – это стеклянная или металлическая палочка или трубка, конец которой загнут в виде треугольника. Левой рукой слегка приоткрывают крышку. Петлей, пипеткой или стеклянной палочкой наносят на поверхность среды посевной материал и тщательно втирают его круговыми движениями шпателя до тех пор пока шпатель не перестанет свободно скользить по поверхности агара. Левой рукой при этом придерживают крышку и одновременно вращают чашку. По окончании посева шпатель вынимают из чашки и закрывают чашку. Стеклянный шпатель опускают в дезинфицирующий раствор, а металлический прокаливают в пламени горелки. Засеянную чашку поворачивают дном вверх. Посев петлей на чашки Петри с агаром. Небольшое количество посевного материала втирают петлей в поверхность среды у края чашки несколько раз, проводя петлей из стороны в сторону. После этого у места, где закончились штрихи, агар прокалывают петлей, снимая избыток посевного материала. Зигзагообразным движением распределяют оставшийся на петле посевной материал по всей поверхности чашки. По окончании посева закрывают чашку и прожигают петлю. Посев на секторы. Чашку со стороны дна расчерчивают на секторы. Посев производят зигзагообразными движениями от края чашки к центру. При этом необходимо следить, чтобы штрихи не заходили на соседний сектор. Чашку закрывают и прожигают петлю. 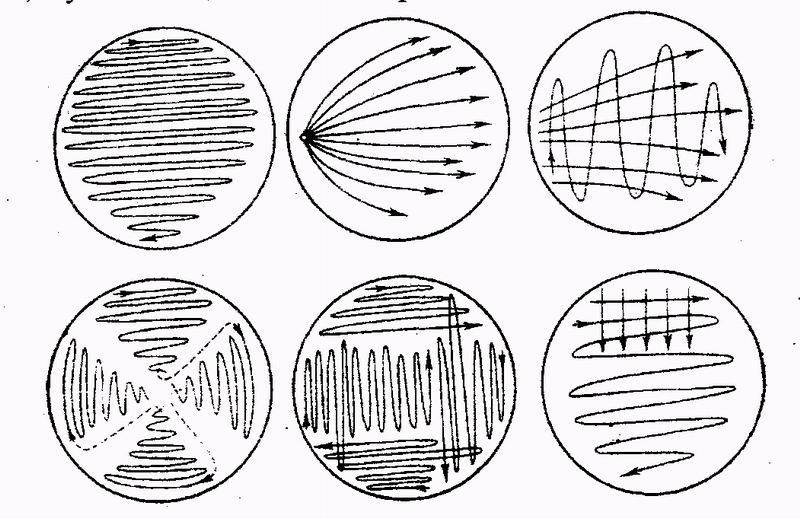 Рис. 3. Посев на сектора Посев на агаровые среды газоном. Примерно 1 мл жидкой культуры (если культура выращена на плотной среде, ее эмульгируют в физиологической растворе или бульоне) наносят пипеткой на поверхность агара и тщательно распределяют жидкость на поверхности среды. Чашку слегка наклоняют и пипеткой через грушу отсасывают избыток культуры, выливая его в дезинфицирующий раствор. Туда же помещают и пипетку. Глубинный посев (в толщу плотной среды). Культуру, выращенную в жидкой среде или взвесь микроорганизмов вносят в склянку с растопленной и остуженной до 450 агаровой среды, перемешивают и выливают в стерильную чашку Петри. После застывания агара чашки поворачивают дном вверх. До посева в толщу агара можно внести посевной материал в пустую стерильную чашку Петри и залить 15-20 мл остуженного до 450 агара. Для перемешивания содержимого чашки ее слегка поворачивают или вращают. После застывания среды чашку поворачивают дном вверх. Посев во флаконы, колбы, матрацы и бутыли производят примерно так же, как в пробирки, только сначала набирают посевной материал, а потом открывают пробку в сосуде со средой. После посева чашки, флаконы и др. сосуды подписывают, пробирки в верхней части, чашки со стороны дна. Выделение чистых культур. Чистой культурой называют популяцию клеток, состоящую из микроорганизмов одного вида, которая получена как потомство одной клетки (клон). Выделение чистой культуры микробов является обязательным этапом любого бактериологического исследования. Все способы выделения чистых культур микроорганизмов основаны на получении из смеси на плотной питательной среде изолированных колоний. Чаще других используется метод пластинчатых культур Р.Коха, иначе называемый чашечным или истощающего посева. Сущность этого метода: культуру аэробных микроорганизмов высевают на поверхность агара. Рассев проводят петлей или шпателем (рис4) 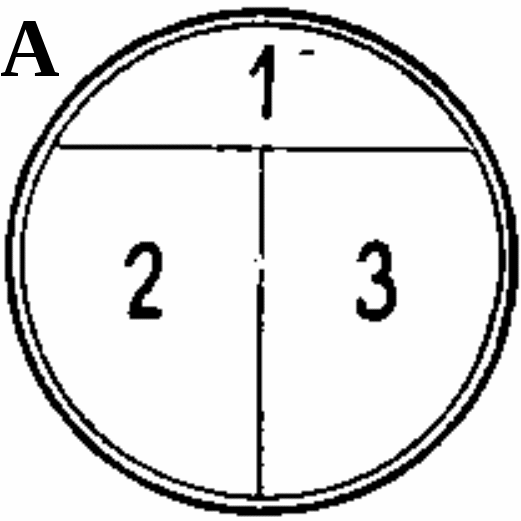 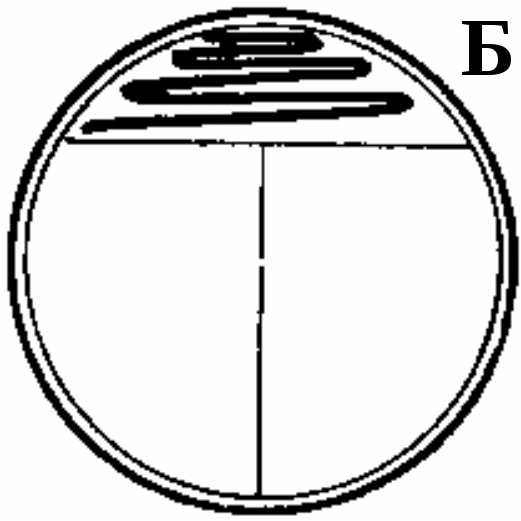 В 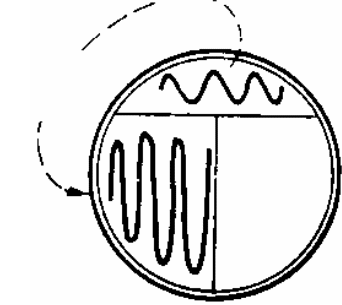 Г Г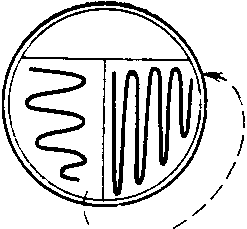 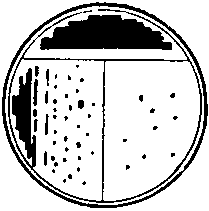 Д ДРис.4 Техника посева смешанной культуры микроорганизмов на плотную питательную среду. А. Обратную сторону чашки Петри карандашом разделяют на 3 сектора (можно на 6), Б. Петлей с культурой зигзагом наносят штрихи на поверхности агара в секторе 1, как показано на рисунке. Для этого крышку чашки сначала приподнимают, а после нанесения штриха сразу закрывают. В. Проводят петлей по поверхности среды в секторе 1, как показано на рисунке, и затем немедленно наносят ею зигзагом штрихи на поверхности среды в секторе 2. Г. Проводят петлей по поверхности среды в секторе 2, как показано, и затем наносят ею зигзагом штрихи на поверхности среды в секторе 3. Д. Инкубируют опрокинутые вверх дном чашки, для того чтобы конденсирую конденсирующаяся вода с крышки не попала на поверхность агара. В секторе 1 отмечается сплошной рост, тогда как в секторах 2 и 3 появляются отдельные изолированные колонии. Отбирают изолированные колонии и высевают их на «скошенный» агар. Для микроорганизмов, растущих на жидких средах, можно использовать метод предельного разведения, последовательно перенося клетки в отдельные пробирки с жидкой средой. Изолированные колонии микроорганизмов, относящихся к факультативным анаэробам, чаще получают при глубинном посеве. Иногда достаточно одного посева на плотную питательную среду, чтобы получить чистую культуру. Однако чаще посев повторяют два-три раза. В качестве посевного материала при этом используют культуру, полученную из отдельной колонии. Схема выделения и идентификации чистой культуры аэробов. Первый этап. Исследуемый материал (почва, гной, мокрота и др.) засевают на чашки Петри с питательной средой методом истощающего штриха (рис 4). Чашки помещают в термостат на 37С крышками вниз. Продолжительность культивирования – 1–2 суток. Второй этап. Описывают и отсевают выросшие колонии. При этом следует выбирать изолированные колонии. При описании колоний чашки Петри не открывать. Признаки колоний записывают в таблице. После этого отсеивают изолированную колонию в пробирку на поверхность скошенного агара и ставят в термостат на 30С на 1–2 суток. Третий этап. Проверка чистоты выделенных культур. Чистоту выделенных культур проверяют визуально и микроскопированием. Визуальный контроль. Просматривают рост по штриху на скошенной агаризованной среде. Для дальнейшей работы оставляют культуры, рост которых однороден по всему штриху. Если рост культуры по штриху неоднороден, культуру считают загрязненной и отбрасывают. Микроскопический контроль. Готовят препараты фиксированных окрашенных клеток или препараты живых клеток. Чистые культуры морфологически однородны, допустимо лишь некоторое варьирование размеров клеток. Рассев на плотную среду. Это наиболее надежный способ проверки чистоты культур. Культуру пересевают в пробирку со свежей агаровой средой. Затем готовят суспензию культуры смывом стерильной водопроводной водой. Полученную суспензию можно использовать для микроскопического контроля. Чистая культура характеризуется однородностью клеток и колоний. Четвертый этап. Идентификация выделенной чистой культуры. Проводят по морфологическим, культуральным, биохимическим признакам, антигенной структуре, факторам патогенности, чувствительности к бактериофагам (фаготипирование). Определяют чувствительность к антибиотикам. Примечание: При наличии небольшого числа микроорганизмов в исследуемом материале, предварительно производят посев на среды обогащения. Контрольные вопросы по теме занятия: На чем основано разделение микроорганизмов на автотрофы и гетеротрофы, хемотрофы и фототрофы, органотрофы и литотрофы? Какие микроорганизмы называют прототрофами и ауксотрофами? Каковы основные требования, предъявляются к питательным средам? Приведите примеры питательных сред и рост на них различных микроорганизмов. Какие питательные среды называют элективными и дифференциально-диагностическими? Какие культуры бактерий называют чистыми? Оформление лабораторной тетради. Записать схему классификации питательных сред, зарисовать схему выделения чистых культур аэробов, зарисовать приготовленные на занятии мазки. |
