Электрохимия. Вопросы коллоквиума к разделу Электрохимия Основные положения теории электролитической диссоциации
 Скачать 6.64 Mb. Скачать 6.64 Mb.
|
|
Энергия активизации – энергия, представляющая собой минимальную энергию, достаточную для осуществления акта химической реакции. Основные уравнения электрохимической кинетики 1-й закон Фарадея устанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества. Δm = kэ*Jt = kэ*q, где Δm – количество прореагировавшего вещества; k – коэффициент пропорциональности; q – количество электричества, равное произведению силы тока I на время t. Если q = Jt = 1, то Δm = kэ – количество вещества, прореагировавшего в результате протекания единицы количества электричества. kэ – электрохимический эквивалент. 2-й закон Фарадея устанавливает связь между количеством прореагировавшего вещества при пропускании данного количества электричества и его природой. По этому закону, при постоянном количестве прошедшего электричества массы прореагировавших веществ относятся между собой, как их химические эквиваленты А: Если количество электричества равно F, числу Фарадея, то Δm1 = F*kэ1 = A1, F*kэ при q = 1F, то Уравнение (3) позволяет объединить оба закона Фарадея в виде одного общего закона, по которому количество электричества (1F = 96500k) всегда изменяет электрохимически массу любого вещества, независимо от его природы. Законы Фарадея – основные законы электролиза, согласно которых, количество вещества, выделившегося при электролизе, прямо пропорционально его химическому эквиваленту и количеству прошедшего электричества. Уравнение Нернста Е0 – равновесный стандартный потенциал. где С0 – стандартная концентрация раствора; С – любая концентрация в нестандартных условиях, С = С0 x Е = Е0 , т. е. в стандартных условиях С = C0 = 1 моль. Для окислительных веществ 1-й закон Фика: где dc/dx – градиент концентрации; s – площадь, через которую происходит диффузия. Δ – коэффициент диффузии cм² *c־¹, показывает число частиц, продиффундировавших за 1 с через поперечное сечение раствора площадью 1 см², dt – время диффузии, dm – число продиффундировавших частиц. где Тк – коэффициент внутреннего трения; D – коэффициент диффузии. Первый закон Фика относится к процессу стационарной диффузии, сходен с закономерностями переноса тепла из электричества. Если диффузионный поток не изменяется с течением времени, это называется стационарной диффузией. Диффузия – самопроизвольно протекающий в системе процесс выравнивания концентрации молекул, ионов, частиц под влиянием теплового хаотического движения. Основное уравнение электрохимической кинетики ik = ia = i0, где i0 – ток обмена, (окислительно-восстановительные реакции). При катодной поляризации на электроде через систему протекает ik преимущественно, если поляризация не слишком велика, то суммарная скорость процесса равна: i = ik – ia, для реакции (1) катодные и анодные токи будут равны: 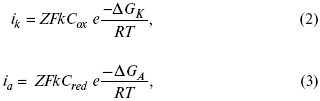 где Z – количество электронов, участвующих в реакции; F – число Фарадея; к – const скорости; Сox, Cred – концентрация окислительной и восстановленной форм реагентов; ΔGK – энергия активации катодного процесса; ΔGA – энергия активации анодного процесса. Энергия активации зависит от величины накладываемого потенциала, в то же самое время эта энергия распределяется между прямой и обратной реакцией в соответствии с коэффициентом переноса – а, т. е. υ = υпр – υоб. Коэффициент переноса α– доля энергии электрического поля в ДЭС, которая приходится на прямую и обратную реакции. α– коэффициент переноса для катодной реакции; (1 – α) – для анодного процесса (коэффициент переноса). ΔGk = ZFE α, (4) ΔGA = ZFE(1 – α) (5) С учетом уравнений (4), (5) уравнения (2), (3) примут следующий вид: 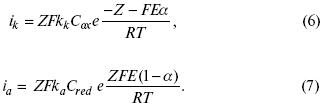 Различие знаков у электрона объясняется тем, что катодная поляризация («–») ускоряет прямую реакцию и замедляет обратную реакцию. 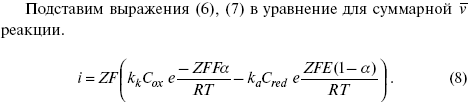 Введем в уравнение (8) плотность тока обмена – i0. Вместо потенциала введем перенапряжение: Вывод из уравнения (10): при равновесном потенциале, когда ток равен нулю, уравнение (10) преобразуется в уравнение Нернста: при малых величинах η: 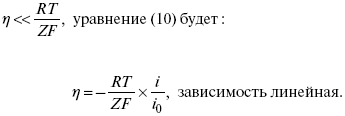 При сдвижении потенциала от равновесного (59 mВ); 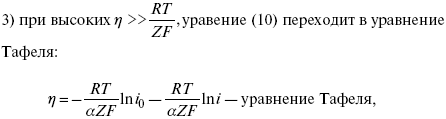 η = a + b lni– уравнение Тафеля в простом виде при замедлении стадии переноса заряда. Величина i0 (тока обмена) и α(коэффициента переноса) – основные кинетические параметры стадии переноса заряда (q). Они могут быть определены из экспериментальных измерений, для этого на исследуемом электроде снимают зависимость η– i или Ei – i. Поляризационная кривая судит о коррозионной стойкости металлов. Перенапряжение Термин «перенапряжение» относится не к электроду, а к процессу. Величину перенапряжения обозначают буквой Ƞ 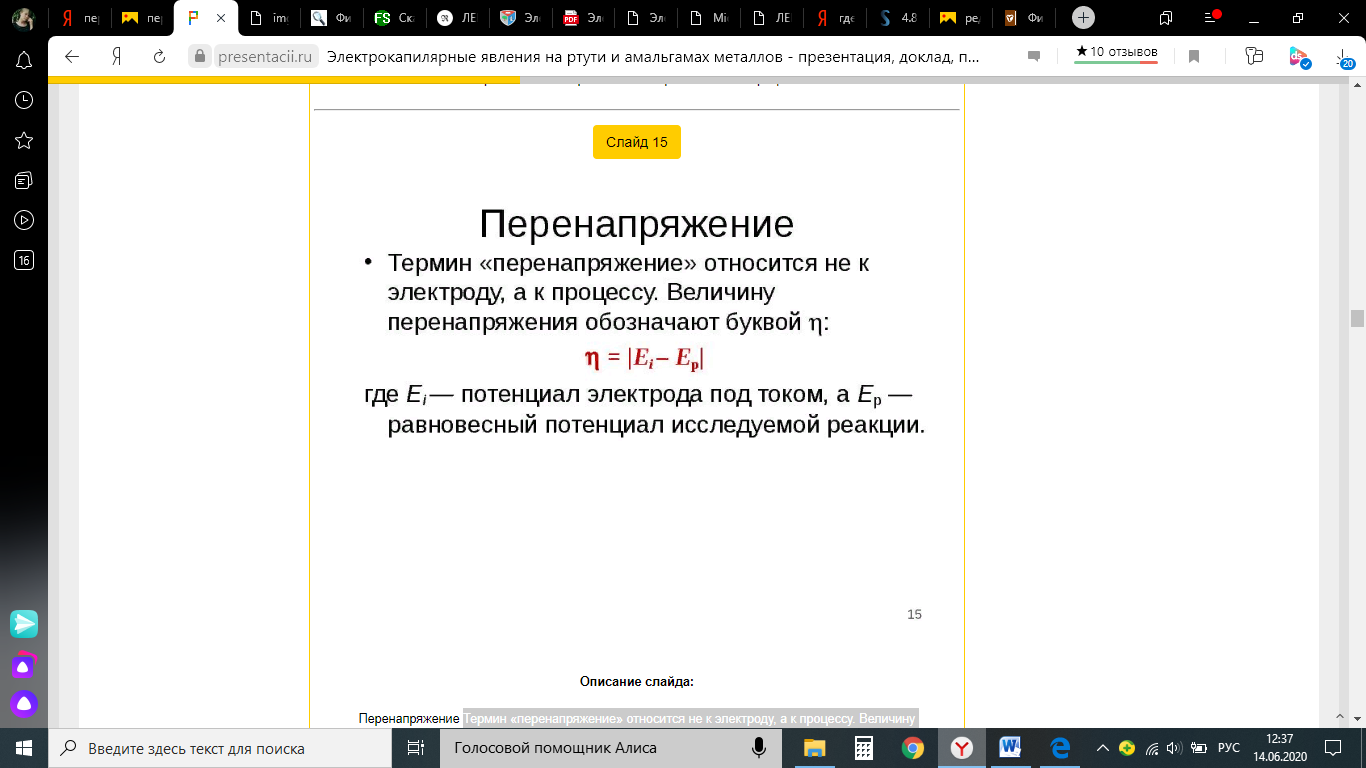 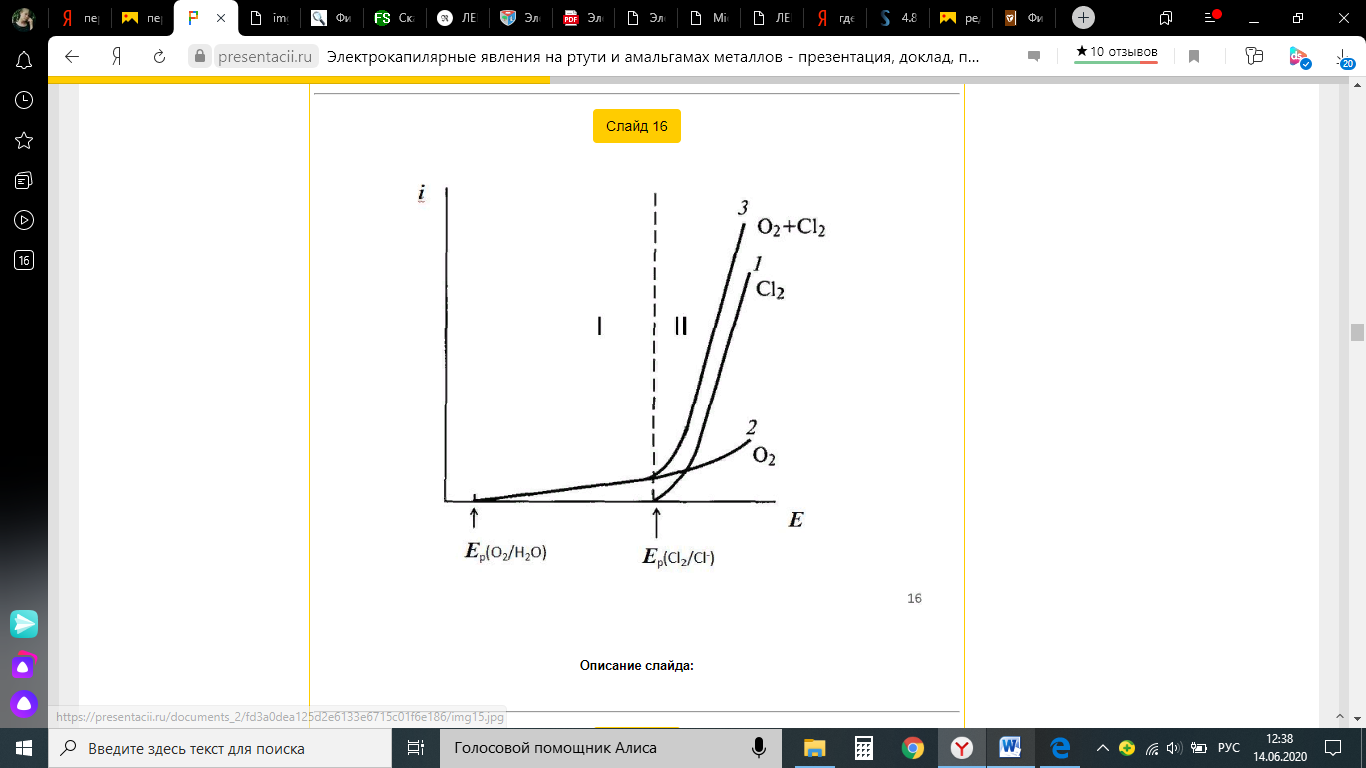 В соответствии с возможным характером элементарных стадий рассматривают несколько видов перенапряжения. Диффузионное перенапряжение Ƞдиф- вид перенапряжения, связанный с торможением подвода реагентов к электроду или отвода продуктов реакции; Электрохимическое перенапряжение Ƞэл - вид перенапряжения, связанный со стадией замедленного (то есть имеющего конечную скорость) перехода электронов от электрода к реагирующей частице или от реагирующей частицы к электроду. Используются также термины перенапряжение перехода, активационное перенапряжение и перенапряжение разряда. Перенапряжение химической реакции Ƞхим - вид перенапряжения, обусловленный конечной скоростью химической реакции, которая может быть одной из стадий сложного электродного процесса. Примером может служить образование молекул адсорбированного водорода H2(ad): 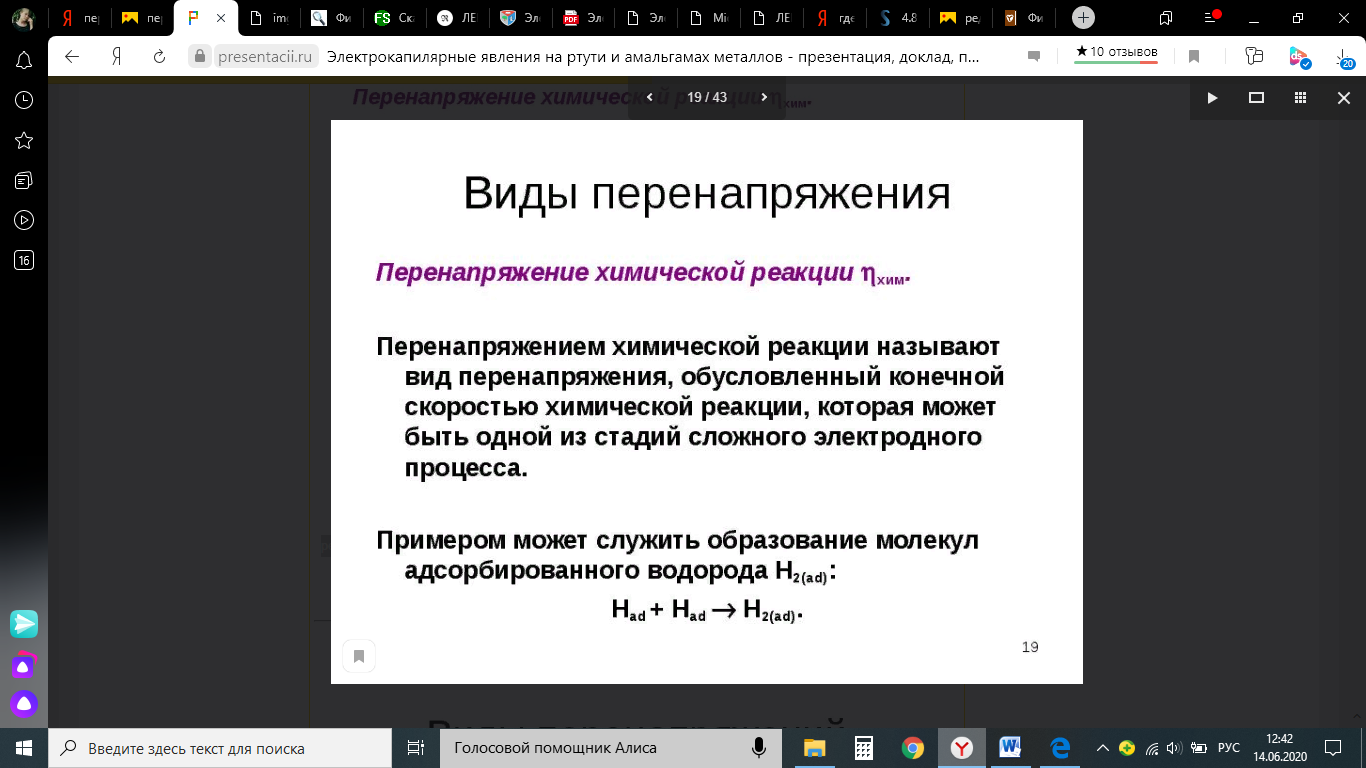 Фазовое перенапряжение Ƞфаз- вид перенапряжения, связанный с торможением сложной электродной реакции на стадии образования новой или разрушения старой фазы. Пример: десорбция H2(ad) с поверхности электрода и образование газовой фазы H2(г): 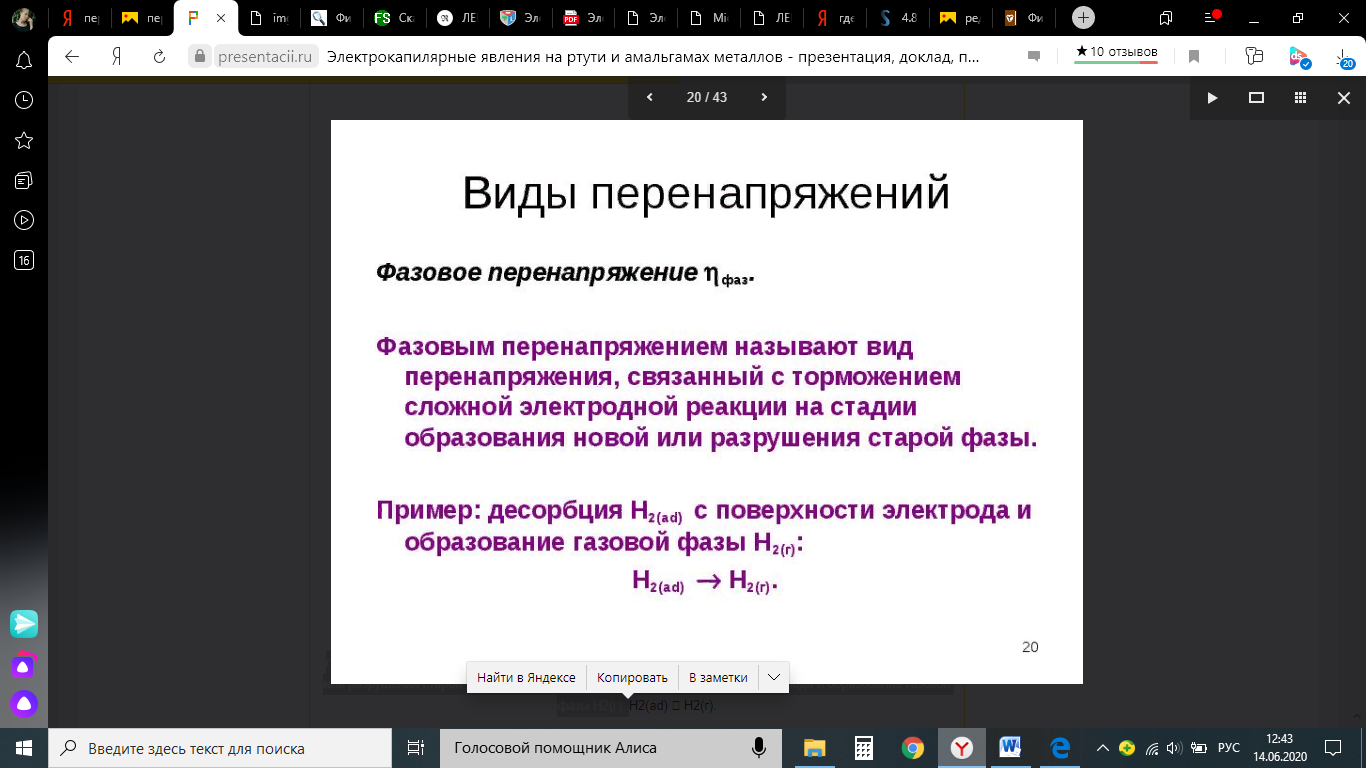 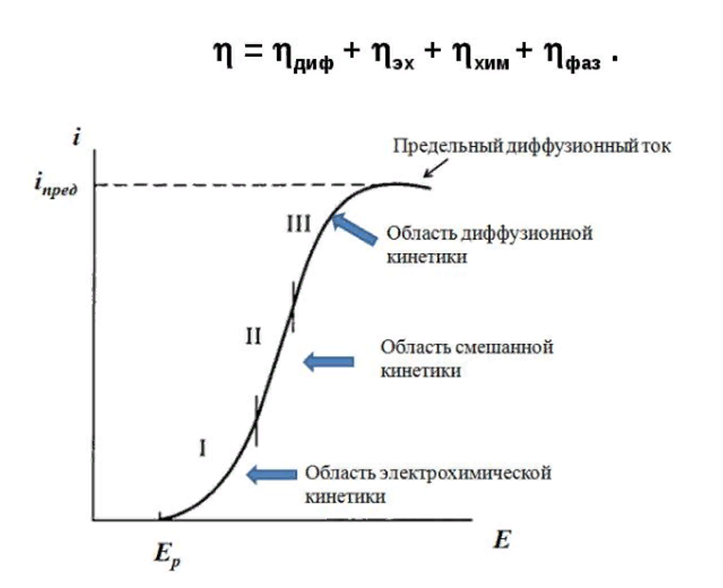 4)Уравнение Тафеля Уже в 1905 г. Тафель эмпирически вывел уравнение, которое связывает перенапряжение с плотностью тока, проходящего через раствор, т.е. со скоростью электрохимического процесса : Ƞ = а + b lgi, Ƞ– перенапряжение, В; a и b – константы; i – плотность тока, А/см². Смысл величины а : а дает значение перенапряжения при i = 1 А/см². Величина а существенно зависит от материала электрода. Величина b мало зависит от материала электрода и является характеристикой самого электрохимического процесса; в большинстве случаев она приблизительно равна 2×2,303RT/zF , т.е. 0,116 В при z = 1 и комнатной температуре. Это значит, что при увеличении плотности тока в 10 раз Ƞ увеличивается на 0,116 В. Однако величина b в ряде случаев может составлять и 0,030 В. Формула Тафеля соответствует опыту в очень широком интервале величин i; при очень малых i она, естественно, неприменима. В области малых отклонений от равновесного потенциала наблюдается линейная связь между Ƞ и i : Ƞ = R* i. |
