Электрохимия. Вопросы коллоквиума к разделу Электрохимия Основные положения теории электролитической диссоциации
 Скачать 6.64 Mb. Скачать 6.64 Mb.
|
|
Методы измерения ЭДС. Зависимость ЭДС от температуры. Компенсационный метод измерения ЭДС   С достаточной степенью точности ЭДС гальванического элемента может быть измерена и с помощью высокоомного вольтметра, имеющего большое внутреннее сопротивление. Вследствие высокого омического сопротивления сила тока, протекающего через элемент, чрезвычайно мала, поэтому создаются условия для протекания обратимых процессов, а разница между ЭДС и напряжением элемента незначительна. Зависимость ЭДС от температуры К электрохимическим цепям, находящимся при постоянном давлении применимо уравнение Гиббса-Гельмгольца 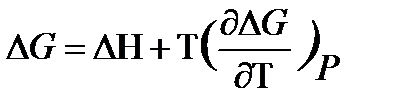 , ,где ∆H-изменение энтальпии в ходе химической реакции. Если ОВР(окислительно-восстановительная реакция) является итогом электродных процессов в электрохимической цепи и соответствует прохождению через цепь n электронов, то разделив все члены уравнения 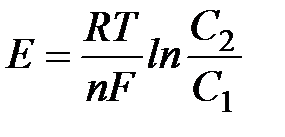 на nF и поменяв знаки, с учетом соотношения 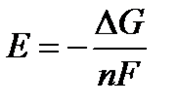 получаем выражение 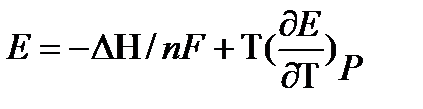 , ,где величина Так как 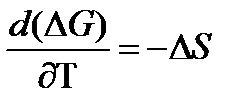 , ,то 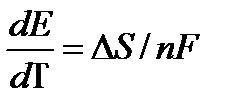 Таким образом, температурный коэффициент ЭДС характеризует изменение энтропии ∆S в ходе соответствующей химической реакции, а величина ∆ H характеризует общий тепловой эффект химической реакции при ее обратимом протекании в условиях постоянного давления. Гальванические элементы являются электрохимическими цепями с самопроизвольно протекающими химическими реакциями, для которых E > 0. Если (dE/dT) < 0, то ОВР, протекающая в гальваническом элементе, может быть только экзотермической (∆H<0).Поскольку при протекании реакции энтропия уменьшается S<0 , то работа гальванического элемента должна сопровождаться выделением теплоты. Следовательно, в условиях теплоизоляции электрохимическая система будет нагреваться. Таким образом, при работе гальванического элемента в условиях (dE/dT )<0 за счет убыли энтальпии совершается электрическая работа nFE и выделяется теплота в количестве nFТ(dE/dT) Аналогичным образом можно показать, что если (dE/dT).>0, то при работе такого элемента будет происходить поглощение теплоты из окружающей среды. В случае теплоизоляции электрохимической цепи, она будет охлаждаться. Если (dE/dT)=0, то реакция может быть только экзотермической. В этом случае ∆S=0 и работа гальванического элемента, совершаемая за счет убыли энтальпии, не должна сопровождаться тепловыми эффектами. Типы электродов, используемых в потенциометрии. Определение потенциала электрода. Известны электроды 1,2 и 3 рода. Электрод первого рода – металл в растворе своих ионов. Ox – ионы металла (простые или комплексные), Red – металл 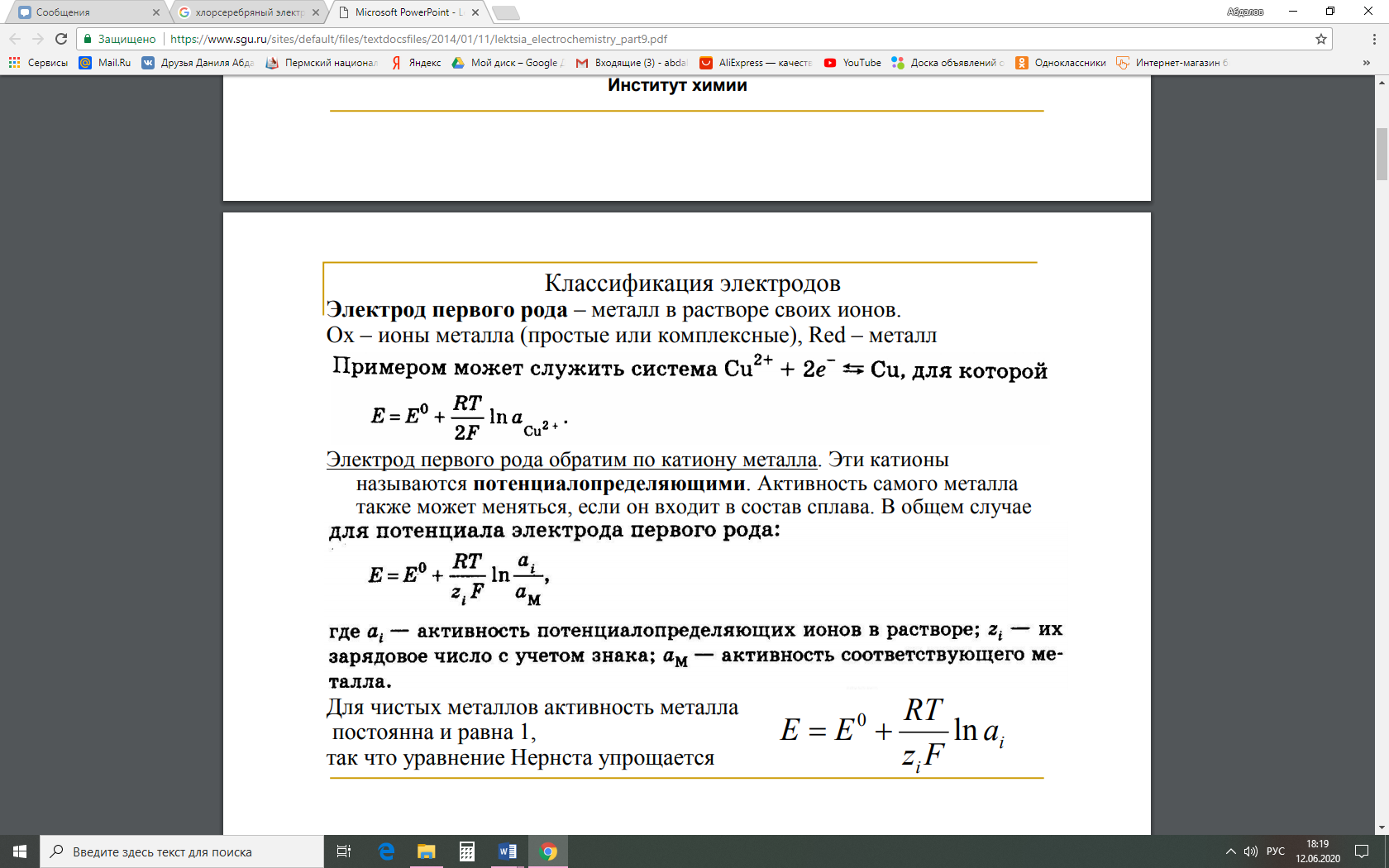 Электрод первого рода обратим по катиону металла. Эти катионы называются потенциалопределяющими. Активность самого металла также может меняться, если он входит в состав сплава. В общем случае  Для чистых металлов активность металла постоянна и равна 1, так что уравнение Нернста упрощается 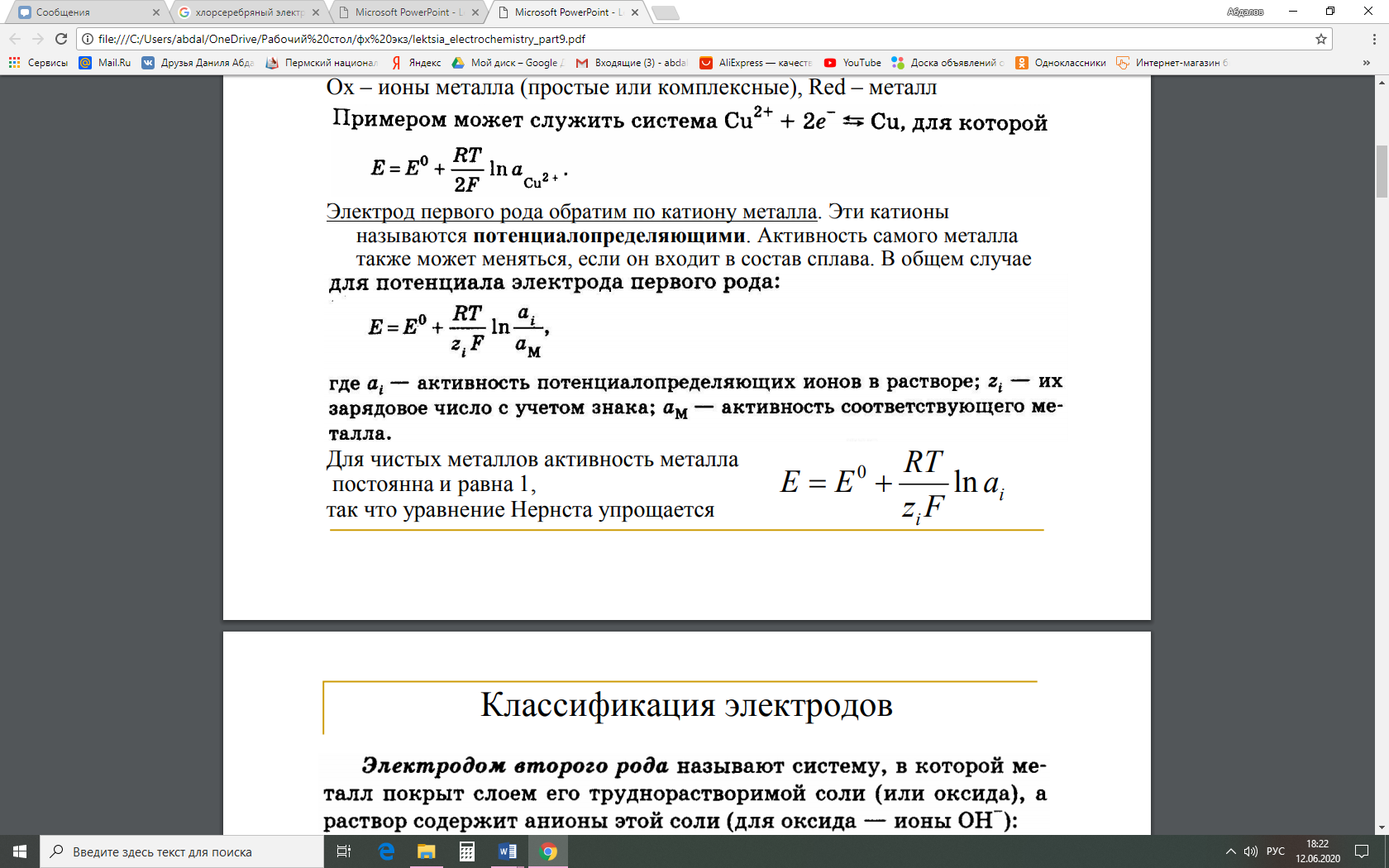 К электродам 1 рода относят амальгамные электроды: металлы,растворенные в ртути. Электроды 2 рода представляют собой металлы,покрытые солью малорастворимого соединения. К числу таких электодов относится: KCl(р-р),AgCl(тв)/Ag(тв)-хлорсеребряный электрод. На практике используется в качестве электрода сравнения. Рассмотрим процессы, протекающие при его работе: 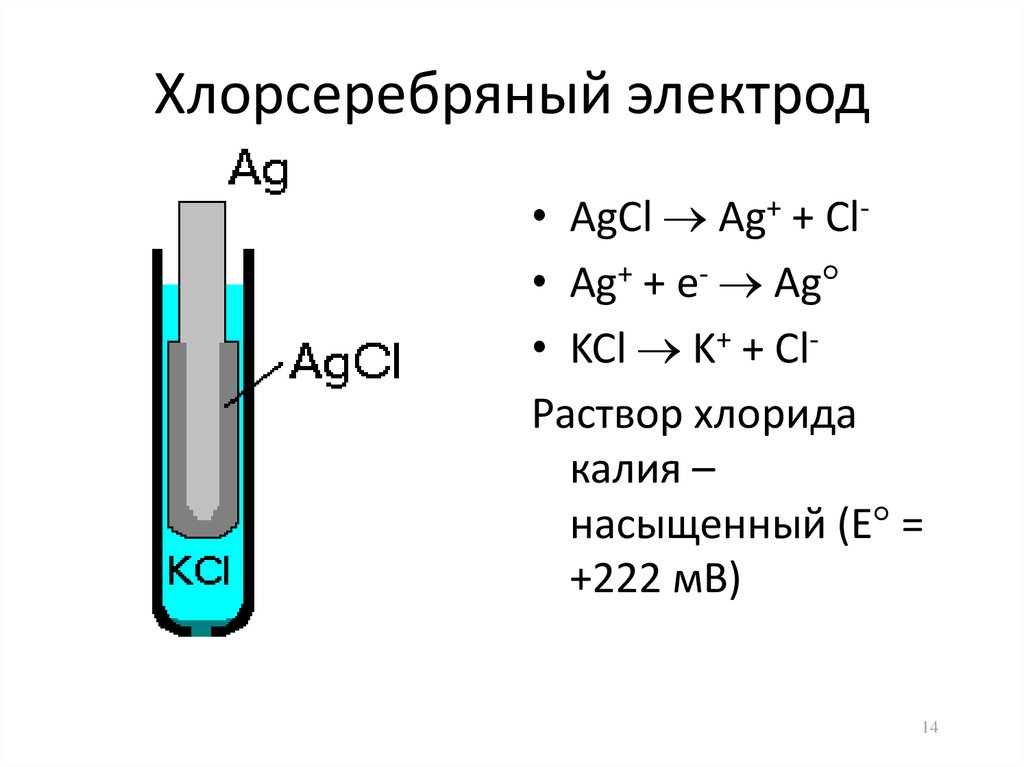  (электродная реакция получена сложением двух процессов, описанных выше) (электродная реакция получена сложением двух процессов, описанных выше)В соответствии с уравнением или Электродом 3 рода является металл, который находится в контакте с парой труднорастворимых солей: одна-соль данного металла, а вторая с тем же анионом, что и первая соль, но с другим катионом, и раствор, который содержит катион второй соли. Пример: Ca²⁺, CaC₂O₄ (тв), Ag₂C₂O₄(тв), Ag⁺(р-р). Потенциал такого электрода зависит от активности Ca²⁺ в растворе.  Газовые электроды обратимы относительно молекул в газовой фазе. Пример: водородный электрод H⁺(р-р)+1e=1/2 H₂ (г).  Окислительно-восстановительные электроды (редокс-электроды) позволяют определить окислительно-восстановительный потенциал в присутствии окисленных и восстановительных форм. Например:  В числителе всегда окисленная форма, а в знаменателе-восстановленная. Для определения электродного потенциала составляют гальванический элемент Me / 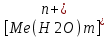 / (H2, H2SO4) / Pt, / (H2, H2SO4) / Pt,включающий стандартный водородный электрод и электрод, состоящий из металла, погруженного в раствор его соли. Электроды соединяются с внешней электрической цепью с помощью электролитического ключа – трубки, заполненной раствором инертного электролита (например, насыщенный KCl). Включенный в цепь электроизмерительный прибор (высокоомный вольтметр) фиксирует величину электродвижущей силы (ЭДС) собранного гальванического элемента:  Если в равновесной системе Me / 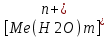 концентрация ионов металла равна 1 моль/л, то измеренная при температуре 25 °С величина электродного потенциала будет называться стандартным электродным потенциалом. Электрохимические цепи. Связь ЭДС электрохимического элемента с термодинамическими параметрами системы. Электрохимические цепи. В зависимости от природы и свойств электродов, из которых составлена электрохимическая система, различают химические и концентрационые цепи. В химических цепях электроды отличаются друг от друга химическими свойствами. В этих цепях источником электрической энергии служит химическая реакция. Различают химические цепи с двумя и одним электролитом. К электрохимическим элементам с двумя электролитами относится элемент Даниэля — Якоби. Химические цепи с одним электролитом могут быть двух видов. В цепях первого вида на одном электроде протекает реакция с участием катиона электролита (электрод первого рода), а на другом электроде — с участием аниона электролита (электрод второго рода). Так, например, в химической цепи на положительном и отрицательном электродах протекают реакции: 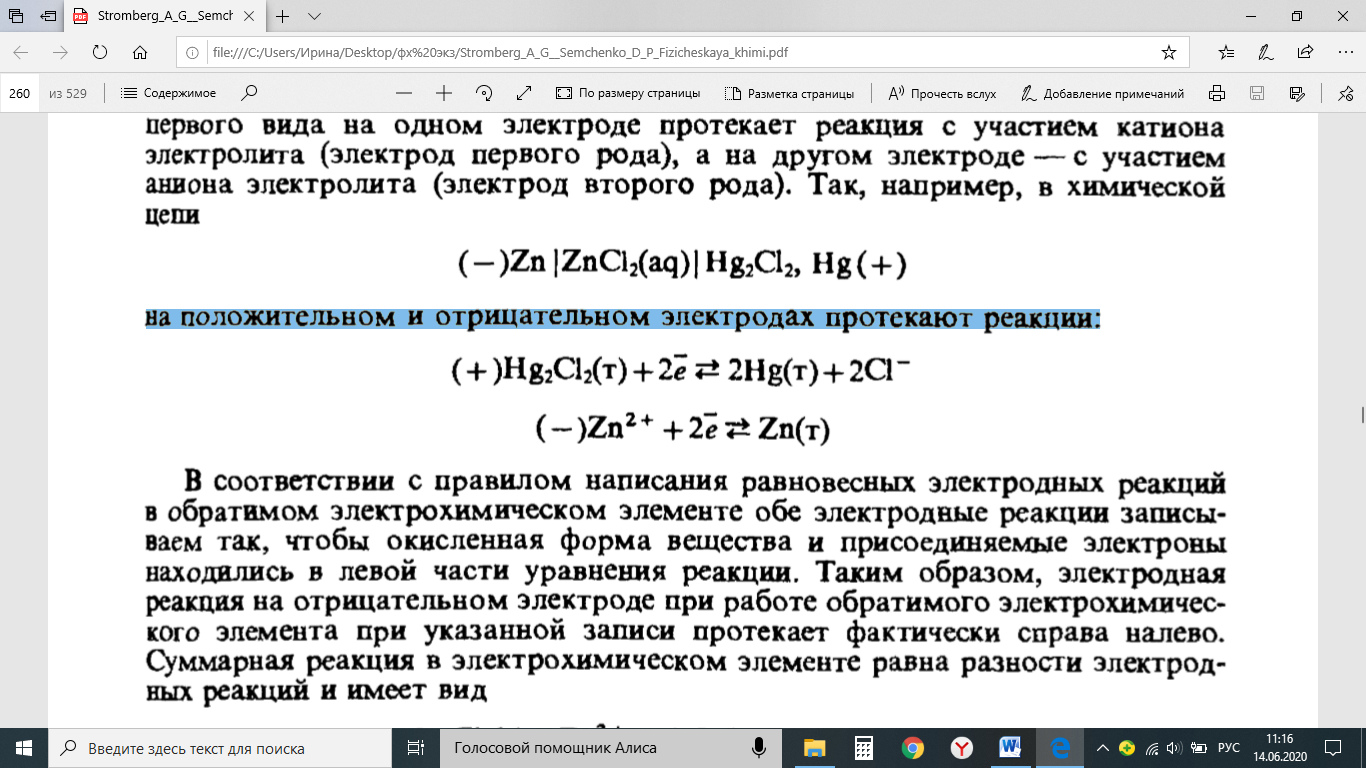 Суммарная реакция в электрохимическом элементе равна разности электродных реакций и имеет вид После переноса слагаемых с отрицательным знаком из одной части уравнения в другую уравнение реакции принимает обычный вид, получаем выражение для электродных потенциалов: 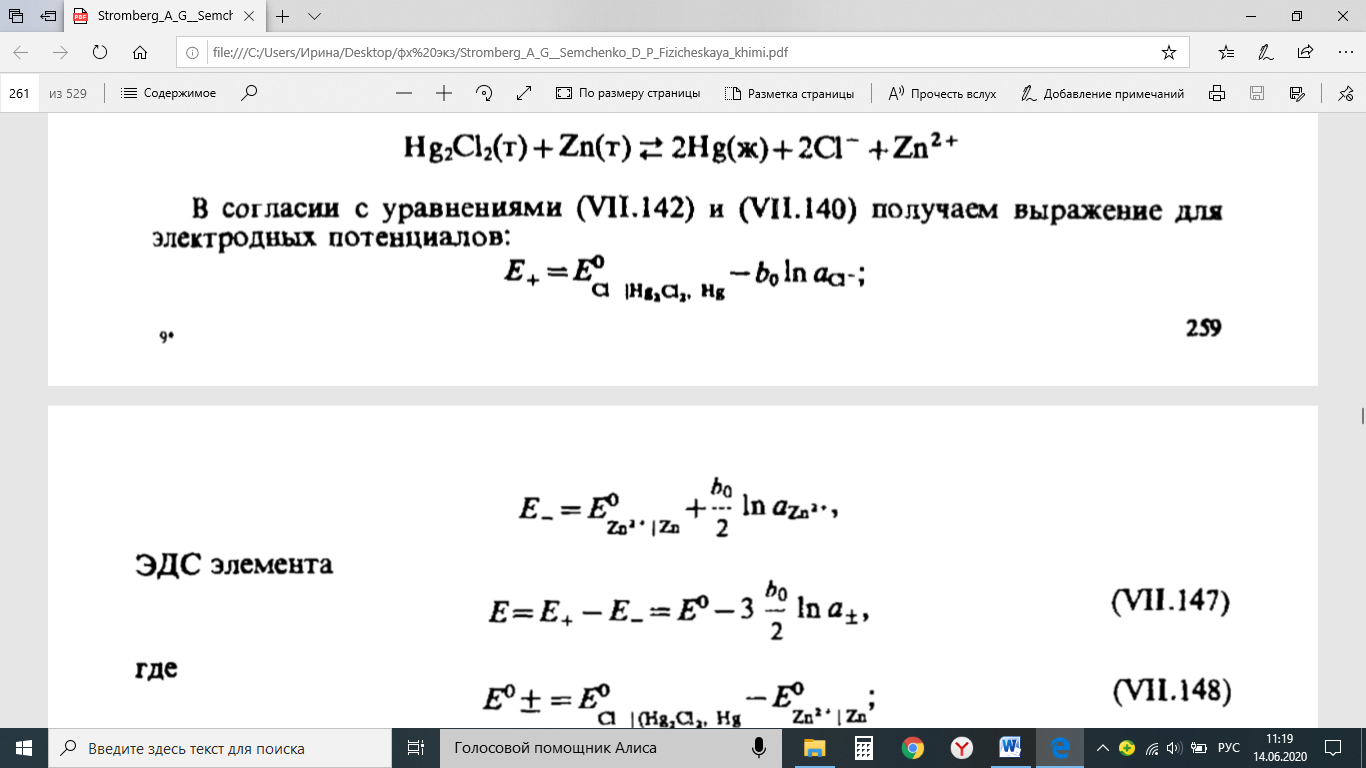  ЭДС элемента: 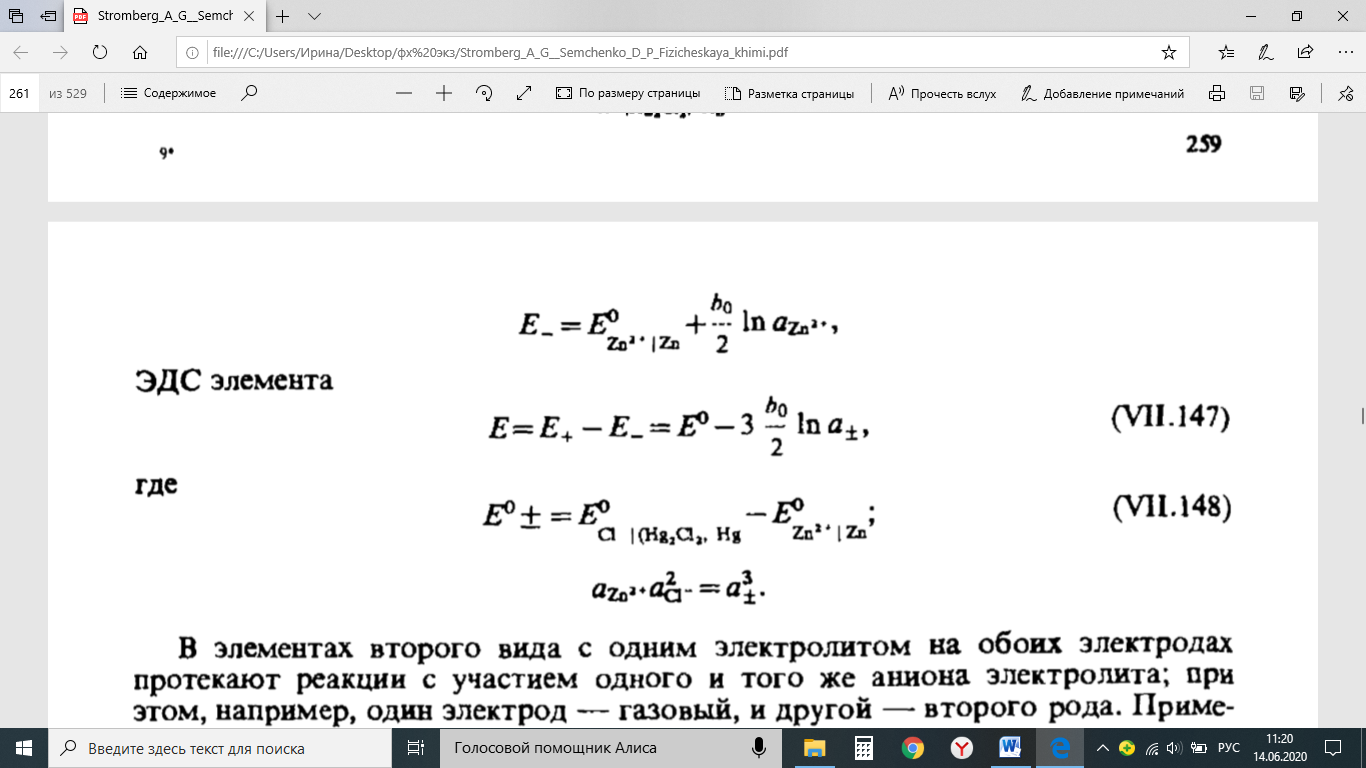 где  В элементах второго вида с одним электролитом на обоих электродах протекают реакции с участием одного и того же аниона электролита; при этом, например, один электрод — газовый, и другой — второго рода. Примером может служить элемент Реакции на электродах: 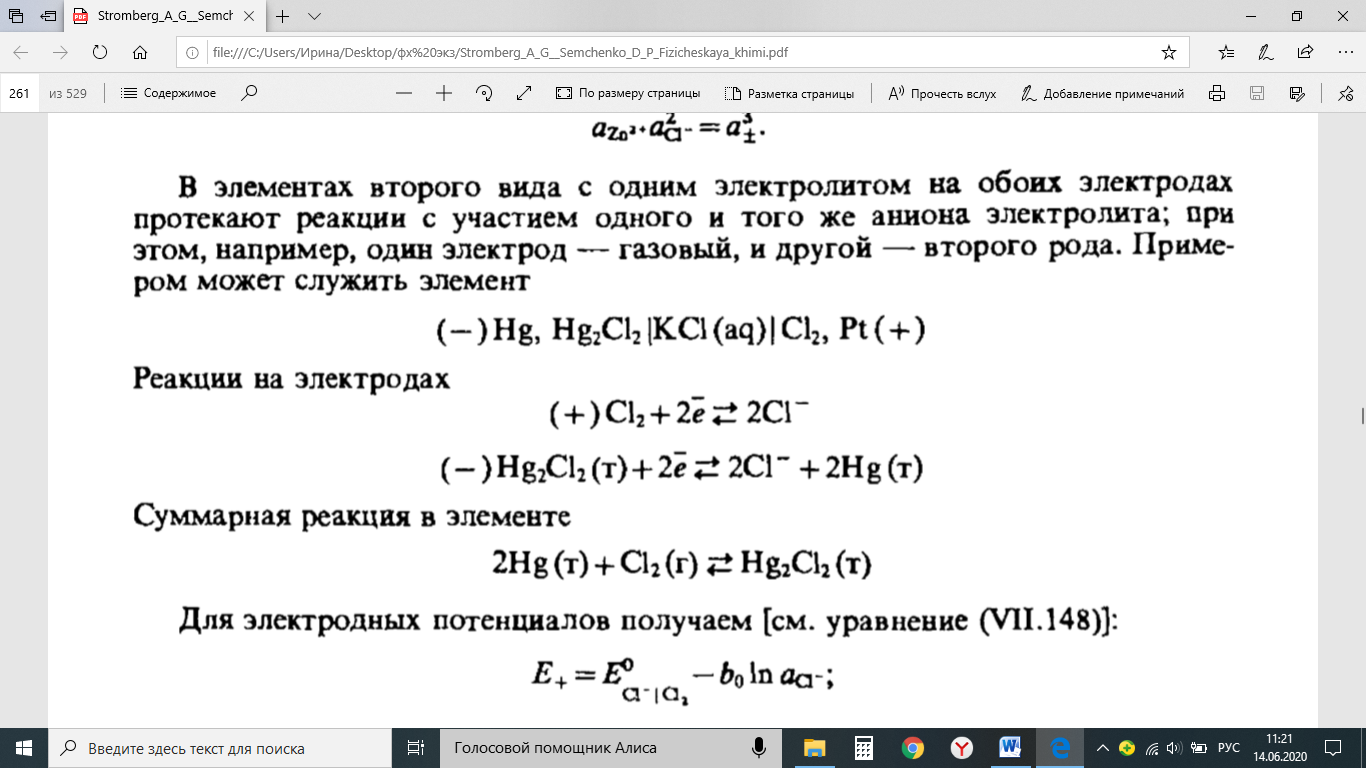 Суммарная реакция в элементе:  Для электродных потенциалов получаем 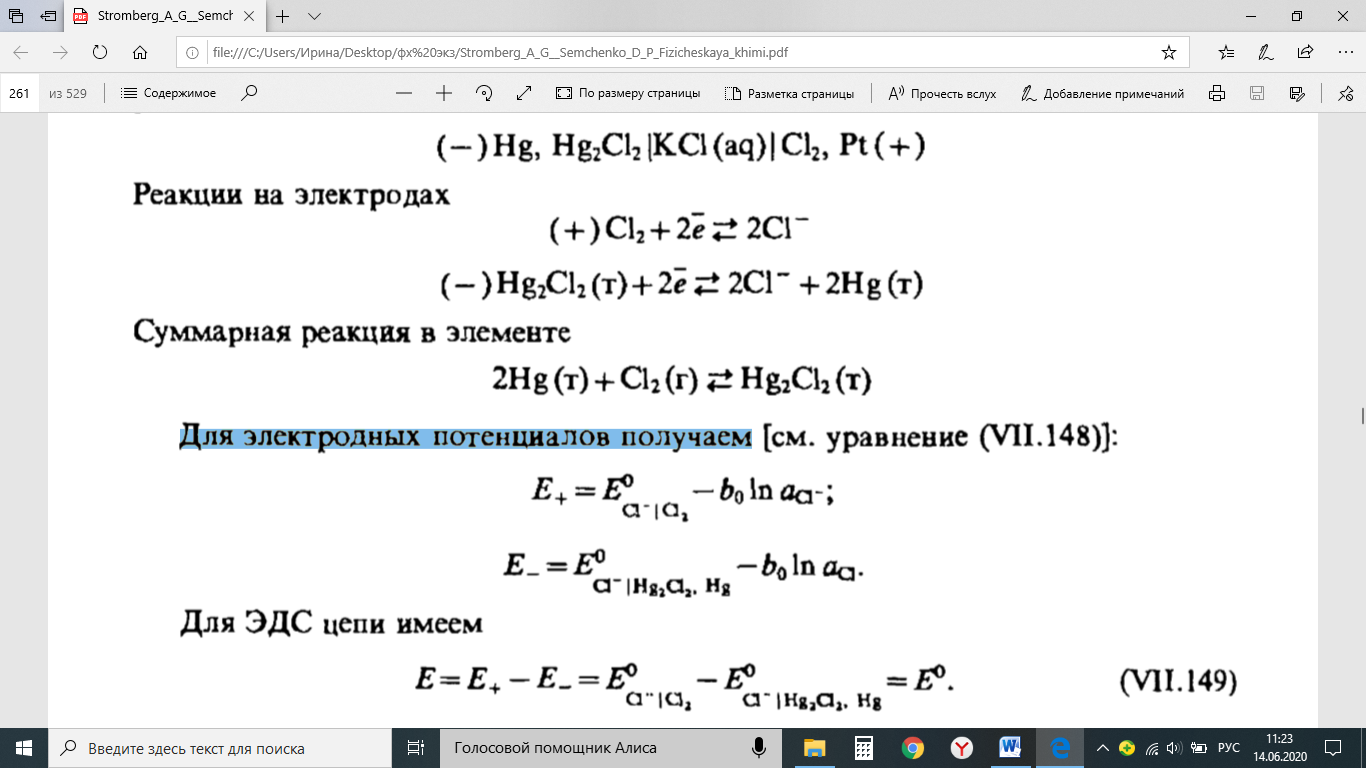 Для ЭД С цепи имеем 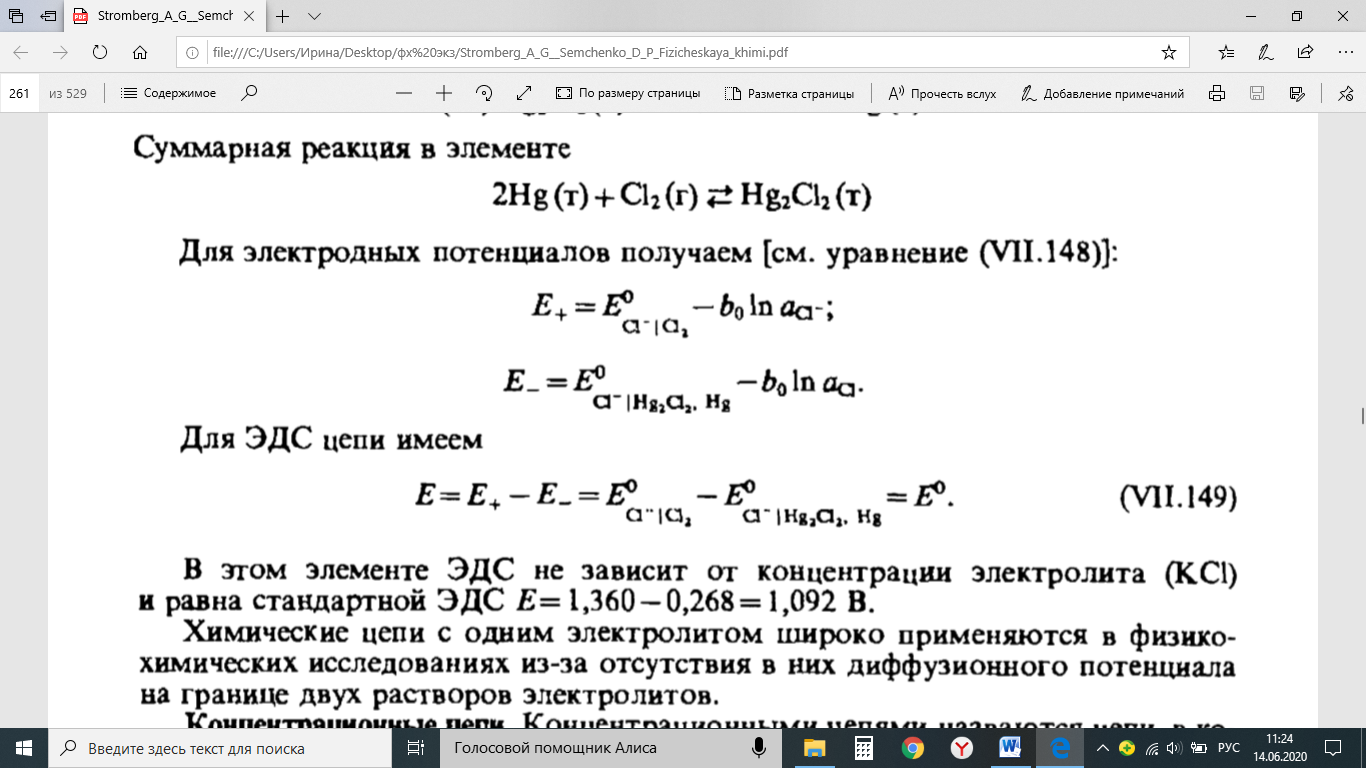 В этом элементе ЭД С не зависит от концентрации электролита (КС1) и равна стандартной ЭД С Е = 1,360 — 0,268= 1,092 В. Химические цепи с одним электролитом широко применяются в физико-химических исследованиях из-за отсутствия в них диффузионного потенциала на границе двух растворов электролитов. Концентрационными цепями называются цепи, в которых оба электрода одинаковы по своей природе, но различаются активностью одного или нескольких участников электродной реакции. При этом электрическая энергия получается за счет выравнивания концентраций веществ в элементе. Концентрационные цепи (элементы) могут быть без переноса и с переносом. Концентрационными цепями без переноса называются элементы: а) с одинаковыми электродами и двумя одинаковыми по природе, но разными по концентрации растворами электролитов, причем между растворами отсутствует непосредственное соприкосновение; б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации (с одним раствором электролита); в) с газовыми электродами, одинаковыми по природе, но с разным давлением газа на электродах (с одним раствором электролита). (примеры на стр.261) Концентрационными цепями (или элементами) с переносом называются элементы с одинаковыми электродами и двумя одинаковыми по природе, но разными по концентрации растворами электролитов, причем между растворами имеется непосредственная граница соприкосновения. Обычно на границе между растворами помещают пористую диафрагму, чтобы замедлить перемешивание растворов. На границе между растворами двух одинаковых электролитов разной концентрации возникает так называемый диффузионный потенциал ϕ0. Возникновение диффузионного потенциала на границе двух растворов объясняется разной подвижностью катиона и аниона при диффузии их из более концентрированного раствора в менее концентрированный. Таким образом, диффузионный потенциал является неравновесным потенциалом, возникающим вследствие переноса ионов через границу раздела. Связь ЭДС электрохимического элемента с термодинамическими параметрами системы. Термодинамические характеристики реакции: 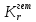 , стандартное мольное изменение энергии Гиббса реакции , стандартное мольное изменение энергии Гиббса реакции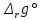 , стандартное мольное изменение энтропии реакции , стандартное мольное изменение энтропии реакции 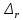 s° и стандартное мольное изменение энтальпии реакции s° и стандартное мольное изменение энтальпии реакции 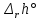 . .Начнем с мольной энергии Гиббса реакции, протекающей в гальваническом элементе:  С другой стороны, из определительного выражения константы равновесия Следовательно,  Известно, что 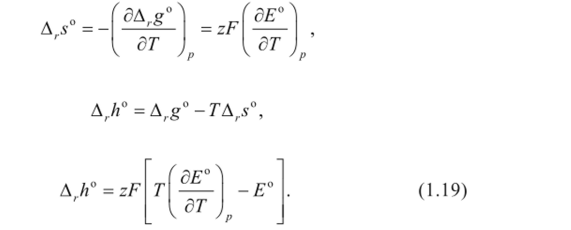 Для нахождения 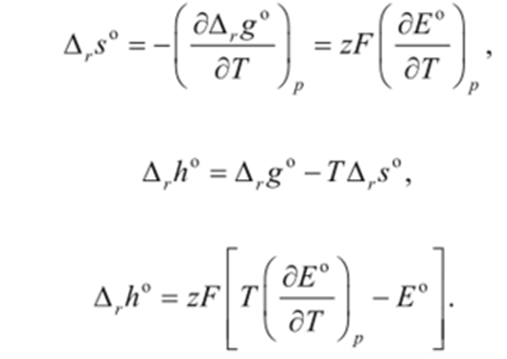 - температурного коэффициента, - температурного коэффициента, ЭДС — определяют на опыте E° при разных температурах и строят график Е=f(T). Для разных элементов зависимость имеет разный вид, примерный ход может быть таким (рис): линия 1- 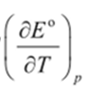 >0; линия 2- >0; линия 2- 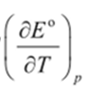 <0. <0.В небольшом диапазоне температур часто зависимость стандартной ЭДС от температуры бывает практически линейной. В этом случае нет необходимости проводить касательную, нужно просто определить угловой коэффициент самой зависимости. 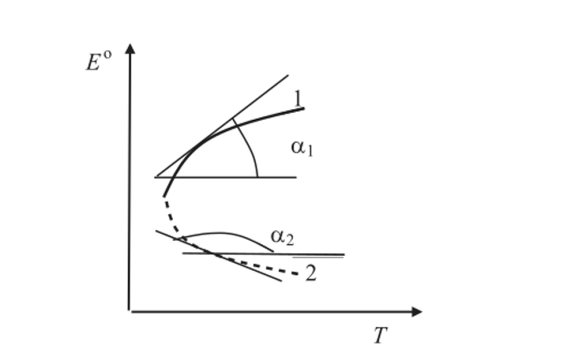 Элементы кинетики электрохимических реакций. Перенапряжение. Уравнение Тафеля. Основные кинетические характеристики i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2 поверхности раздела электрод-раствор. α– коэффициент переноса заряда – характеризует степень влияния электрического поля электрода на энергию активации электрохимической стадии и определяет симметрию катодного и анодного процессов, зависит от формы потенциальных кривых. α≈ 0,5. При одном и том же отклонении потенциала электрода от равновесного значения скорости реакции результативная плотность тока будет тем больше, чем выше i0. Ток обмена i0 зависит от природы электрохимической реакции, материала электрода и состава раствора. Константа скорости – скорость реакции при единичных концентрациях. Скорость прямой реакции: где k – константа, зависящая от свойств системы и способа выражения скорости процесса; Cox – концентрация реагирующих частиц; Ea – энергия активации разряда в отсутствии скачка потенциала между металлом и раствором. Скорость обратной реакции: где CRed – концентрация частиц Red (восстановление продуктов); Еa– энергия активации реакции ионизации при скачке потенциала между металлом и раствором, равным нулю. Энергия активации электрохимического процесса зависит от величины электродного потенциала, природы ее непосредственных участников и электрода. Энергия активации при постоянном перенапряжении η – эффективная энергия активации. Если энергия активации не зависит от перенапряжения, то ее появление замедляет диффузию. Метод расчета величин αи i0 основан на явлении редоксикинетического эффекта заключается в том, что при наложении переменного тока на электрод его потенциал смещается в ту или иную сторону на некоторую величину от первоначального значения. Это смещение – редоксикинетический потенциал ψ. Связь редоксикинетического потенциала ψ с кинетическими параметрами а и i0 такая: если наложить переменный ток на электрод, находящийся в равновесии с соответствующими ионами в растворе, то за время катодного полупериода он окажется заполяризованным катодно, причем зависимость между η и i при условии замедленности стадии разряда будет передаваться уравнением 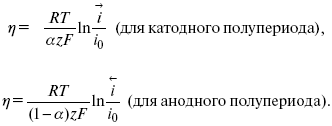 При достаточном удалении от состояния равновесия 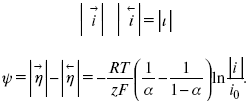 Из последнего выражения следует, если α= 0,5, то ψ = 0, чем сильнее α отклонена от 0,5, тем больше ψ. |
