Лекции по органической химии 1 курс. Введение органическая химия
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
Явление гомологии. Гомологический ряд метанаИз выше изложенного видно, что замещая в молекулах углеводородов один атом водород метильной группой, мы каждый раз получаем более сложный углеводород, отличающийся по состав от предыдущего на один углеродный и два водородных атома, т.е. на группу СН2. Если расположить выведенные таким образом углеводороды в порядке возрастания числа углеродных атомов или, что то же самое, в порядке возрастания их молекулярных весов, то они образуют следующий ряд: СН4, С2Н6, С3Н8, С4Н10, С5Н12, С6Н14, С7Н16, С8Н18, С9Н20 и т.д. Простой подсчет подсказывает, что соотношение атомов водорода и углерода во всех образующих этот ряд соединениях одинаково и может быть выражено общей формулой СnH2n+2, где n – число атомов углерода. Все эти вещества подобно метану являются предельными, насыщенными углеводородами. Такой ряд соединений, расположенных в порядке возрастания числа углеродных атомов, в котором каждый последующий член ряда отличается по составу от предыдущего на группу СН2, причем состав каждого члена характеризуется определенным постоянным соотношением атомов, называют гомологическим рядом, а вещества, образующие его гомологами; группу СН2 называют гомологической разностью состава. Члены гомологического ряда обладают сходным химическим строением, для них характерна некоторая общность физических и химических свойств и в то же время свойства их постепенно изменяются в ряду по мере изменения количественного состава. Гомологические ряды могут быть образованы не только углеводородами, но и органическими соединениями других классов. Существование такого рода рядов органических веществ получило название явления гомологии. Открытие гомологии сыграло большую роль в развитии органической химии. Оно позволило выделить из огромного количества органических соединений определенные ряды веществ, что значительно облегчило изучение их свойств. Исчерпывающее объяснение гомологии оказалось возможным только на основании теории химического строения, согласно которой гомология является следствием способности углеродных атомов образовывать цепи различной длины. Развитие представлений о гомологии позволило предсказать и открыть многие ранее неизвестные члены гомологических рядов. Гомологический ряд углеводородов, в котором простейшим является метан, называют гомологическим рядом метана, или гомологическим рядом предельных (насыщенных) углеводородов. Изомерия насыщенных углеводородовВернемся к выводу формул строения более сложных предельных углеводородов путем последовательного замещения атома водорода в молекуле более простого углеводорода на радикал метил. Из этана С2Н6 таким образом может быть выведен пропан – углеводород состава С3Н8, которому соответствует одновалентный радикал пропил состава С3Н7—. Напишем еще раз упрощенную структурную формулу пропана, обозначив в ней атомы углерода: СН3—СН2—СН3. Из этой формулы видно, что в пропане не все углеродные атомы одинаковы по своему положению в молекуле. Каждый из двух атомов углерода, обозначенных буквой , затратил только по одной валентной связи на соединение с другим углеродным атомом. Такие атомы углерода называют первичными углеродными атомами. Углеродный атом, обозначенный буквой , затратил на соединение с другими углеродными атомами две валентные связи и поэтому называется вторичным углеродным атомом. Первичные углеродные атомы входят в состав метильных групп, вторичный – в состав группы СН2 , которую называют метиленовой группой. Первичные углеродные атомы в молекуле пропана равноценны между собой, так как они связаны с одним и тем же вторичным углеродным атомом. Следовательно, равноценны и все атомы водорода, связанные с обоими первичными углеродными атомами, но они отличаются по положению от атомов водорода, соединенных с вторичным углеродом. Таким образом, очевидно, что при отнятии атома водорода от молекулы пропана могут образоваться два остатка состава С3Н7 : один при отнятии водорода от каждого из первичных углеродных атомов; его называют первичным пропилом, или просто пропилом; второй – при отнятии водорода от вторичного углеродного атома; его называют вторичным пропилом, или изопропилом: СН3—СН2—СН2 СН3—СН—СН3 пропил вторичный пропил (изопропил) При замещении одного атома водорода в молекуле пропана на остаток метил или, что то же самое, при соединении пропильного остатка С3Н7 с метильным остатком СН3 образуется следующий в ряду гомолог С4Н10 углеводород, получивший название бутан. Однако на основании выше изложенного следует сделать вывод, что бутанов может быть два. Один образуется при соединении метила с первичным пропильным остатком, его структурная формула и упрощенная формула имеет следующий вид: Н Н Н Н Н—С—С—С—С—Н бутан (а) СН3—СН2—СН2—СН3 Н Н Н Н Второй углерод состава С4Н10 образуется при соединении метила с вторичным пропильным остатком, и его строение может быть выражено формулами: Н Н Н СН3—СН—СН3 Н—С—С—С—Н СН3 изобутил (б) 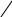 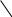 Н С Н Н С Н Н Н Н Перед нами два вещества, имеющие одинаковый состав, но в одном (а) четыре атома углерода образуют неразветвленную цепь, во втором (б) имеется цепь из трех углеродных атомов, а один углерод (метильная группа) образует боковое ответвление (боковую цепь). Оба соединения являются предельными углеводородами, атомы углерода в них четырехвалентны, и все их валентные связи насыщены. Однако эти вещества отличаются по физическим свойствам: оба они газы, но углерод с неразветвленной цепью кипит при -0,5 оС, углеводород с разветвленной цепью – при -11,7 оС. Выведенные углеводороды (а и б) – вещества, одинаковые по качественному и количественному составу, но различные по свойствам, так как они имеют различное химическое строение, т.е. отличаются последовательным порядком взаимной связи атомов и, следовательно, являются изомерами. Изомеры с неразветвленной цепью углеродных атомов называются нормальными соединениями; в частности, предельные углеводороды, у которых углеродные атомы образуют единую цепь, называются нормальными углеводородами или сокращенно н-углеводородами. Изомеры с разветвленной цепью углеродных атомов называются соединениями изостроения или изосоединениями (в частности, изоуглеводородами). Поэтому один из углеводородов С4Н10 (а) представляет собой н-бутан (или просто бутан), а второй (б) – изобутан. Как видно из изложенного, изомерные насыщенные углеводороды различаются лишь строением своих углеродных цепей. Поэтому изомерию насыщенных углеводородов обычно называют изомерией углеродного скелета или изомерией цепи. В других классах соединений встречаются иные, более сложны виды изомерии. Разберем теперь, какие радикалы могут образоваться из двух изомерных бутанов. Для этого еще раз напишем их формулы и обозначим углеродные атомы: а б б а а г а СН3—СН2—СН2—СН3 СН3—СН—СН3 бутан изобутан а СН3 В молекуле бутана атомы (а) являются первичными углеродными атомами и равноценны по своему положению в молекуле. Атомы (б) представляют собой вторичные углеродные атомы и также равноценны между собой. Таким образом, из бутана путем отнятия одного атома водорода от каждого из первичных углеродных атомов может быть получен радикал – первичный бутил (или просто бутил); при отнятии водорода от каждого из вторичных углеродных атомов образуется радикал – вторичный бутил: СН3—СН2—СН2—СН2 СН3—СН—СН2—СН3 бутил вторичный бутил В молекуле изобутана углеродные атомы (а) являются первичными, а атом (г) – третичным углеродным атомом, т.к. на соединение с другими углеродными атомами затрачено три его валентные связи. Все первичные углеродные атомы равноценны между собой, поскольку они соединены с одним и тем же третичным углеродом. Поэтому при отнятии атома водорода от каждого из первичных углеродов изобутана образуется радикал первичный изобутил (или просто изобутил), а при отнятии водорода от третичного углеродного атома – третичный изобутил: СН3—СН—СН2— (i) СН3—С—CH3 (ii) CH3 CH3 (i)– первичный изобутил, (ii) – третичный изобутил. Таким образом, возможны четыре бутильных остатка состава С4Н9—. |
