Лекции_Введение_в_нанотехнологии. Введение в нанотехнологии
 Скачать 5.09 Mb. Скачать 5.09 Mb.
|
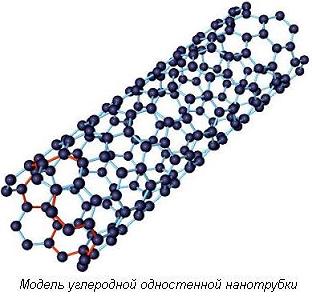
Глава 4. Контрольные вопросыЧто такое кластер? В чем особенности физических свойств кластеров? Как получают нанокластеры? Что такое магические числа? Что такое квантовые точки и почему их называют «искусственными атомами»? Как можно изменять физические свойства нанокластеров? Глава 5. Углеродные наноструктуры. Структуры на основе углеродаУглерод является неметаллическим химическим элементом IV группы (C, Si, Ge, Sn, Pb) периодической системы элементов Д.И. Менделеева, поэтому у углерода 4 валентных электрона. Он широко распространен, составляет основу живой природы, но содержание его в земной коре всего 0,19%. Д.И. Менделеев писал, что «ни в одном из элементов такой способности к усложнению не развито в такой мере, как в углероде». Способность атомов одного химического элемента соединяться друг с другом различными способами, образуя различные пространственные конфигурации, называется аллотропией. Углерод в полной мере обладает этим свойством. Действительно, у углерода четыре аллотропические модификации – алмаз (рис. 5.1 а), графит (рис. 5.1 б), карбин и фуллерен. В последние годы обнаружены новые модификации углерода: фуллерены, углеродные нанотрубки, графен, уникальные свойства которых открывают большие возможности в области нанотехнологий. 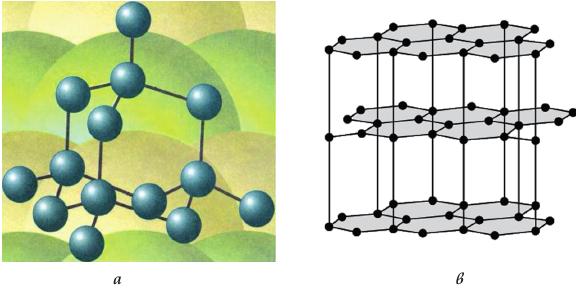 Рис. 5.1. Кристаллическая структура алмаза (а) и графита (б) У алмаза все четыре валентных электрона атомов углерода образуют высокопрочные ковалентные связи С–С. Их трудно разорвать. Поэтому у него отсутствуют электроны проводимости, и он относится к диэлектрикам. По этой же причине алмаз обладает исключительной твердостью и высокой температурой плавления (3550оC). Другой аллотропической формой углерода является графит, сильно отличающийся от алмаза по свойствам. Графит – мягкое черное вещество из легко слоящихся плоскостей, называемых графеновыми. В пределах графеновой плоскости атомы углерода соединены сильными ковалентными связями. Эти связи образуют двухмерную гексагональную решетку, в основе которой лежит правильный шестиугольник (рис. 5.2). Однако, в отличие от алмаза, в образовании связей участвуют только 3 электрона. Четвертые электроны атомов свободны. Это обусловливает хорошую электропроводность графеновых плоскостей (электрическое сопротивление – 0,0014 см). Между графеновыми плоскостями существует слабое притяжение, котороеОм обусловлено силами Ван-дер-Ваальса. Природа этих сил объясняется взаимодействием электронной оболочки атома с положительно заряженным ядром соседнего атома, кулоновское поле которого экранировано собственными электронами. Слабое взаимодействие между плоскостями приводит к тому, что они легко скользят относительно друг друга и могут отслаиваться от графита. 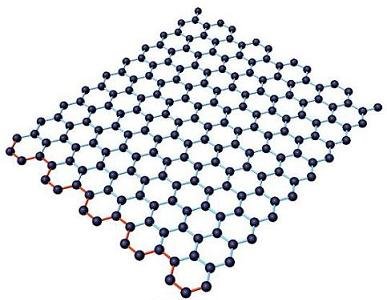 Рис. 5.2. Модель графена в виде двухмерной гексагональной решетки (http://www.ixbt.com) Хотя графит известен с незапамятных времен, изолированные графеновые плоскости научились получать и исследовать только в 2004 году. Профессор А. Гейм совместно с группой доктора наук К.С. Новоселова (Черноголовка, Россия) сумели получить материал толщиной в один атом углерода. Этот материал, названный графеном, представляет собой двухмерную плоскую молекулу углерода толщиной в один атом. Свойства графена оказались совершенно удивительными. Эффективная масса электронов графена стремится к нулю, поэтому эти электроны обладают большой подвижностью. Их подвижность в сотни раз превосходит подвижность электронов и дырок в кристаллическом кремнии, который является самым распространенным материалом современной микроэлектроники. Графен позволяет создавать транзисторы и другие полупроводниковые приборы очень малых габаритов (порядка нескольких нанометров). Уменьшение размеров транзистора приводит к изменению его свойств. С уменьшением размеров происходит переход в наномир, где усиливается роль квантовых эффектов. Электроны перемещаются по каналу как волны де Бройля, а это уменьшает количество столкновений (актов рассеяния) и, соответственно, повышает эффективность транзистора, так как уменьшаются потери энергии, неизбежные при рассеянии электронов. Третьей аллотропической формой углерода является карбин, открытый в 60-х годах ХХ века. Карбин представляет линейную структуру, в которой атомы углерода соединены двойными связями (=С=С=) либо чередующимися одинарными и тройными связями. Таким образом, структура карбина одномерная. Эти нити могут формировать углеродные волокна, обладающие большой прочностью и проводящими свойствами. Карбиновые нити могут замыкаться в кольца. В 1985 году была открыта ранее неизвестная форма углерода – фуллерены (рис. 5.3). 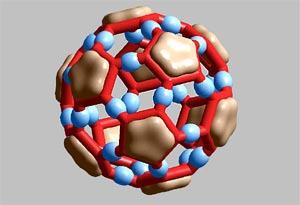 Рис. 5.3. Модель фуллерена Фуллерен представлял собой новую аллотропическую форму углерода. В фуллерене каждый атом углерода соединён тремя прочными химическими связями с другими атомами. Это имеет место и на графеновой плоскости. Однако, в отличие от графена, фуллерен образует выпуклую, замкнутую поверхность, состоящую из правильных шести и пятиугольников. По виду он напоминает футбольный мяч. Фуллерен назван в честь архитектора Б. Фуллерена, который создавал подобные купола у строящихся помещений. Формы фуллеренов могут быть достаточно разнообразными. В то же время квантовохимические расчеты показывают, что их построение подчиняется определенным правилам. Стабильные кластеры углерода имеют вид полиэдров, в которых каждый атом углерода имеет координационное число 3. Более стабильны карбополиэдры, содержащие только пяти- и шестичленные циклы. Наиболее исследованной является молекула фуллерена, которая состоит из 60 атомов и обозначается С60. Структура С60 содержит 20 шестиугольников и 12 пятиугольников, причем каждый шестиугольник граничит с 3 пятиугольниками и 3 шестиугольниками, пятиугольники граничат только с шестиугольниками. Такая структура обеспечивает молекуле C60 необычайную устойчивость. Наличие пятиугольников при построении замкнутых объемных геометрических фигур обязательно, именно они обеспечивают искривление графитовых слоев. Длины C–C связей различаются в зависимости от того, на какой границе они находятся: длина C–C связи на границе шестиугольник-шестиугольник равна 0,139 нм, а длина С–С связи на границе шестиугольник-пятиугольник 0,144 нм. Уже упоминалось, что в образовании структуры фуллерена принимает участие 3 электрона. Четвертый электрон находится на свободной химической связи. Поэтому данные молекулы обладают важными химическими свойствами. Они могут образовывать полимерные структуры, а также присоединять водород (гидрированные фуллерены), фтор (фторированные фуллерены) и другие атомы. Одним из явлений, наблюдаемых в твердых материалах на основе фуллеренов, является сверхпроводимость, причем критическая температура перехода в сверхпроводящее состояние достаточно высока. Еще в 1991 году было установлено, что при легировании твердого C60 небольшим количеством щелочного металла образуется материал с металлической проводимостью, который при низкой температуре переходит в сверхпроводящее состояние. Твердые фуллериты представляют собой полупроводники. Они являются одними из лучших фотопроводящих органических материалов. Из них можно изготавливать оптические преобразователи, удваивающие и утраивающие частоту падающего света. После открытия фуллерена ученые выяснили, что графеновые плоскости могут при определенных условиях сворачиваться в трубки. Эти образования были названы углеродными нанотрубками (УНТ). УНТ – это полые продолговатые цилиндрические структуры диаметром порядка от единиц до десятков нанометров и длиной порядка десятков микрон (рис. 5.4).
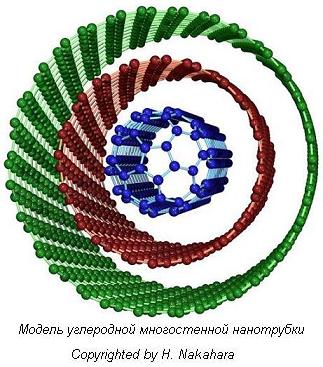
Идеальная нанотрубка представляет собой свернутую в цилиндр графеновую плоскость, т. е. поверхность, выложенную правильными шестиугольниками, в вершинах которых расположены атомы углерода. Формы углеродных нанотрубок очень разнообразны. Они могут быть одностенными или многостенными (однослойными или многослойными), прямыми или спиральными, длинными и короткими и т. д. Нанотрубки необыкновенно прочны на растяжение и на изгиб. Под действием больших механических напряжений они не рвутся, не ломаются, а просто перестраивают свою структуру. УНТ обладают важными для практического использования свойствами: они способны проводить ток очень высокой плотности, менять свои свойства при присоединении (адсорбции) других атомов и молекул, испускать электроны со своих концов при низких температурах (холодная электронная эмиссия) и т.д. Поэтому во всем мире ведутся интенсивные исследования их свойств, что расширяет область их практического использования. УНТ могут быть открытыми, как это показано на рис. 5.4, и закрытыми. В последнем случае их конец заканчивается половинкой фуллерена, поэтому фуллерены и УНТ являются родственными структурами купольного типа. | ||||