Неорганика. Закон сталості cкладу
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
22. Сірка в природі. Алотропні модифікації сірки. Хімічні властивості. Сполуки сульфура: оксиди, сірководень, кислоти, їх властивості, застосування. Сірководень і сульфіди Сірководень H2S — безбарвний газ із запахом тухлих яєць. Він добре розчинний у воді (при 20°С в 1 об’ємі води розчиняється 2,5 об’єму сірководню). Поширення в природі. Сірководень трапляється в природі у вулканічних газах і у водах деяких мінеральних джерел, наприклад П’ятигорська, Мацести. Він утворюється під час гниття сірковмісних органічних речовин різних рослинних і тваринних решток. Цим пояснюється характерний неприємний запах стічних вод, вигрібних ям і звалищ сміття. Добування. Сірководень може бути добутий безпосереднім сполученням сірки з воднем при нагріванні: Проте звичайно його добувають дією розведеної хлоридної або сульфатної кислот на сульфід феруму(ІІ): 2НСl + FeS = FeCl2 + H2S. Цю реакцію часто проводять в апараті Кіппа. Фізичні властивості. Сірководень — дуже отруйний газ, що уражає нервову систему. Тому працювати з ним потрібно у витяжній шафі або з приладами, що герметично закриваються. Допустимий вміст H2S у промислових приміщеннях становить 0,01 мг в 1 л повітря. Розчин сірководню у воді називається сірководневою водою, або сульфідною кислотою (вона виявляє властивості слабкої кислоти). Хімічні властивості. H2S — менш міцна сполука, ніж вода. Це зумовлено більшим розміром атома сульфуру порівняно з атомом оксигену (див. п. 6, табл. 9.1). Тому зв’язок Н—О коротший і міцніший, ніж зв’язок Н—S. При сильному нагріванні сірководень майже повністю розкладається на сірку і водень: H2S = S + Н2. Газуватий H2S горить на повітрі блакитним полум’ям з утворенням оксиду сульфуру(ІV) і води: 2H2S + 3О2 = 2SO2 + 2Н2О. При недостатній кількості кисню утворюються сірка і вода: 2H2S + О2 = 2S + 2Н2O. Цю реакцію використовують для добування сірки із сірководню в промисловому масштабі. Сірководень — досить сильний відновник. Цю його важливу хімічну властивість можна пояснити так. У розчині H2S порівняно легко віддає електрони молекулам кисню повітря: 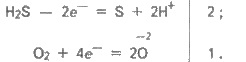 У цьому випадку H2S окиснюється киснем повітря до сірки, яка робить сірководневу воду каламутною. Сумарне рівняння реакції: 2H2S + О2 = 2S ↓ + 2Н2О. Цим пояснюється і той факт, що сірководень не нагромаджується в дуже великих кількостях у природі під час гниття органічних речовин — кисень повітря окиснює його до вільної сірки. Енергійно реагує сірководень з розчинами галогенів. Наприклад: H2S + l2 = 2Нl + S. Відбувається виділення сірки і знебарвлення розчину йоду. Слабка сульфідна кислота дисоціює на іони Н+ і HS- : H2S ⇆ Н+ + HS-; HS- ⇆ Н+ + S2-. В її розчині сульфід-іони S2- містяться в дуже малих кількостях. Сульфіди. Сульфідна кислота, як двохосновна, утворює два ряди солей — середні (сульфіди) і кислі (гідросульфіди). Наприклад, Na2S — сульфід натрію, NaHS — гідросульфід натрію. Майже всі гідросульфіди добре розчиняються у воді. Сульфіди лужних і лужноземельних металів також розчинні у воді, а решта металів практично нерозчинні або малорозчинні; деякі з них не розчиняються і в розведених розчинах кислот. Тому такі сульфіди можна легко добути, пропускаючи сірководень крізь розчин солі відповідного металу, наприклад: CuSO4 + H2S = CuS ↓ + H2SO4 або Cu2+ + H2S = CuS ↓ + 2Н+. Деякі сульфіди мають характерне забарвлення : CuS і PbS — чорне, CdS — жовте, ZnS — біле, MnS — рожеве, SnS — коричневе, Sb2S3 — оранжеве тощо. На різній розчинності сульфідів і різному забарвленні багатьох з них базується якісний аналіз катіонів. Оксид сульфуру(ІV). Сульфітна кислота Оксид сульфуру(ІV). Оксид сульфуру(ІV), або сірчистий газ, за звичайних умов — безбарвний газ з різким, задушливим запахом. Під час охолодження до — 10°С зріджується у безбарвну рідину. У рідкому стані його зберігають у стальних балонах. У лабораторних умовах оксид сульфуру(ІV) добувають взаємодією гідросульфіту натрію із сульфатною кислотою: 2Na2HSO3 + H2SO4 = Na2SO4 + 2SO2 ↑ + 2Н2O, а також нагріванням міді з концентрованою сульфатною кислотою: Cu + 2H2SO4 = CuSО4 + SO2 ↑ + 2Н2О. Оксид сульфуру(ІУ) утворюється також під час спалювання сірки. У промислових умовах SO2 добувають під час випалювання піриту FeS2 або сірчистих руд кольорових металів (цинкової обманки ZnS, свинцевого блиску PbS тощо). Оксид сульфуру(ІV) SO2, що утворюється за цих умов, використовують в основному для добування оксиду сульфуру(VІ) SO3 і сульфатної кислотиH2SO4 (див. § 9.6). Структурна формула молекули SO2: 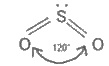 Як бачимо, в утворенні зв’язків у молекулі SO2 беруть участь чотири електрони сульфуру і чотири електрони від двох атомів оксигену. Взаємне відштовхування зв’язуючих електронних пар і неподіленої електронної пари атома сульфуру надає молекулі кутової форми. За наявності каталізатора під час нагрівання SO2 приєднує кисень повітря й утворюється SO3: +4 +6 2SO2 + O2 ⇆ 2SO3. У цій реакції сульфур змінює ступінь окиснення від +4 до +6, отже, для SO2 характерні відновні властивості. Оксид сульфуру(ІV) виявляє всі властивості кислотних оксидів. Сульфітна кислота. Оксид сульфуру(ІV) добре розчинний у воді (в 1 об’ємі води при 20°С розчиняється 40 об’ємів SO2). При цьому утворюється сульфітна кислота, яка існує тільки у водному розчині: SO2 + Н2O ⇆ H2SO3. span >Реакція сполучення SO2 з водою оборотна. У водному розчині оксид сульфуру (IV) і сульфітна кислота перебувають у стані хімічної рівноваги, яку можна зміщувати. При зв’язуванні H2SO3 лугом (нейтралізація кислоти) реакція йде в бік утворення сульфітної кислоти; при видаленні SO2 (продування через розчин азоту або нагрівання) — в бік утворення вихідних речовин. У розчині сульфітної кислоти завжди міститься оксид сульфуру(ІV), який надає йому різкого запаху. Оксид сульфуру(ІV) і сульфітна кислота знебарвлюють багато барвників, утворюючи з ними безбарвні сполуки. Останні можуть знову розкладатися при нагріванні або при освітленні, внаслідок чого забарвлення відновлюється. Отже, вибілююча дія SO2 і H2SO3 відрізняється від вибілюючої дії хлору. Звичайно оксидом сульфуру(ІV) вибілюють вовну, шовк і солому (хлорною водою ці матеріали руйнуються). Оксид сульфуру(ІV) вбиває багато мікроорганізмів. Тому для знищення пліснявих грибів ним обкурюють сирі підвали, погреби, винні бочки тощо. Використовують його також під час транспортування і зберігання фруктів і ягід. Багато оксиду сульфуру(ІV) потрібно для добування сульфатної кислоти. Широко застосовується розчин гідросульфіту кальцію Ca(HSO3)2 (сульфітний митель), яким обробляють волокна деревини і паперову масу. 23. Сульфатна кислота, її властивості, отримання. Оксид сульфуру(VІ). Сульфатна кислота Оксид сульфуру(VІ). Оксид сульфуру (VI), або триоксид сульфуру, — це безбарвна рідина, що перетворюється при температурі нижчій 17 °С на тверду кристалічну масу. Він дуже сильно поглинає вологу, утворюючи сульфатну кислоту: SO3 + Н2О = H2SO4, тому його зберігають у запаяних колбах. Оксид сульфуру(VІ) виявляє всі властивості кислотних оксидів. Добувають його окисненням SO2. Він є проміжним продуктом у виробництві сульфатної кислоти. Молекула SO3 має форму трикутника, в центрі якого розміщений атом сульфуру: 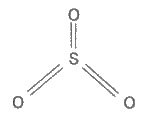 Така будова зумовлена взаємним відштовхуванням зв’язуючих електронних пар. Для її утворення атом сульфуру надав усі шість зовнішніх електронів. Сульфатна кислота. Найбільше значення має контактний спосіб добування сульфатної (сірчаної) кислоти. Цим способом можна добути H2SO4 будь-якої концентрації, а також олеум, тобто розчин SO3 вH2SO4. Процес складається з трьох стадій: 1) добування SO2; 2) окиснення SO2 в SO3; 3) добуванняH2SO4. Оксид сульфуру(ІV) SO2 добувають випалюванням піриту FeS2 у спеціальних печах: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2. Для прискорення випалювання пірит попередньо подрібнюють, а для повнішого вигоряння сірки вводять значно більше повітря (кисню), ніж потрібно для реакції. Газ, що виходить з печі випалювання, складається з оксиду сульфуру(ІV), кисню, азоту, сполук арсену (з домішок у колчедані) і водяної пари. Він називається випалювальним газом. Випалювальний газ піддають ретельному очищенню; оскільки навіть мізерні кількості сполук арсену, що містяться в ньому, а також пил і волога отруюють каталізатор. Від сполук арсену і від пилу газ очищають, пропускаючи його крізь спеціальні електрофільтри і промивну башту; волога поглинається концентрованою сульфатною кислотою у сушильній башті. Очищений газ, що містить кисень, нагрівається в теплообміннику до 450°С і надходить до контактного апарата. Всередині контактного апарата є решітчасті полички, заповнені каталізатором. Раніше як каталізатор використовували тонко подрібнену металічну платину. Пізніше вона була замінена сполуками ванадію — оксидом ванадію(V) V2O5 або сульфатом ванадилу VOSO4, які дешевші, ніж платина, і повільніше отруюються. Реакція окиснення SO2 в SO3 оборотна: 2SO2 + O2 ⇆2SO3. Збільшення кількості кисню у випалювальному газі підвищує вихід оксиду сульфуру(VІ): при температурі 450°С він звичайно досягає 95% і більше. Оксид сульфуру(VІ) SO3 поглинається концентрованою сульфатною кислотою — утворюється олеум. Розводячи олеум водою, можна дістати розчин кислоти необхідної концентрації. Слід зазначити, що поглинати оксид сульфуру(VІ) концентрованою H2SO4, а не водою доцільніше, тому що він виходить із контактного апарата дрібно розпиленим і з водя ною парою утворює туман, що складається з дрібних краплин сульфатної кислоти, який не поглинається водою. При поглинанні SO3 концентрованою сульфатною кислотою туман не утворюється. Концентровану сульфатну кислоту перевозять залізницею у стальних цистернах. Властивості сульфатної кислоти та її практичне значення Фізичні властивості. Сульфатна кислота — важка безбарвна оліїста рідина. Надзвичайно гігроскопічна. Поглинає вологу з виділенням великої кількості теплоти, тому не можна воду доливати до концентрованої сульфатної кислоти — відбуватиметься розбризкування кислоти. Для розведення потрібно сульфатну кислоту доливати невеликими порціями до води. Безводна сульфатна кислота розчиняє до 70 % оксиду сульфуру(VІ). При звичайній температурі вона не летка і не має запаху. При нагріванні відщеплює SO3 доти, доки не утвориться розчин, що містить 98,3 % H2SO4. Безводна H3SO4 майже не проводить електричного струму. Хімічні властивості. Концентрована сульфатна кислота обвуглює органічні речовини — цукор, папір, деревину, волокна тощо, відбираючи від них елементи води. При цьому утворюються гідрати сульфатної кислоти. Обвуглювання цукру можна подати рівнянням: С12Н22О11 + nH2SO4 = 12С + nH2SO4 ∙ 11Н2O. Вугілля, що утворилося, частково вступає у взаємодію з кислотою: С + 2H2SO4 = СО2 + 2SO2 + 2Н2O. Тому кислота, що надходить у продаж, має бурий колір від пилу й органічних речовин, які випадково потрапили в розчин і обвуглилися. На поглинанні (відбиранні) води сульфатною кислотою базується осушування газів. Як сильна нелетка кислота, H2SO4 витісняє інші кислоти із сухих солей. Наприклад: NaNO3 + H2SO4 = NaHSO4 + HNO3. Однак, якщо H2SO4 додають до розчинів солей, то витіснення кислот не відбувається. Дуже важлива хімічна властивість сульфатної кислоти — взаємодія її з металами. Розведена і концентрована сульфатна кислота реагує з ними по-різному. Розведені розчини сульфатної кислоти розчиняють метали, розташовані в ряду стандартних електродних потенціалів до водню. Однак на поверхні свинцю утворюється плівка PbSO4, яка захищає його від подальшої взаємодії з кислотою. Метали, розташовані в ряду стандартних електродних потенціалів після водню, з розведеними розчинами H2SO4 не взаємодіють. Концентрована сульфатна кислота за звичайної температури з багатьма металами не реагує. Тому безводну сульфатну кислоту можна зберігати у залізній тарі й перевозити у стальних цистернах1. Однак при нагріванні концентрована H2SO4 взаємодіє майже з усіма металами (крім Pt, Au та деяких інших). При цьому вона виступає як окисник, сама відновлюється звичайно до SO2. Водень у цьому випадку не виділяється, а утворюється вода. Наприклад: Cu + 2H2SO4 = CuSO4 + SO2 + 2Н2O. Сульфатна кислота має всі властивості кислот. Значення сульфатної кислоти. Сульфатна кислота є важливим продуктом основної хімічної промисловості, що виробляє неорганічні кислоти, луги, солі, мінеральні добрива і хлор. За різноманітністю застосування сульфатна кислота посідає перше місце серед кислот. Найбільша кількість її витрачається для добування фосфорних та азотних добрив. Як нелетка кислота, сульфатна кислота використовується для добування інших кислот — хлоридної, плавикової, ортофосфатної, ацетатної тощо. Багато її йде для очищення нафтопродуктів — бензину, гасу, мастил — від шкідливих домішок. У машинобудуванні сульфатною кислотою очищають поверхню металів від оксидів перед покриттям (нікелюванням, хромуванням тощо). Сульфатна кйслота застосовується у виробництві вибухових речовин, штучного волокна, барвників, пластмас та ін. її використовують для заливання акумуляторів. У сільському господарстві вона застосовується для боротьби з бур’янами (гербіцид). 24. Підгрупа Нітрогену, загальна характеристика, отримання та властивості азоту, біологічне значення. Загальна характеристика підгрупи нітрогену Підгрупу нітрогену складають п'ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів — ns2 nр3 (п. 2, табл. 10.1). Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий —3, характерний також +3.
На прикладі нітрогену і фосфору розглянемо валентні стани елементів. Електронна будова зовнішніх енергетичних рівнів їх атомів така: У атома нітрогену є три неспарених електрони. Тому валентність нітрогену дорівнює трьом. N2O3 — кислотний оксид; Р4О6 — слабкокислотний оксид; AS2O3 — амфотерний оксид з переважанням кислотних властивостей; SbО3 — амфотерний оксид з переважанням основних властивостей; Вl2О3 — основний оксид. Отже, кислотні властивості оксидів складу R2O3 та R2O5зменшуються зі зростанням порядкового номера елемента . Азот у природі трапляється переважно у вільному стані. У повітрі об’ємна частка його становить 78,09 %, а масова частка — 75,6 %. Сполуки нітрогену в невеликих кількостях є у ґрунті. Нітроген входить до складу білкових речовин і багатьох природних органічних сполук. Загальний вміст азоту у земній корі становить 0,01 %. |
