Неорганика. Закон сталості cкладу
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
Швидкість хімічної реакціїІнтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагуючої речовини або продукту реакції за одиницю часу: де С – молярна концентрація реагуючої речовини, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагуючої речовини в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість рекції завжди позитивна. Швидкість хімічної реакції також визначається законом діючих мас, що був висунутий Бекетовим, а потім формульований Гульдберґом і Вааґе у 1867 році. За цім законом швидкість хімічної реакції при постійній температурі прямо пропорційна добуткові концентрацій реагуючих речовин у степеням, які дорівнюють стехіометричним коефіцієнтам у відповідному рівнянні реакції. Залежність швидкості гомогенних реакцій від концентрації (закон діючих мас) Вплив концентрації реагуючих речовин може бути пояснено з уявлень, згідно з якими хімічну взаємодію є результатом зіткнення частинок. Збільшення числа частинок в заданому обсязі призводить до частіших їх зіткнень, тобто до збільшення швидкості реакції. Кількісно залежність між швидкістю реакції та молярний концентраціями реагуючих речовин описується основним законом хімічної кінетики - законом діючих мас. Швидкість хімічної реакції при постійній температурі прямо пропорційна добутку концентрацій реагуючих речовин. Для мономолекулярної реакції визначається концентрацією молекул речовини А:швидкість реакції v = k * [A] де k - коефіцієнт пропорційності, який називається константою швидкості реакції; [А] - молярна концентрація речовини А. У разі бімолекулярний реакції, її швидкість визначається концентрацією молекул не тільки речовини А, але і речовини В: v = k * [A] * [B] У разі трімолекулярной реакції, швидкість реакції виражається рівнянням: v = k * [A] 2 * [B] У загальному випадку, якщо в реакцію вступають одночасно т молекул речовини А і n молекул речовини В, т. е. ТА + ПВ = С, рівняння швидкості реакції має вигляд: v = k * [A] m * [B] n Це рівняння є математичний вираз закону діючих мас у загальному вигляді. Щоб зрозуміти фізичний зміст константи швидкості реакції, треба прийняти в написаних вище рівняннях, що [А] = 1 моль / л і [В] = 1 моль / л (або прирівняти одиниці їх твір), і тоді v = k. Звідси ясно, що константа швидкості k чисельно дорівнює швидкості реакції, коли концентрації реагуючих речовин (чи його твір в рівняннях швидкості) рівні одиниці. Загальна вираз для швидкості хімічної реакції отримано для даної, фіксованої температури. У загальному ж випадку, оскільки швидкість реакції залежить від температури, закон діючих мас записується як v (T) = k (T) * [A] m * [B] n де v і k є функціями температури. 9.3 Константа швидкості хімічної реакції, її залежність від температури Численні досліди показують, що при підвищенні температури швидкість більшості хімічних реакцій істотно збільшується, причому для реакцій в гомогенних системах при нагріванні на кожні десять градусів швидкість реакції зростає в 2 - 4 рази (правило Вант-Гоффа). Це правило пов'язане з поняттям температурного коефіцієнта швидкості реакції γ і визначається співвідношенням γ = k Т +10 / k Т Значення температурного коефіцієнта γ дає можливість розрахувати зміну швидкості реакції при збільшенні температури на деяке число градусів від Т 1 до Т 2 по формулі v (Т 1) / v (Т 2) = γ (Т 2-Т 1) / 10 Очевидно, що при підвищенні температури в арифметичній прогресії швидкість реакції зростає в геометричній. Каталіз Каталіз - процес, що полягає у зміні швидкості хімічних реакцій у присутності речовин, які називаються каталізаторами. Каталітичні реакції - реакції, що протікають в присутності каталізаторів. Позитивним називають каталіз, при якому швидкість реакції зростає, негативним ( інгібуванням) - при якому вона убуває. Прикладом позитивного каталізу може служити процес окислення аміаку на платині при отриманні азотної кислоти. Прикладом негативного - зниження швидкості корозії при введенні в рідину, в якій експлуатується метал, нітриту натрію, хромату і дихромата калію. Багато найважливіші хімічні виробництва, такі, як отримання сірчаної кислоти, аміаку, азотної кислоти, синтетичного каучуку, ряду полімерів та ін, проводяться в присутності каталізаторів. 6. Хімічна рівновага, фактори її зміщення. Принцип Лє-Шательє. Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотними. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаютьсянеоборотними. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції — випадають у вигляді осаду, виділяються у вигляді газу: 2) Утворюються малодисоціюючі сполуки, наприклад вода: 3) Виділяється велика кількість енергії: Хімічна рівновага Оборотні реакції не йдуть до кінця і закінчуються встановленням хімічної рівноваги — такого стану системи реагуючих речовин, за якого швидкості прямої та зворотної реакцій однакові. Стан хімічної рівноваги можна змістити в той або інший бік зміною зовнішніх умов: температури, тиску, концентрації речовин, що беруть участь у реакції. Ці зміни визначаються принципом динамічної рівноваги— принципом Ле Шательє: зовнішня дія на рівноважну систему зміщує рівновагу в напрямі ослаблення ефекту цієї дії. Із принципу Ле Шательє випливає: 1) при збільшенні концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а при зменшенні концентрації — у бік її утворення; 2) зміна тиску зміщує рівновагу тільки в газових системах. Зі збільшенням тиску рівновага зміщується у бік зменшення об’єму (кількості речовини) газоподібних речовин, із зменшенням тиску — у бік збільшення об’єму (кількості речовини) газоподібних речовин. Якщо реакція проходить без зміни числа молекул (кількості речовини) газоподібних речовин, то тиск не впливає на стан рівноваги; 3) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури — екзотермічної реакції. 7. Окисно-відновні реакції. Окисник,відновник. Складання ОВР методом електронного баланса. Окисно-відновні реакції За зміною ступенів окиснення елементів, що входять до складу реагентів та продуктів реакції, усі хімічні реакції можна розділити на дві групи, а саме на: 1) Реакції, що протікають без зміни ступенів окиснення всіх елементів. До таких реакцій належать, зокрема, реакції іонного обміну в розчинах та деякі інші: AgNO3 + NaCl → AgCl ↓ і + NaNO3. 2) Реакції, що протікають зі зміною ступеня окиснення всіх або деяких (або навіть одного) елементів, наприклад: — усі елементи змінюють ступені окиснення: 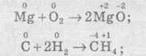 — деякі елементи змінюють ступені окиснення:  — один елемент змінює ступінь окиснення: 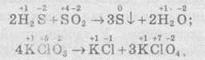 Хімічні реакції, які протікають зі зміною ступеня окиснення елементів, що входять до складу реагентів, називають окисно-відновними реакціями (ОВР). Будь-який окисно-відновний процес обов’язково складається з двох протилежних процесів — окиснення та відновлення. Окиснення — це процес віддачі електронів атомом, іоном або молекулою. Якщо атом віддає електрон, то він здобуває позитивний заряд: Якщо негативно заряджена частинка віддає електрон, то вона може перетворюватися в нейтральний атом або позитивно заряджену частинку: Якщо ж позитивно заряджена частинка віддає електрони, то вона збільшує свій позитивний заряд: Відновлення — це процес прийому електронів атомом, іоном або молекулою. Якщо нейтральний атом приймає електрони, то він перетворюється в негативно заряджену частинку: Якщо позитивно заряджена частинка приймає електрони, то вона зменшує свій позитивний заряд і залежно від числа прийнятих електронів може перетворитися в позитивно заряджену частинку з меншим позитивним зарядом, нейтральний атом або негативно заряджену частинку: 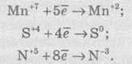 Частинку (атом, молекулу або іон), яка приймає електрон, називають окисником, а частинку, яка віддає електрони — відновником. Окисник у процесі реакції відновлюється, а відновник — окислюється. Оскільки в результаті реакції одна частинка віддає електрони, то обов’язково має бути частинка, яка ці електрони приймає, тому процеси окиснення й відновлення нерозривно пов’язані й не можуть протікати незалежно один від одного. Із цієї ж точки зору в окисно-відновному процесі обов’язково мають брати участь окисник і відновник, ОВР не може протікати між двома окисниками або між двома відновниками. Окисниками можуть бути частинки, які здатні приймати електрони. До таких частинок належать: 1) нейтральні атоми та молекули неметалів; 2) позитивно заряджені іони металів, складні іони та молекули, що містять атоми елементів з вищим або проміжним ступенем окиснення. Катіони як окисники Позитивно заряджені іони металів тією чи іншою мірою володіють окисною здатністю, тобто здатні приймати електрони — відновлюватися. Серед них найсильнішими окисниками є іони металів з найвищим ступенем окиснення. 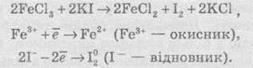    Аніони як окисники Типовими окисниками є аніони, до складу яких входять атоми перехідних металів з вищим ступенем окиснення, наприклад: КМnО, (Мn+7), К2Сr2O7 (Сr+6) тощо. Сильними окисниками є також іони або молекули, що містять неметали з позитивним ступенем окиснення (вищим або проміжним), наприклад нітратна кислота HNO3 (N+5), концентрована сульфатна кислота H2SO4 (S+6), бертолетова сіль КСlO3 (Сl+5) тощо. Найпоширеніші окисники, які часто використовують у техніці або в лабораторіях: 1.Кисень (O2) використовують у багатьох хімічних виробництвах. Ще більш сильним окисником є інша алотропна модифікація Оксигену — озон. У реакціях атоми Оксигену приймають два електрони, утворюючи найчастіше частинку О-2 або, рідше, О22-: 2. Нітратна кислотаHNO3 є одним з найсильніших окисників. Вона окислює багато металів, а в суміші з хлоридною кислотою (царська горілка) здатна окислювати навіть малоактивні метали, наприклад золото. У реакціях може відновлюватися до нітроген діоксиду NO2, нітроген монооксиду NO, азоту N2,амоніаку NH3. 3. Концентрована сульфатна кислотаH2SO4 належить до числа досить сильних окисників, особливо при нагріванні. Проявляючи окисні властивості, сульфатна кислота найчастіше відновлюється до сульфур діоксиду SO2, а з більш сильними відновниками може відновлюватися до сірки S або до сірководню H2S. 4.Манган(ІV) оксид МnO2 використовують у лабораторних умовах при добуванні хлору з хлоридної кислоти. У реакціях відновлюється до іона Мангану Мn2+. 5. Калій перманганат КМnO4 є дуже сильним окисником і широко використовується в лабораторіях. Продукти відновлення КМnO4 залежать від середовища, в якому відбувається реакція. В основному відновлюється до калій манганату К2МnO4, манган(ІV) оксиду МnO2, іона Мангану Мn2+. 6. Калій хромат К2СrO4 та калій дихромат К2Сr2O7 широко використовують у лабораторіях. Продуктом відновлення є іон Хрому Сr3+. 7. Галогени(F2,Сl2, Вr2) та оксигеновмісні сполуки Хлору й Брому, наприклад КСlO4, КСlO3, КСlO,NaBrO3, NaBrO. Відновники Відновниками можуть бути частинки, які здатні віддавати електрони. До таких частинок належать: 1) нейтральні атоми металів та, в деяких випадках, неметалів; 2) негативно заряджені іони неметалів; 3) позитивно заряджені іони металів у проміжному ступені окиснення; 4) складні іони та молекули, що містять атоми елементів у проміжному ступені окиснення. МnO2 (Мn+4), МnО42- (Мn+6),SO32- i SO2 (S+4), СlO3- (Сl+5), СО (C+2),NO (N+2), NO2- (N+3). Складання рівнянь окисно-відновнихреакцій При складанні рівнянь ОВР дуже часто користаються методом електронного балансу та методом електронно-іонного балансу (метод напівреакцій). їх використовують для підбору стехіометричних коефіцієнтів у рівняннях ОВР. Метод електронного балансу Суть методу знаходження стехіометричних коефіцієнтів у рівняннях ОВР полягає в тому, щоб визначити ступені окиснення атомів елементів, які беруть участь в ОВР, і зрівняти число прийнятих та відданих електронів. При складанні електронного балансу можна дотримуватися такого алгоритму: 1. Записати реагенти й продукти реакції в молекулярному вигляді. 2. Визначити ступені окиснення всіх елементів, які входять до складу реагентів та продуктів реакції. 3. Визначити, які елементи змінюють ступені окиснення. 4. Записати рівняння окиснення та відновлення із зазначенням числа прийнятих і відданих електронів. 5. Знайти найменше спільне кратне для чисел відданих і прийнятих електронів й обчислити коефіцієнти, на які необхідно помножити рівняння окиснення та відновлення. 6. Записати сумарне рівняння окиснення й відновлення. 7.Розставити коефіцієнти у вихідному молекулярному рівнянні. Розгляньмо простий приклад відновлення ферум(ІІІ) оксиду чадним газом (карбон монооксидом). Продуктом реакції є залізо та карбон діоксид (вуглекислий газ):      8. Електроліз: поняття, сутність процесу, складання реакцій електролізу. Електроліз розчинів та розплавів електролітів Сукупність ОВР, які протікають на електродах у розчинах та розплавах електролітів при пропусканні через них електричного струму, називають електролізом. На підставі етимології слова можна сказати, що електроліз (від електро... і грец. лізіс — розклад) — це розклад під дією електричного струму. При проведенні електролізу на електроди накладається зовнішнє електричне поле, під дією якого відбуваються реакції. Під час електролізу електрична енергія перетворюється в хімічну. На катоді джерела струму відбувається процес передачі електронів катіонам з розчину або розплаву, тому катод є відновником. На аноді відбувається віддача електронів аніонами, тому анод є окисником. Під час електролізу як на аноді, так і на катоді можуть відбуватися конкуруючі реакції. При проведенні електролізу з використанням інертного (який не витрачається) електрода (наприклад, графіту або платини), як правило, у розчинах конкуруючими є два окисних і два відновних процеси: на аноді — окиснення аніонів і гідроксид-іонів, а на катоді — відновлення катіонів солей та іонів Гідрогену Н+. При проведенні електролізу з використанням активних (що витрачаються) електродів процеси ускладнюються: на аноді відбувається, окрім окиснення аніонів та гідроксид-іонов, також окиснення матеріалу анода (анодне розчинення); на катоді, окрім відновлення катіонів солей та іонів Н+, відбувається відновлення катіонів металу, що утворилися при розчиненні анода. Для того, щоб вибрати найбільш імовірний процес, необхідно виходити з тези, що протікає та реакція, яка вимагає найменшої затрати енергії. Це означає, що відновлюються найбільш активні окисники, а окислюються найбільш активні відновники. Електроліз розплавів солей Розгляньмо на прикладі розплаву натрій хлориду. У розплаві натрій хлориду наявні іони натрію Na+ і хлорид-іони Сl-. Іони Натрію прямують до негативно зарядженого катода, на якому протікає реакція: У свою чергу, хлорид-іони прямують до позитивно зарядженого анода, на якому віддають свої електрони, унаслідок чого протікає реакція: Сумарне рівняння реакції електролізу натрій хлориду має такий вигляд: Схематично процес електролізу розплаву натрій хлориду можна записати так: 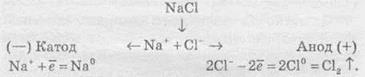 Сумарне рівняння реакції Електроліз розплавів використовують для добування високоактивних металів, які неможливо отримати за допомогою електролізу розчинів. Також широко розповсюджений електроліз алюміній оксиду, за допомогою якого в промисловості добувають алюміній: 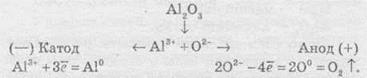 Сумарне рівняння реакції Електроліз розчинів електролітів Електроліз розплавів енергетично менш вигідний порівняно з електролізом розчинів, тому що більшість електролітів плавляться при високих температурах. Тому частіше користуються електролізом розчинів. При електролізі розчинів, на відміну від електролізу розплавів, може протікати велика кількість конкуруючих реакцій, тому при електролізі розчинів електролітів з інертним електродом дотримуються таких правил: 1. При електролізі розчинів, що містять аніони F-, SO42-, NO3-, РO43-, відбувається окиснення гідроксид-іонов, які завжди в тій або іншій кількості є у воді: 2. При окисненні галогенід-іонів утворюються вільні галогени: 3. При окисненні аніонів органічних кислот відбувається процес: 4. При електролізі розчинів солей, що містять катіони, розташовані в ряді активності металів лівіше алюмінію, на катоді виділяється водень унаслідок відновлення іонів Н+, які завжди є у водних розчинах, у результаті реакції: 5. При електролізі розчинів солей, що містять катіони, розташовані в ряді активності металів між алюмінієм та воднем, на катоді можуть протікати як конкуруючі процеси відновлення катіонів металів, так і виділення водню: 6. При електролізі розчинів солей, що містять катіони, розташовані в ряді активності металів правіше водню, відбувається відновлення катіонів металів. Розгляньмо кілька випадків електролізу водних розчинів різних солей. Найбільш простий випадок, коли сілі складається з іонів, які підлягають правилам 2 та 6. Наприклад, купрум(ІІ) хлорид. У цьому разі на катоді відновлюються іони Сu2+, а на аноді — Сl-.  Сумарне рівняння реакції У результаті електролізу на катоді виділяється металічна мідь, а на аноді — газуватий хлор. Якщо ж до складу солі входять іони активного металу, наприклад, натрій бромід, то на катоді відновлюються іони Н+ (правила 4 та 2): 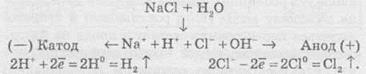 Сумарне рівняння реакції У результаті на катоді виділяється водень, на аноді — хлор, а в розчині залишаються іони Натрію та гідроксид-іони, утворюючи луг (порівняйте з продуктами електролізу розплаву натрій хлориду). Цей спосіб є одним із промислових способів добування лугів. Гідролізу може піддаватися тільки катіон із солі. Наприклад, у випадку електролізу ферум(ІІ) сульфату (правила 1 та 5): 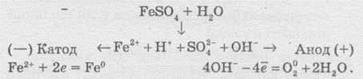 Сумарне рівняння реакції У результаті на катоді утворюється залізо (хоча побічним процесом також може бути виділення газуватого водню), на аноді виділяється газуватий кисень, а в розчині залишається сульфатна кислота. І, нарешті, випадок, коли ні катіон, ні аніон солі не піддається електролізу. Наприклад, калій нітрат (правила 1 та 4): 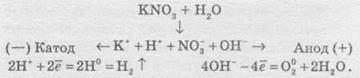 Сумарне рівняння реакції У цьому разі ні катіони металу, ні аніон оксигеновмісної кислоти не розряджаються. На катоді виділяється водень, а на аноді — кисень. Фактично електроліз розчину калій нітрату зводиться до електролітичного розкладу води. Розгляньмо також випадок електролізу купрум(ІІ) хлориду, тільки не з інертними електродами, а з активними. Якщо як електроди взяти мідні пластинки, то в цьому разі на катоді також буде виділятися мідь, а на аноді, де відбуваються процеси окиснення, замість розрядки хлоридіонів і виділення хлору протікає окиснення анода (міді). У цьому разі продукти окиснення анода — іони Сu2+ переходять у розчин, а досягаючи катода, осідають на ньому: 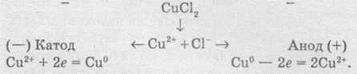 Таким чином, електроліз розчину купрум(ІІ) хлориду з розчинним анодом зводиться до окиснення матеріалу анода (його розчинення) й супроводжується перенесенням металу з анода на катод. У промисловості цей процес використовують для електрохімічного очищення (рафінування) міді. Один електрод у вигляді тонкого дроту виготовляють із хімічно чистої міді, а другий електрод роблять із болванок чорнової міді, отриманої при виплавці. Після підключення джерела електричного струму чорнова мідь (анод) розчиняється, а чиста мідь осідає на іншому катоді. У підсумку одержують мідь із досить високим ступенем очищення. 9. Вода в природі. Фізичні властивості, будова молекули води, роль водневого зв’язку. Твердість води та методи її пом’якщення. Вода́, Н2O — хімічна речовина у вигляді прозорої безбарвної рідини без запаху і смаку, (в нормальних умовах). В природі існує у трьохагрегатних станах — твердому (лід), рідкому (вода) і газоподібному (водяна пара). Молекула води складається з одного атома Оксигену і двох атомів Гідрогену. Атоми Гідрогену розташовані в молекулі так, що напрямки до них утворюють кут 104,45o із вершиною в центрі атома Оксигену. Таке розташування зумовлює молекулі води дипольний момент у 1,844 Дебая. При заміні атомів Гідрогену (протонів) на атомидейтерію утворюється модифікація, яка називається важкою водою. Вода — одна із найголовніших речовин, потрібних для органічного життя. Рослини та тварини містять понад 60 % води за масою. На Земліводою покрито 70,9% поверхні. Вона здійснює у природі постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у виглядіопадів. Вода має велике значення для економіки: сільського господарства й промисловості. Питна вода становить тільки 2,5% від загальної кількості. Нестача води може стати однією з найважчих проблем людства в найближчі десятиллітя. У ВсесвітіХімічні елементи, які входять до складу води, Гідроген і Оксиген, належать до найпоширеніших у природі. Утворення води з цих елементів відбувається там, де густина газів достатньо велика і зіткненням між атомами достатньо ймовірне. Вода виявлена в складі міжзоряних газових хмар, що лежать у межах нашої галактики - Чумацького Шляху. Вода належить до найпоширеніших речовин на Земній кулі[Джерело?]. Водою вкрито близько 2/3 поверхні земної кулі (океани, моря, озера,річки). Значна її кількість у вигляді льоду і снігу вкриває високі гори і величезні простори Арктики і Антарктиди. Багато води в атмосфері —пара, туман і хмари. Значні кількості води містяться і в земній корі у вигляді підземних вод. У природі вода перебуває не тільки у вільному стані, а і в хімічно зв'язаному. Вода входить до складу багатьох гірських порід і всіх рослинних і тваринних організмів. На воду припадає близько 60% маси тварин і до 80% маси риб. У деяких рослинах вміст води іноді перевищує 90% їхньої маси. Більшість запасів води на Землі знаходяться в морях і океанах, прісна вода становить 2,5-3% від загального об'єму гідросфери. |
