Неорганика. Закон сталості cкладу
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
Добування. У техніці азот добувають з рідкого повітря. Як відомо, повітря — це суміш газів, переважно азоту і кисню. Сухе повітря біля поверхні Землі містить (в об’ємних частках): азоту 78,09 %, кисню 20,95 %, благородних газів 0,93 %, оксиду карбону (IV) 0,03 %, а також випадкові домішки — пил, мікроорганізми, сірководень, оксид сульфуру (IV) та ін. Для добування азоту повітря переводять у рідкий стан, потім випаровуванням відокремлюють азот від менш леткого кисню (т. кип. азоту — 195,8, кисню — 183 °С). Добутий в такий спосіб азот містить домішки благородних газів (переважно аргону). Чистий азот можна добути у лабораторних умовах, розкладаючи під час нагрівання нітрит амонію: NH4NO2 = N2 ↑ + 2Н2О. Фізичні властивості. Азот — газ без кольору, запаху і смаку, легший за повітря. Розчиняється у воді гірше, ніж кисень: при 20 °С в 1 л води розчиняється 15,4 мл азоту (кисню — 31 мл). Тому в повітрі, розчиненому у воді, вміст кисню відносно азоту більший, ніж в атмосферному. Мала розчинність азоту у воді, а також його дуже низька температура кипіння пояснюються досить слабкими міжмолекулярними взаємодіями як між молекулами азоту і води, так і між молекулами азоту. Природний азот складається з двох стабільних ізотопів з масовими числами 14 (99,64 %) і 15 (0,36 %). Хімічні властивості. Молекула азоту складається з двох атомів. Довжина зв’язку між ними дуже мала — 0,109 нм. Потрійний зв’язок та його мала довжина роблять молекулу дуже міцною (енергія зв’язку 946 кДж/моль). Цим пояснюється мала реакційна здатність азоту при звичайній температурі (порівняти зO2 і Сl2). При кімнатній температурі азот безпосередньо сполучається тільки з літієм: 6Li + N2 = 2Li3N. Нітрид літію З іншими металами він реагує лише при високій температурі, утворюючи нітриди. Наприклад: ЗСа + N2 = Са3N2; 2Аl + N2 = 2AlN. Нітрид кальцію Нітрид алюмінію З воднем азот сполучається за наявності каталізатора, за високих тиску і температури: N2 + ЗН2 ⇆ 2NH3. При температурі електричної дуги (3 000—4 000 °С) азот сполучається з киснем: N2 + O2 ⇆2NO. Оскільки на зовнішньому енергетичному рівні атома нітрогену розташовано 5 електронів, нітроген виявляє ступені окиснення —3 і +5, а також +4, +3, +2, +1, —1 і —2. Застосування. У великих кількостях азот застосовується для добування аміаку. Широко використовується для створення інертного середовища — наповнення електричних ламп розжарювання і вільного простору у ртутних термометрах, при перекачуванні горючих рідин. Ним азотують поверхню стальних виробів, тобто насичують їх поверхню азотом за високої температури. У результаті в поверхневому шарі утворюються нітриди феруму, які надають сталі більшої твердості. Така сталь витримує нагрівання до 500°С без втрати своєї твердості. Велике значення азот має для життя рослин і тварин, оскільки він входить до складу білкових речовин. Сполуки нітрогену застосовуються у виробництві мінеральних добрив, вибухових речовин і в багатьох інших галузях промисловості. 25. Аміак, добування та властивості. Солі амонію. отримання, якісні реакції на іон-амонію. Будова молекули. Нітроген утворює з гідрогеном кілька сполук, з яких найважливішою є аміак. Електронна формула молекули аміаку така: 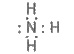 Видно, що з чотирьох електронних пар у нітрогену — три спільні (зв’язуючі) і одна неподілена (незв’язуюча). Будову молекули NH3 розглянуто раніше. Вона має форму піраміди. Хімічний зв’язокN—Н полярний: позитивний заряд зосереджений на атомах гідрогену, негативний — на атомі нітрогену. Внаслідок цього між молекулами аміаку утворюється водневий зв"язок,що можна зобразити так: 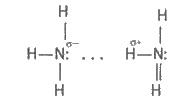 Внаслідок водневих зв"язків аміак має порівняно високі температури плавлення і кипіння, а також значну теплоту випаровування, він легко зріджується. Фізичні властивості. Аміак — безбарвний газ з характерним різким запахом, майже у два рази легший за повітря. При збільшенні тиску або охолодженні він легко зріджується у безбарвну рідину (температура кипіння —33,4°С). Аміак дуже добре розчиняється у воді (при 20°С в 1 об’ємі води розчиняється до 700 об’ємів NH3). Розчин аміаку у воді називається аміачною водою, або нашатирним спиртом. Під час кип’ятіння розчинений аміак звітрюється з розчину. Хімічні властивості. Велика розчинність аміаку у воді зумовлена утворенням водневих зв’язків між їх молекулами: 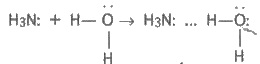 Однак, крім таких гідратів аміаку,1 частково утворюються іони амонію і гідроксид-іони: 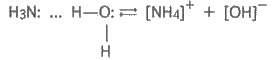 Гідроксид-іони зумовлюють слабколужну (їх мало) реакцію аміачної води. При взаємодії їх з іонамиNH+4 знову утворюються молекули NH3 і Н2О, сполучені водневим зв’язком, тобто реакція відбувається у зворотному напрямку. Утворення іонів амонію та гідроксид-іонів в аміачній воді можна зобразити рівнянням: NH3 + Н2О ⇆ NH3 ∙ Н2О ∙ NH+ + ОН-. В аміачній воді найбільша частина аміаку міститься у вигляді молекул NH3, рівновага зміщена в бік утворення аміаку, тому вона пахне аміаком. Незважаючи на це, водний розчин аміаку за встановленою традицією позначають формулою NH4OH 1 і називають гідроксидом амонію, а лужну реакцію розчину пояснюють дисоціацією молекул NH4OH: NH4OH ⇆NH+ + ОН- Оскільки в розчині аміаку у воді концентрація гідроксид- іонів невелика, гідроксид амонію належить до слабких основ. Отже, в реакції взаємодії аміаку з водою до молекули аміаку приєднується протон з води, внаслідок чого утворюється катіон амонію NH+4 і гідроксид-іон ОН . У катіоні амонію чотири ковалентних зв’язки, один з них утворений за донорно-акцепторним механізмом (див. § 3.1). Важливою хімічною властивістю аміаку є його взаємодія з кислотами з утворенням солей амонію. У цьому разі до молекули аміаку приєднується іон гідрогену кислоти, утворюючи іон амонію, що входить до складу солі: NH3 = НСl + NH4Cl; . NH3 + Н3РО4 = NH4H2PO4. З наведених прикладів випливає, що для аміаку характерна реакція приєднання протона. Аміак згоряє у кисні і в повітрі (попередньо підігрітому) з утворенням азоту і води: 4NH3 + 3О2 = 2N2 + 6Н2О. За наявності каталізатора (наприклад, платини, оксиду хрому(ІІІ)) реакція відбувається з утворенням оксиду нітрогену(ІІ) і води: 4NH3 + 5O2 = 4NO + 6Н2О. Ця реакція називається каталітичним окисненням аміаку. 1 Оскільки такої речовини немає, то всупереч традиції її можна зображати як гідрат NН3 ∙ Н2О або просто NН3 (без гідроксид-іона). Аміак — сильний відновник. При нагріванні він відновлює оксид купруму(ІІ), сам окиснюється до вільного азоту: +2 -3 0 0 ЗСuО + 2NH3 = ЗСu + N2 + ЗН2О; 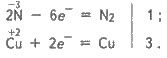 За допомогою цієї реакції можна добути азот в лабораторних умовах. Добування і застосування. В лабораторних умовах аміак звичайно добувають слабким нагріванням суміші хлориду амонію з гашеним вапном: 2NH4Cl+ Са (ОН)2 = СаСі2 + 2NH3 ↑ + 2Н2О. Ця реакція ґрунтується на зміщенні рівноваги взаємодії аміаку з водою при додаванні гідроксид-іонів: NH+ + ОН- ⇆ NH3 ↑ + Н2O. Основним способом добування аміаку у промисловості є його синтез з азоту і водню. Реакція екзотермічна і оборотна: N2 + ЗН2 ⇆ 2NH3, ∆ Н° = -92,4 кДж. Вона відбувається тільки за наявності каталізатора — губчастого заліза з домішками активаторів — оксидів алюмінію, калію, кальцію, силіцію (іноді й магнію). Вихідні продукти добувають: азот — з рідкого повітря, водень — конверсійним способом або з води (див. § 8.2). Великі кількості аміаку витрачаються для добування нітратної (азотної) кислоти, азотовмісних солей, сечовини, соди за аміачним методом. На легкому зрідженні і подальшому випаровуванні з поглинанням теплоти ґрунтується "його застосування в холодильній справі. Рідкий аміак та його водні розчини застосовують як рідкі добрива. Хімічні основи виробництва аміаку Теорія синтезу аміаку з простих речовин досить складна. Тут лише зазначаються оптимальні умови процесу, що ґрунтуються на принципі зміщення хімічної рівноваги. Оскільки ця реакція екзотермічна, то при зниженні температури рівновага зміщуватиметься в бік утворення аміаку. Однак при цьому значно зменшується швидкість реакції. Тому синтез аміаку доводиться вести при 500—550 °С і за наявності каталізатора. А оскільки каталізатор прискорює пряму і зворотну реакції однаково, а підвищення температури зміщує рівновагу в бік вихідних речовин, то ці умови невигідні для промислового виробництва. Отже, відповідно до принципу зміщення рівноваги для протидії впливу підвищеної температури необхідно використовувати високий тиск. Для синтезу аміаку застосовують тиск від 15 до 100 МПа. Залежно від тиску, який застосовують, розрізняють три способи виробництва синтетичного аміаку: низького (10—15 МПа), середнього (25—30 МПа) і високого (50—100 МПа) тиску. Найпоширенішим є середній. Негативно впливають на швидкість утворення аміаку шкідливі домішки: сірководень, оксид карбону (II), вода та ін. Вони знижують активність каталізатора. Для усунення цього впливу азотоводневу суміш старанно очищають, особливо від сірчистих сполук. Однак і за таких умов тільки частина азотоводневої суміші перетворюється на аміак. Для повнішого використання вихідних речовин аміак, що утворився, зріджують під дією низьких температур, а азотоводневу суміш, яка не прореагувала, знову направляють до реактора. Технологічний процес, при якому речовини, що не прореагували, відокремлюються від продуктів реакції і знову повертаються у реакційний апарат для подальшого використання, називається циркуляційним. За допомогою такої циркуляції використання азотоводневої суміші досягає 95 %. Синтез аміаку є найважливішим способом зв’язування атмосферного азоту. Схему виробництва синтетичного аміаку наведено на рис. 10.3. Суміш 3 об’ємів водню і 1 об’єму азоту всмоктується компресором 1 і стискається до необхідного тиску. Потім азотоводнева суміш подається до масловіддільника 2 (для видалення частинок масла) і фільтра 3, заповненого прожареним вугіллям. Очищена суміш направляється до контакт ного апарата 4 з каталізатором (губчасте залізо з домішками оксидів алюмінію, калію, кальцію, силіцію), де і відбувається утворення аміаку: 3/2 Н2 + 1/2 N2 ⇆ NH3, ∆ Н˚ = —46 кДж/моль. Перед пуском усієї системи контактний апарат нагрівають до 400—500°С, а потім температура в системі підтримується тією теплотою, яка виділяється під час реакції. Оскільки процес утворення аміаку оборотний, то газова суміш, що виходить з контактного апарата, містить лише 20—30 % аміаку. Цю суміш подають до трубчастого холодильника 5, де під тиском аміак зріджується. Азот і водень, що не вступили в реакцію, циркуляційним насосом знову нагнітаються в контактний апарат 4, а рідкий аміак збирається у збирачі 6. Солі амонію Солі амонію та їх властивості. Солі амонію складаються з катіона амонію та аніона кислоти. За будовою вони аналогічні відповідним солям однозарядних іонів металів. Солі амонію добувають при взаємодії аміаку або його водних розчинів з кислотами. Наприклад: NH3 + HNO3 = NH4NO3; NH3 ∙ Н2О + HNO3 = NH4NO3 + Н2О або в іонній формі: NH3 + Н+ = NH+4 NH3 ∙ Н2О + Н+ = NH+ + Н2О. Вони виявляють загальні властивості солей, тобто взаємодіють з розчинами лугів, кислот та інших солей: NH4Cl + NaON = NaCl + Н2О + NH3 ↑; 2NH4Cl (к) + H2SO4 = (NH4)sub>2SO4 + 2НСl ↑; (NH4)2SO4 + ВаСl2 = BaSO4↓ + 2NH4Cl. Всі амонійні солі при нагріванні розкладаються або сублімуються, наприклад: (NH4)2CO3 = 2NH3 ↑ + Н2О + СО2 ↑; NH4NO2 = N2 ↑ + 2Н2O; NH4Cl ⇆ NH3 ↑ + НСl ↑. Амонійні солі добре розчиняються у воді. У водних розчинах вони гідролізують. Тому розчини солей амонію сильних кислот мають кислу реакцію: NH+4 + Н2O ⇆ NH3 + Н3О+. Якісна реакція на іон амонію. Дуже важливою властивістю солей амонію є їх взаємодія з розчинами лугів. Цією реакцією виявляють солі амонію (іони амонію) за запахом аміаку, що виділяється, або за зміною забарвлення вологого лакмусового папірця з червоного на синє: NH4 + ОН- ⇆ NH3 ↑ + Н2O. Реакцію проводять так: у пробірку із сіллю або розчином, які аналізують, вводять розчин лугу і суміш обережно нагрівають. За наявності іона амонію виділяється аміак. 26. Нітратна кислота, властивості, отримання. Нітратна кислота Добування. У лабораторних умовах нітратну (азотну) кислоту добувають з її солей дією концентрованої сульфатної кислоти: KNO3 + H2SO4 = HNO3 + KHSO4. Реакція відбувається при слабкому нагріванні (сильне нагрівання розкладає HNO3). У промисловості нітратну кислоту добувають каталітичним окисненням аміаку, який, у свою чергу, утворюється при сполученні водню і азоту повітря. Відкриття промислового способу окиснення аміаку до нітратної кислоти належить інженеру-хіміку І. І. Андрєєву — засновнику азотної промисловості в Росії. Він запропонував застосовувати при окисненні аміаку киснем повітря каталізатор — платинову сітку — і реалізував цей спосіб спочатку на дослідній установці в Макіївці (1916), а потім на заводі в Донецьку (колишній Юзовці) (1917). Увесь процес добування нітратної кислоти можна розділити на три етапи: 1) окиснення аміаку на платиновому каталізаторі до NO: 4NH3 + 5O2 = 4NO + 6Н2О; 2) окиснення киснем повітря NO до NO2: 2NO + О2 = 2NO2; 3) поглинання NO2 водою при надлишку кисню: 4NO2 + 2Н2O + О2 = 4HNO3. Вихідні продукти — аміак і повітря — старанно очищають від шкідливих домішок, що отруюють каталізатор (сірководень, пил, масла тощо). За цим способом утворюється розведена (40—60 %-ва) кислота. Концентровану нітратну кислоту (96—98 %-ву) добувають перегонкою розведеної кислоти у суміші з концентрованою сульфатною кислотою. При цьому випаровується тільки нітратна кислота. Розведену нітратну кислоту зберігають і перевозять у тарі з хромистої сталі, концентровану — в алюмінієвій тарі. Невелику кількість її зберігають у скляних бутлях. Фізичні властивості. Нітратна кислота — безбарвна рідина з їдким запахом. Дуже гігроскопічна, “димить” на повітрі, оскільки її пара з вологою повітря утворює краплі туману. Змішується з водою у будь-яких співвідношеннях. Кипить при 86 °С. |
