Неорганика. Закон сталості cкладу
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
Амфотерні гідроксиди та відповідні їм кислоти й солі
ВИСНОВКИ Під амфотерністю розуміють здатність хімічної сполуки виявляти кислотні або основні властивості залежно від природи іншої сполуки, яка бере участь у кислотно-основній взаємодії. Амфотерна речовина, реагуючи з сильною кислотою, виявляє основні властивості, а реагуючи з сильною основою (лугом) — кислотні. Типовими амфотерними гідроксидами є Zn(OH)2, Ве(ОН)2, Аl(ОН)3, Сr(ОН)3 тощо. 33. Якісні реакції на іони металів. 34. Лужні метали: загальна характеристика, властивості, сполуки, застосування. Будова атомів лужних металів У зовнішньому електронному шарі атоми лужних металів мають по одному електрону. У передзовнішньому електронному шарі в атома Літію 2 електрони, а в атомів інших металів по 8 електронів. Однакова будова не тільки зовнішнього, але й передостаннього електронного шару атомів усіх лужних металів, окрім Літію, обумовлює велику подібність властивостей цих елементів. Водночас збільшення заряду ядра й загального числа електронів в атомі зі збільшенням порядкового номера, збільшення числа електронних шарів (збільшення радіуса) спричиняє деякі відмінності в їхніх властивостях (збільшення легкості віддачі валентних електронів, посилення металічних властивостей). Маючи в зовнішньому електронному шарі тільки по одному електрону, що перебуває на порівняно великій відстані від ядра, атоми цих елементів досить легко віддають електрон, тобто характеризуються низькою енергією іонізації. Утворювані при цьому однозарядні позитивні іони мають стійку електронну структуру відповідного інертного газу (Li+ → Не ; Na+ → Ne тощо). Легкість віддачі зовнішніх електронів характеризує розглядані елементи як найбільш типових представників металів: металічні властивості в лужних металів виражені дуже чітко. Загальні фізичні властивості лужнихметалів Усі лужні метали мають кубічну об’ємно-центровану кристалічну ґратку, яка не є щільно упакованою (атоми займають у ній лише 68 % наявного об’єму), тому всі лужні метали — легкі. Вони мають металічний блиск на свіжому зрізі металу. Лужні метали характеризуються незначною твердістю, малою густиною, низькими температурами кипіння й плавлення, що пояснюється слабкими хімічними зв’язками в кристалічних ґратках цих металів. Загальні хімічні властивості лужнихметалів Лужні метали належать до числа найбільш активних у хімічному відношенні елементів. На свіжому зрізі лужні метали мають блискучу поверхню, однак, вступаючи в контакт із киснем повітря, вони окислюються й швидко тьмяніють, тому в разі потреби їх зберігають під шаром гасу. Усі лужні метали горять в атмосфері повітря, утворюючи оксиди одного або кількох типів — нормальні оксиди складу Ме2О, пероксиди складу Ме2О2 та супероксиди МеО2. При цьому тільки літій згорає на повітрі з утворенням оксиду: 4Li + О2 = 2Li2О, а інші лужні метали утворюють пероксиди й супероксиди (або їхню суміш): 3Na + 2О2 = Na2О2 + NaО2. Оксиди Натрію й Калію можуть бути отримані тільки при нагріванні суміші пероксиду з надлишком металу за відсутності кисню: К2О2 + 2К = 2K2O. Легко віддаючи в хімічних реакціях свої валентні електрони, лужні метали є енергійними відновниками. Усі лужні метали сполучаються з воднем при нагріванні, утворюючи гідриди: 2Ме + Н2 = 2МеН. При взаємодії з галогенами, сіркою, азотом, фосфором, вуглецем та кремнієм утворюються відповідно галогеніди, сульфіди, нітриди, фосфіди, карбіди та силіциди. При взаємодії лужних металів з водою утворюються луги й водень: 2Ме + 2Н2О = 2МеОН + Н2. Активність металів зростає згори вниз за групою. Із кислотами всі лужні метали реагують із вибухом, тому такі реакції спеціально не проводять. Солі лужних металів розчиняються у воді, за винятком деяких солей Літію: фториду, карбонату та фосфату. Якщо внести в полум’я газового пальника сіль лужного металу, то вона розкладається, і пари вивільненого металу забарвлюють полум’я в характерний для даного металу колір. Калій забарвлює полум’я у фіолетовий колір, Натрій — у жовтий, а Літій — у малиновий. Леткі солі Рубідію та Цезію забарвлюють безбарвне полум’я пальника в рожево-фіолетовий колір. 35. Характеристика металів головної підгрупи; кальцій, магній. Властивості елементів та їх сполуки. Фізичні властивості металів . Для всіх металів характерний металічний блиск, звичайно сірий колір і непрозорість, що пов’язано з наявністю вільних електронів. Той факт, що метали мають хорошу електричну провідність, пояснюється наявністю в них вільних електронів, які під впливом навіть невеликої різниці потенціалів набувають направленого руху від негативного полюса до позитивного. З підвищенням температури посилюється коливання атомів (іонів), що утруднює напрямлений рух електронів і тим самим призводить і до зменшення електричної провідності. За низьких температур коливання, навпаки, сильно зменшується і електрична провідність різко зростає. Найбільшу електричну провідність мають срібло і мідь. За ними йдуть золото, алюміній, залізо. Поряд з мідними виготовляють і алюмінієві електричні проводи. До речі, зазначимо, що у неметалів, яким властива провідність, з підвищенням температури електрична провідність зростає, що зумовлено збільшенням числа вільних електронів за рахунок розриву ковалентних зв’язків. При низьких же температурах неметали струм не проводять внаслідок відсутності вільних електронів. В цьому головна відмінність між фізичними властивостями металів і неметалів. Різна густина металів. Вона тим менша, чим менша атомна маса елемента-металу і чим більший радіус його атома. Найлегший з металів — літій (густина 0,53 г/см3), найважчий — осмій (густина 22,6 г/см3). Як уже зазначалося, метали з густиною менш як 5 г/см називаються легкими, решта — важкими. Різноманітні температури плавлення і кипіння металів. Найбільш легкоплавкий метал — ртуть, її температура плавлення — 38,9°С, цезій і галій плавляться відповідно при 29,0 і 29,8°С. Вольфрам — найбільш тугоплавкий метал, температура його плавлення З 390°С. Він застосовується для виготовлення ниток електроламп. Метали, які плавляться при температурі понад 1 000°С, називають тугоплавкими, при нижчій — легкоплавкими. Значну відмінність в температурах плавлення і кипіння слід пояснювати відмінністю в міцності хімічного зв’язку між атомами в металах. Дослідження показали, що в чистому вигляді металічний зв’язок характерний лише для лужних та лужноземельних металів. Хімічні властивості металів Атоми металів порівняно легко віддають валентні електрони і перетворюються на позитивно заряджені іони. Тому метали є відновниками. В цьому, власне, і полягає їх головна і найзагальніша хімічна властивість. Очевидно, метали як відновники вступатимуть в реакції з різними окисниками, серед яких можуть бути прості речовини, кислоти, солі менш активних металів та деякі інші сполуки. Сполуки металів з галогенами називаються галогенідами, із сульфуром — сульфідами, з нітрогеном — нітридами, з фосфором — фосфідами, з карбоном — карбідами, з силіцієм — силіцидами, з бором — боридами, з гідрогеном — гідридами і т. д. Багато з цих сполук знайшли важливе застосування в новій техніці. Наприклад, бориди металів використовуються в радіоелектроніці, а також у ядерній техніці як матеріали для регулювання нейтронного випромінювання та захисту від нього. Взаємодія металів з кислотами —окисно-відновний процес. Окисником є іон гідрогену, який приймає електрон від атома металу: 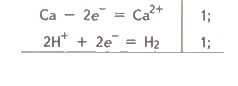 Са + 2Н+ = Са2+ + Н2. Взаємодію металів з водними розчинами солей менш активних металів можна показати на прикладі: Ni + CuSO4 = NiSO4 + Cu; 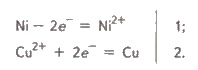 У цьому випадку відбувається відщеплення електронів від атомів більш активного металу (Ni) і приєднання їх іонами менш активного (Cu2+). Активні метали взаємодіють з водою, яка виступає в ролі окисника. Наприклад: 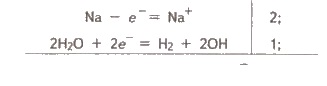 2Na + 2H2O = 2Na+ + 2OH + Н2↑. Метали, гідроксиди яких амфотерні, як правило, взаємодіють з розчинами і кислот, і лугів. Наприклад: Be + 2НСl = ВеСl2 + Н2; Be + 2NaOH + 2Н2О = Na2[Be(OH)4] + H2↑. Отже, характер взаємодії металів з неметалами, кислотами, розчинами солей менш активних металів, водою і лугами підтверджує їх головну хімічну властивість — відновну здатність. 36. Окисні властивості хрому (VI), мангану(VII) . Оксид хром у (VI) СrО3 — темно-червона кристалічна речовина. Сильний окисник: окиснює йод, сірку, фосфор, вугілля, перетворюючись при цьому на Сr2О3. Наприклад: 3S + 4СrО3 = 3SO2 + 2Сr2О3. При нагріванні до 250°С розкладається: 4СrО3 = 2С3О2 + 3O2. Добувають його взаємодією концентрованої сульфатної кислоти з насиченим розчином дихромату натрію або калію: К2Сr2О7 + H2SO4 = 2СrО3 ↓ + K2SO4 + Н2О. СrО3 має кислотний характер: легко розчиняється у воді, утворюючи хроматні кислоти. З надлишком води утворює хроматну кислоту Н2СrO4: СrО3 + Н2О = Н2СrO4. При великій концентрації СrО3 утворюється дихроматна кислота Н2Сr2О7: 2СrО3 + Н2O = Н2СrO7, яка при розведенні переходить у хроматну кислоту: Н2Сr2О7 + Н2O = 2Н2СrO4. Хроматні кислоти існують тільки у водному розчині. Однак їх солі дуже стійкі. Якщо порівняти гідроксиди хрому з різним ступенем окиснення +2 +3 +6 Сr(OН)2, Сr(ОН)3 та Н2СrO4, то легко дійти висновку, що зі зростанням ступеня окиснення основні властивості гідроксидів слабшають, а кислотні — посилюються. Сr(ОН)2 виявляє основні властивості, Сr(ОН)3 — амфотерні, а Н2СrO4 — кислотні. | |||||||||||||||||||||||||||||||||||||||||
