Неорганика. Закон сталості cкладу
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
БРОМБРОМ (Br) - хімічний елемент VII групи періодичної системи Менделєєва, відноситься до галогенів, атомний номер 35, атомна маса 79,904; червоно-бура рідина із сильним неприємним заходом. Бром відкритий в 1826 французьким хіміком А. Ж. Баларом при вивченні розсолів соляних промислів; названий від грецького bromos — сморід. Природний бром складається з 2 стабільних ізотопів 79Br (50,34%) і 81Br (49,46%). Зі штучно отриманих радіоактивних ізотопів брому найцікавіший 80Вr, на прикладі якого И. В. Курчатовим відкрите явище ізомерії атомних ядер. Зміст брому в земній корі (  % по масі) оцінюється в 1015-1016 т. У головній своїй масі бром перебуває в магматичних породах, а також у широко розповсюджених галогенідах. Бром - постійний супутник хлору. Бромисті солі (NaBr, KBr, MgBr2) зустрічаються у відкладеннях хлористих солях (у кухоній солі до 0,03% Br), а також у морській воді (0,065% Br), ропі соляних озер (до 0,2% Br) і підземних розсолах, звичайно пов'язаних із соляними й нафтовими родовищами (до 0,1% Br). Завдяки гарній розчинності у воді бромисті солі накопляються в залишкових розсолах морських й озерних водойм. Бром мігрує у вигляді легко розчинних з'єднань, дуже рідко утворюються тверді мінеральні форми, представлені броміритом AgBr, емболітом Ag (Сl, Br) і йодемболітом Ag (Сl, Вr, I). Утворення мінералів відбувається в зонах окислювання сульфідних срібло-утримуючих родовищ, що формуються в посушливих пустельних областях. % по масі) оцінюється в 1015-1016 т. У головній своїй масі бром перебуває в магматичних породах, а також у широко розповсюджених галогенідах. Бром - постійний супутник хлору. Бромисті солі (NaBr, KBr, MgBr2) зустрічаються у відкладеннях хлористих солях (у кухоній солі до 0,03% Br), а також у морській воді (0,065% Br), ропі соляних озер (до 0,2% Br) і підземних розсолах, звичайно пов'язаних із соляними й нафтовими родовищами (до 0,1% Br). Завдяки гарній розчинності у воді бромисті солі накопляються в залишкових розсолах морських й озерних водойм. Бром мігрує у вигляді легко розчинних з'єднань, дуже рідко утворюються тверді мінеральні форми, представлені броміритом AgBr, емболітом Ag (Сl, Br) і йодемболітом Ag (Сl, Вr, I). Утворення мінералів відбувається в зонах окислювання сульфідних срібло-утримуючих родовищ, що формуються в посушливих пустельних областях.2. Застосування галогенів та їх найважливіших сполук ЙОД Сировиною для промислового одержання йоду служать нафтові бурові води, морські водорості, а також маткові розчини чилійської (натрієвої) селітри, що містять до 0,4% йоду у вигляді йодату натрію. Йод і його з'єднання застосовують головним чином у медицині й в аналітичній хімії, а також в органічному синтезі й фотографії. У промисловості застосування йоду поки незначно по обсягу, але досить перспективно. Так, на термічному розкладанні йодидів засноване одержання високоочисних металів. ХЛОР Однією з важливих галузей хімічної промисловості є хлорна промисловість. Основні кількості хлору переробляються на місці його виробництва. Xлор - один з біогенних елементів, постійний компонент тканин рослин і тварин. Вміст хлору в рослинах (багато хлору в галофітах) - від тисячних часток відсотка до цілих відсотків, у тварин - десяті й соті частки відсотка. Добова потреба дорослої людини в хлорі, (2 - 4 г) покривається за рахунок харчових продуктів. З їжею хлор надходить звичайно в надлишку у вигляді хлориду натрію й хлориду калію. Особливо багаті хлором хліб, м'ясні й молочні продукти. В організмі тварин хлор - основна осмотично-активна речовина плазми крові, лімфи, спинномозкової рідини й деяких тканин. Відіграє роль у водно-сольовому обміні, сприяючи втриманню тканинами води. Регуляція кислотно-лужної рівноваги в тканинах здійснюється поряд з іншими процесами шляхом зміни в розподілі хлору між кров'ю й іншими тканинами, хлор бере участь в енергетичному обміні в рослин. Xлор позитивно впливає на поглинання коріннями кисню. Xлор необхідний для утворення кисню в процесі фотосинтезу ізольованими хлоропластами. До складу більшості живильних для середовищ штучного культивування рослин хлор не входить. Можливо, для розвитку рослин достатньо досить малі концентрації хлору. ФТОРДжерелом для виробництва фтору служить фтористий водень, що виходить в основному або при дії сірчаної кислоти H2SO4 на флюорит Ca2, або при переробці апатитів і фосфоритів. Широке застосування одержали численні з'єднання фтору - фтористий водень, алюмінію фторис), кремне-фториди, фторсульфована кислота (розчинник, каталізатор, реагент для одержання органічних сполук, що містять групу - SO2F), ВF3 (каталізатор), фторорганічні з'єднання й ін. Біологічна роль фтору вивчена недостатньо. Установлено зв'язок обміну фтору з утворенням кісткової тканини кістяка й особливо зубів. Необхідність фтору для рослин не доведена. Препарати, що містять фтор, застосовують у медичній практиці в якості захисту від пухлин (5-фторурацил, фторафур, фтор-бензотеф), нейроліптичних (трифлу-перидол, або триседил, фторфеназин, трифтазин й ін.), антидепресивних (фторацизин), наркотичних (фторотан) і інших засобів. БРОМ Вихідною сировиною для одержання брому служать морська вода, озерні й підземні розсоли, що містять бром у вигляді броміду-іону Вг-. Бром застосовують досить широко. Він - вихідний продукт для одержання ряду бромистих солей й органічних похідних. Більші кількості брому витрачають для одержання бромистого етилу й діброметану - складових частин етилової рідини, що додає до бензинів для підвищення їхньої детонаційної стійкості. З'єднання брому застосовують у фотографії, при виробництві ряду барвників, бромистий мітив і деякі інші з'єднання брому - як інсектициди. Деякі органічні сполуки брому служать ефективними протипожежними засобами. Бром і бромну воду використають при хімічних аналізах для визначення багатьох речовин. У медицині використовують броміди натрію, калію, амонію, а також органічні з'єднання брому, які застосовують при неврозах, істерії, підвищеній дратівливості, безсонні, гіпертонічній хворобі, епілепсії й хореї. Бром - постійна складова частина тканин тварин і рослин. Наземні рослини містять у середньому 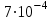 % брому на сиру речовину, тварини % брому на сиру речовину, тварини  %. Бром знайдений у різних секретах (сльозах, слині, поті, молоці, жовчі). У крові здорової людини вміст брому коливається від 0,11 до 2,00 мг. За допомогою радіоактивного брому (82Br) установлене поглинання його щитовидною залозою, мозковим шаром бруньок і гіпофізом. Введені в організм тварин і людини броміди підсилюють концентрацію процесів гальмування в корі головного мозку, сприяють нормалізації стану нервової системи, що постраждала від перенапруги гальмівного процесу. Одночасно, затримуючись у щитовидній залозі, бром вступає в конкурентні відносини з йодом, що впливає на діяльність залози, а у зв'язку із цим - і на стан обміну речовин. %. Бром знайдений у різних секретах (сльозах, слині, поті, молоці, жовчі). У крові здорової людини вміст брому коливається від 0,11 до 2,00 мг. За допомогою радіоактивного брому (82Br) установлене поглинання його щитовидною залозою, мозковим шаром бруньок і гіпофізом. Введені в організм тварин і людини броміди підсилюють концентрацію процесів гальмування в корі головного мозку, сприяють нормалізації стану нервової системи, що постраждала від перенапруги гальмівного процесу. Одночасно, затримуючись у щитовидній залозі, бром вступає в конкурентні відносини з йодом, що впливає на діяльність залози, а у зв'язку із цим - і на стан обміну речовин.20. Підгрупа Оксигену, загальна характеристика. Властивості кисню, алотропні модифікації. Отримання. Загальна характеристика підгрупи оксигену До підгрупи оксигену входять п’ять елементів: оксиген, сульфур, селен, телур і полоній (полоній — радіоактивний елемент). Це р-елементи VI групи періодичної системи Д. І. Менделєєва. Вони мають групову назву — халькогени, що означає “ті, що утворюють руди”. Таблиця 9.1. Властивості елементів підгрупи оксигену
Оксиген і його властивості Поширення в природі. Оксиген — найпоширеніший на Землі елемент. Він становить 47,2 % маси земної кори. Його вміст у повітрі становить 20,95 % за об’ємом або 23,15 % — за масою. Оксиген входить до складу води, гірських порід, багатьох мінералів і солей, міститься у білках, жирах і вуглеводах, з яких складаються живі організми. Добування. У лабораторних умовах кисень добувають електролізом водного розчину гідроксиду натрію (електроди нікелеві) або розкладом при нагріванні бертолетової солі (хлорату(V) калію) чи перманганату калію. Розклад хлорату калію значно прискорюється за наявності оксиду мангану(ІV) МnО2: 2КСlO2 = 2КСl + 3O2 ↑. Дуже чистий кисень утворюється при розкладі перманганату калію: 2КМnO4 = К2МnО4 + МnО2 + O2 ↑ . У промисловості кисень добувають із рідкого повітря, а також при добуванні водню електролізом води. Кисень зберігають і перевозять у стальних балонах під тиском до 15 МПа (мегапаскаль). Фізичні властивості. Кисень — газ без кольору, смаку і запаху, трохи важчий за повітря. У воді розчиняється мало (в 1 л води при 20 °С розчиняється 31 мл кисню). При температурі —183°С і тиску 101,325 кПа кисень переходить у рідкий стан. Рідкий кисень має блакитний колір, втягується в магнітне поле. Природний оксиген містить три ізотопи: 168O (99,76 %), 178O (0,04 %) і 188O (0,20 %). Хімічні властивості. До завершення зовнішнього електронного рівня атому оксигену не вистачає двох електронів. Енергійно приєднуючи їх, атом оксигену виявляє ступінь окиснення —2. Однак у сполуках з флуором (OF2 і O2F2) спільні електронні пари зміщені до флуору, як до більш електроне гативного елемента. У цьому випадку ступені окиснення оксигену відповідно дорівнюють +2 і +1, а флуору —1. Молекула кисню складається з двох атомів O2. Хімічний зв’язок у ній — ковалентний неполярний. Молекула озону складається з трьох атомів оксигену О3. Озон — це алотропічна модифікація елемента оксигену. Хоча кисень і озон утворені одним і тим самим елементом, властивості їх різні. Озон— газ із характерним запахом. Руйнує органічні речовини, окиснює багато металів, у тому числі золото і платину; він сильніший окисник, ніж кисень. Температура киснево-ацетиленового полум’я досягає З 500°С, киснево-водневого — З 000°С. У медицині кисень застосовується для полегшення дихання хворих (кисневі подушки і палатки). Він використовується в кисневих приладах під час виконання робіт у важкій для дихання атмосфері (підземні й підводні роботи, висотні й космічні польоти тощо). 21. Оксиди та гідроксиди. їх класифікація. Хімічні властивості. Оксиди — складні речовини, утворені двома елементами, одним із яких є Оксиген. Їх назва складається зі слова «оксид» з додаванням спочатку назви елемента, що входить до складу речовини, у називному відмінку. Класифікація оксидів 1) Оксиди, яким відповідають основи, називаються основними. Вони утворені металами. До них належать CuO, 2) Оксиди, яким відповідають кислоти, називаються кислотними. Вони утворені в основному неметалами. Це Поширення оксидів у природі Оксиди широко поширені в природі. Наприклад, силіцій(IV) оксид Вода як найважливіший природний оксид Фізичні властивості води. Чиста вода прозора, не має запаху і смаку. Найбільша її густина — при Хімічні властивості води. 1) Взаємодія з металами. Метали, що стоять у ряді напруг до Алюмінію включно, реагують із водою за звичайних умов: Метали, що стоять у ряді напруг від Мангану до Гідрогену, реагують із водою при нагріванні: Метали, що стоять у ряді напруг після Гідрогену, з водою не реагують. 2) Вода реагує з оксидами металів, якщо метали, що утворюють оксиди, знаходяться в ряді напруг до Магнію. При цьому утворюються луги, тобто розчинні у воді основи: 3) Вода реагує з багатьма оксидами неметалів, внаслідок реакції утворюються розчинні кислоти: 4) Вода розкладається під дією високої температури або електричного струму: |
