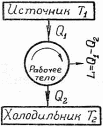
Термодинамика. Термоебаника. Закон теплопроводности. Гипотеза Фурье. 4 1 Изображение основных термодинамических процессов на диаграмме pv. 5
 Скачать 3.87 Mb. Скачать 3.87 Mb.
|
3)Оцените процессы теплообмена при разогреве воды в чайнике на огне. Назовите участок наибольшего термического сопротивления.Билет 61)Истечение газа из сосуда неограниченной ёмкости. Критическая скорость. Критическое отношение давления2)Стационарная теплопроводность в плоской стенке.Однородная плоская стенка (Рис.9.2.). 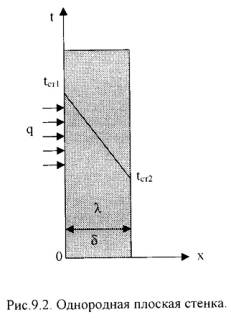 Температуры поверхностей стенки –tст1 и tст2. Плотность теплового потока: q = -λ∙ ∂t/∂n = - λ∙ ∂t/∂x = - λ∙ (tcт2 - tcт1)/(xcт2 - xcт1)∙ или q = λ∙ (tcт2 - tcт1)/(xcт2 - xcт1)∙ Dt/Dx (9.13) Тогда q = λ/δ∙(tст1 – tст2) = λ/δ∙Δt, (9.14) Если R =δ/λ -термическое сопротивление теплопроводности стенки [(м2∙К)/Вт], то плотность теплового потока: q = (tст1 – tст2)/R . (9.15) Общее количество теплоты, которое передается через поверхность F за время τ определяется: Q = q∙F∙τ = (tст1 – tст2)/R·F∙τ . (9.16) Температура тела в точке с координатой х находится по формуле: tx = tст1 – (tст1 – tст2)∙x/ δ . (9.17) 2).Многослойная плоская стенка. Рассмотрим 3-х слойную стенку (Рис.9.3). Температура наружных поверхностей стенокtст1 и tст2, коэффициенты теплопроводности слоевλ1, λ2, λ3, толщина слоевδ1, δ2, δ3. 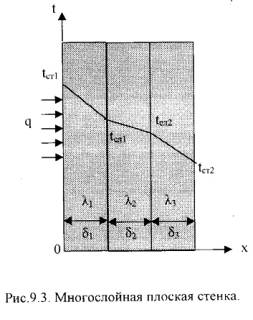 Плотности тепловых потокок через каждый слой стенки: q = λ1/δ1∙(tст1 – tсл1) , (9.18) q = λ2/δ2∙(tсл1 – tсл2) , (9.19) q = λ3/δ3∙(tсл2 – tст2) , (9.20) Решая эти уравнения, относительно разности температур и складывая, получаем: q = (t1 – t4)/(δ1/λ1 + δ2/λ2 + δ3/λ3) = (tст1 – tст4)/Ro , (9.21) где: Ro = (δ1/λ1 + δ2/λ2 + δ3/λ3) – общее термическое сопротивление теплопроводности многослойной стенки. Температура слоев определяется по следующим формулам: tсл1 = tст1 – q∙(δ1/λ1). (9.22) tсл2 = tсл1 – q·δ2/λ2). (9.23) 3)В трубе течет жидкость при турбулентном режиме течения. Как изменится коэффициент теплоотдачи, если диаметр канала увеличить в 3 раза?Ответ: Билет 2 3 задача Билет № 71)Основные закономерности течения газа через сопла и диффузоры.Билет № 81)Второй закон термодинамики.второй закон термодинамики, устанавливающий, возможен или невозможен тот или иной процесс, в каком преимущественно направлении он будет протекать, когда система достигнет динамического равновесия, и при каких условиях работа системы максимальна. Различные формулировки 2-го закона термодинамики: Р. Клаузиус: Невозможен процесс, при котором теплота самопроизвольно переходила бы от холодных тел к телам нагретым. (Теплота не может сама собой переходить от холодного тела к горячему). В. Томсон (Кельвин): Не вся теплота, полученная от теплоотдатчика (нагревателя), может перейти в работу, а только часть её, другая часть должна перейти в теплоприёмник. (Теплоту какого-либо тела невозможно превратить в работу, не производя никакого другого действия, кроме охлаждения тела). М. Планк: Невозможно построить периодически действующую машину, которая производила бы только поднятие груза и охлаждение источника теплоты. В. Оствальд: Невозможно создать вечный двигатель второго рода. Л. Больцман: Природа стремится от состояний менее вероятных к более вероятным. С. Карно: Для перевода теплоты в работу необходимо наличие, кроме источника теплоты, охладителя более низкой температуры, т.е. необходим температурный перепад. И другие: - самопроизвольные (естественные) процессы необратимы; - энтропия изолированной системы стремится к максимуму; - теплота наиболее холодного тела в данной системе не может служить источником работы; - в круговом процессе теплота источника не может быть полностью превращена в работу, честь теплоты неизбежно должна быть отдана холодным источникам; - энергия изолированной системы деградирует. Необратимые (самопроизвольные) процессы протекают от неустойчивого, неравновесного состояния к устойчивому, равновесному. Обратный процесс, например, переход теплоты от холодного тела к нагретому осуществить можно, но для этого необходимо затратить внешнюю работу, и, следовательно, этот процесс не будет самопроизвольным.
|

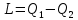 . Из него следует, что ТД-2 не только вскрывает особенность теплоты при превращении в работу, но и устанавливает, от
. Из него следует, что ТД-2 не только вскрывает особенность теплоты при превращении в работу, но и устанавливает, от