Микробиология полости рта. Занятие 1 микрофлора полости рта, её состав и характеристика (микрофлора зубной бляшки, слюны, десневых карманов)
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
Специфические факторы антимикробной резистентности, действующие в полости рта (гуморальные и клеточные) Как уже упоминалось, иммунологическая резистентность обеспечивается тканями и клетками иммунной системы. Иммунная система ротовой полости связана с лимфоидной тканью, в которой различают структурированную и диффузную составляющие. Первая включает в себя единичные некапсулированные фолликулы, а также такие организованные формирования, как миндалины. Вторая составляющая представлена единичными клетками, инфильтрирующими эпителиальные пласты слизистых оболочек (Т-лимфоциты) и собственную пластинку (lamina propria), а также подслизистый слой (преимущественно В-лимфоциты). Миндалины (глоточные и нёбные) представляют собой скопления лимфоидной ткани между слизистой оболочкой, формирующей крипты, и соединительнотканным слоем, который служит источником кровоснабжения миндалин. Лимфоциты в миндалинах находятся в фолликулах и межфолликулярном пространстве. Здесь преобладают В-лимфоциты, несущие в качестве рецептора IgA. Диффузная лимфоидная ткань слизистой оболочки представлена лимфоцитами собственной пластинки (lamina propriа) и межэпителиальными лимфоцитами. Лимфоциты собственной пластинки на 80% представлены В-клетками, несущими на поверхности IgA, а также плазмоцитами, которые в своей цитоплазме содержат IgA. Межэпителиальные лимфоциты - это почти исключительно Т-клетки, основная масса которых в условиях антигенной стимуляции дифференцируется в направлении Тh2-хелперов и обеспечивает развитие гуморального иммунного ответа. Кроме того, в слизистых оболочках содержатся два типа нелимфоидных клеток, выполняющих иммунологические функции: дендритные клетки и сами эпителиальные клетки. Дендритные клетки слизистых оболочек обладают выраженной способностью связывать антиген, но низкой способностью представлять его Т-лимфоцитам. Активация этих клеток происходит или после миграции в лимфатические узлы, или местно в условиях воспаления. Эпителиальные клетки в покоящемся состоянии не имеют признаков иммуноцитов, однако в условиях воспаления способны представлять антиген Т-хелперам и стимулировать пролиферацию Т-цитотоксических клеток. Таким образом, на поверхности слизистой оболочки полости рта определяются практически все основные популяции иммунокомпетентных клеток: Т- и В-лимфоциты, плазматические клетки. В ротовой жидкости и секретах обнаруживаются иммуноглобулины различных классов и медиаторы иммунного ответа - интерлейкины. На уровне слизистой оболочки, подслизистого слоя полости рта и лимфоидного аппарата челюстно-лицевой области в той или иной степени реализуются все стадии и механизмы иммунного ответа. Процессинг и презентация антигена осуществляется фагоцитирующими клетками полости рта, прежде всего, макрофагами-моноцитами и фибробластами, благодаря наличию у них ферментов, расщепляющих крупные белково-полисахаридные молекулы на отдельные фрагменты, несущие специфические антигенные детерминанты - эпитопы. Эпитопы фиксируются на МНС белках 2 класса, синтезируемых в этих клетках, и выводятся на мембрану макрофага. В нормальной ткани десны число макрофагов составляет около 2% всех клеток, а в десневой жидкости достигает 18%. Антигенраспознающая функция, с которой начинается стадия иммунорегуляции, реализуется за счёт специфических рецепторов к антигену, которые есть у Т-хелперов и других лимфоидных клеток, находящихся на слизистой и в подслизистом слое полости рта. Если говорить об эффективности механизмов клеточного иммунитета в полости рта, то стоит напомнить, что нормальные лейкоциты в значительной степени теряют свою активность при контакте с гипотонической слюной. Аналогичной инактивации подвергаются, вероятно, и лимфоциты. В связи с этим эффективно осуществлять цитотоксические функции в полости рта могут лишь сенсибилизированные клетки, не контактирующие со слюной и выходящие в отграниченные от внешней среды участки слизистой оболочки полости рта. Гуморальный иммунный ответ в слизистых оболочках ротовой полости формируется, прежде всего, путем синтеза IgA. Как уже упоминалось, в подслизистом слое и собственной пластинке слизистых оболочек существуют оптимальные условия для IgA-ответа, т.к. 80% антителообразующих клеток секретируют этот Ig. В полости рта первичный контакт с антигеном, его обработка и активация В-лимфоцитов происходят в организованных структурах (миндалинах). Здесь антиген распознают В-лимфоциты, несущие на мембране IgA. В результате взаимодействия с Тh2-хелперами В-клетки трансформируются в бласты и поступают в рециркуляцию. В-бласты попадают в региональный лимфатический узел, где испытывают дополнительное стимулирующее действие со стороны Тh2-клеток, и вновь оказываются в рециркуляции. Достигнув собственной пластинки, В-клетки дозревают здесь до стадии плазмоцитов и секретируют IgA-антитела - мономерные и димерные. Мономеры IgA поступают в кровоток и становятся сывороточными иммуноглобулинами А. Димеры взаимодействуют с рецепторами эпителиоцитов слизистого слоя и, связав его, проникают внутрь этих клеток. Здесь рецептор подвергается частичной деградации, в результате которой в составе молекулы IgA остаётся фрагмент рецептора - секреторный компонент. В таком виде секреторный IgA (sIgA) выделяется на поверхность слизистой оболочки. Здесь sIgA связывает антигены на поверхности слизистых оболочек и обеспечивает активацию комплемента по классическому пути, подавляет адгезию бактерий, нейтрализует вирусы и препятствует всасыванию антигенов через слизистую оболочку полости рта (рис. 3). 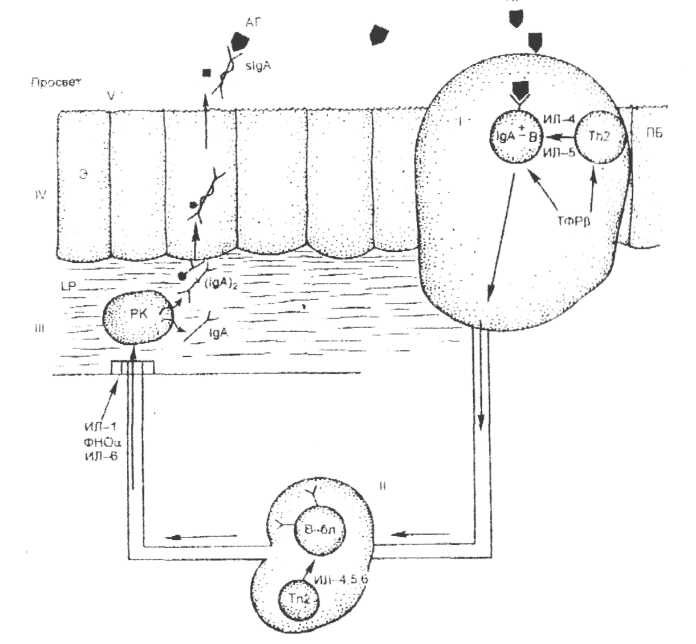 Рис. 3. Развитие секреторного IgA-ответа (по А.А. Ярилину, 1999): I. Структурированное лимфоидное образование (миндалины). II. Регионарный лимфоузел. III. Собственная пластинка слизистой оболочки (lamina propria). IV. Эпителиоциты слизистого слоя. V. Просвет - взаимодействие slgA с антигеном sIgA характеризуется повышенной устойчивостью к действию протеолитических ферментов, содержащихся в секретах, а его концентрация в слюне в 1000 раз выше, чем в сыворотке крови.  Рис. 4. Структура секреторного Ig A. Помимо sIgA свою активность в слюне могут сохранять и иммуноглобулины других классов (G и М), которые являются дополнительными специфическими антибактериальными и противовирусными защитными факторами. Однако основную защитную функцию выполняет sIgA, активность которого на слизистых оболочках в 10 раз превышает активность IgG. Иммунологическая память реализуется за счёт коротко- и долгоживущих субпопуляций Т- и В-клеток памяти, которые находятся в тканях десны и пародонта, в лимфоузлах челюстно-лицевой области. Наличие данных клеток обеспечивает быстрое развитие вторичного иммунного ответа по гуморальному типу на слизистой оболочке. При повторном контакте с антигеном IgA-клетки памяти быстро поступают в собственную пластинку, где превращаются в плазмоциты и начинают секретировать IgA-антитела. Таким образом, очевидно, что основная роль в специфической защите полости рта принадлежит гуморальным иммунным механизмам. Проявления реакций гиперчувствительности в полости рта Аллергия - состояние патологически повышенной чувствительности организма к повторному введению антигена в результате неадекватной реакции иммунной системы. Иммунные механизмы, обеспечивающие защиту организма, могут приводить к повреждению тканей, реализуясь в виде реакций гиперчувствительности. По скорости проявления и механизму аллергические реакции можно разделить на две группы - аллергические реакции (или гиперчувствительность) немедленного типа (ГНТ) и замедленного типа (ГЗТ). Аллергические реакции гуморального (немедленного) типа обусловлены главным образом функцией антител классов IgG и особенно IgE (реагинов). ГНТ характеризуется быстрым развитием после контакта с аллергеном (минуты). ГНТ делят на три типа. Тип 1. Анафилактические реакции - немедленного типа, атопические, реагиновые. Они вызываются взаимодействием поступающих извне аллергенов с антителами класса IgE, фиксированными на поверхности тучных клеток и базофилов. Реакция сопровождается активацией и дегрануляцией клеток-мишеней с высвобождением медиаторов аллергии (главным образом гистамина). Примеры реакций 1 типа - анафилактический шок, атопическая бронхиальная астма, атопический дерматит, развивающиеся в ответ на введение лекарственных препаратов (например, при обезболивании новокаином). Тип 2. Цитотоксические реакции. В них участвуют цитотоксические антитела (IgM и IgG), которые связывают антиген на поверхности клеток, активируют систему комплемента и фагоцитоз, приводят к развитию антитело-зависимого клеточно-опосредованного цитолиза и повреждения тканей. Пример – цитотоксические реакции при лекарственной аллергии. Тип 3. Реакции иммунных комплексов. Комплексы антиген-антитела откладываются в тканях (фиксированные иммунные комплексы), активируют систему комплемента, привлекают к месту фиксации иммунных комплексов полиморфноядерные лейкоциты, приводят к развитию воспалительной реакции. В качестве аллергена могут выступать бактериальные, вирусные и медикаментозные антигены. Примеры – пародонтопатии (язвенно-некротический гингивит, пародонтоз), феномен Артюса (клинически проявляется в виде острого некротически геморрагического воспаления), постгерпетическая многоморфная эритрема. Гиперчувствительность замедленного типа (ГЗТ) - клеточно- опосредованная гиперчувствительность или гиперчувствительность типа 4, связанная с наличием сенсибилизированных лимфоцитов. Эффекторными клетками являются Т-лимфоциты. Они распознают чужеродные антигены и секретируют различные лимфокины, стимулируя цитотоксичность макрофагов, усиливая Т- и В-иммунный ответ, вызывая возникновение воспалительного процесса. Сенсибилизацию Т-клеток могут вызывать агенты контактной аллергии (гаптены), антигены бактерий, вирусов, грибов, простейших. Примеры - инфекционная ГЗТ при бруцеллезе, туберкулезе, актиномикозе кандидозе и др.; контактная аллергия (лекарственные стоматиты – акриловые смолы, рентгенконтрастные вещества, протезы и др.); пародонтопатии; язвенно-некротический стоматит. Рецидивирующий афтозный стоматит относится к иммунопатологиям со смешанным типом аллергии, при котором наблюдаются реакции гиперчувствительности II, III и IV типов при наличии аутоиммунного процесса. Заболевание отличается хроническим течением и характеризуется периодическими ремиссиями и обострениями. На слизистых оболочках рта появляются афты, которые изъязвляются. Обычно это заболевание продолжается в течение всей жизни больного, с наиболее типичными проявлениями в возрасте 20-40 лет. В этиологии и патогенезе афтозного стоматита существенное значение имеют проявления ГЗТ к ряду бактериальных антигенов, в первую очередь к стрептококку, стафилококку, кишечной палочке и другим антигенам или одновременно к нескольким бактериальным антигенам. Из афт при рецидивирующем афтозном стоматите, кроме бактерий, могут быть выделены вирусы простого герпеса и аденовирусы, которые также вызывают состояние гиперчувствительности. При развитии рецидивирующего афтозного стоматита особую роль играют аутоантигены, накапливающиеся при определенных условиях в тканях слизистой оболочки рта. Сама афта представляет собой клеточный инфильтрат, состоящий из лимфоцитов, что соответствует иммуноморфологии аллергической реакции ГЗТ, индуцированной к антигенам микроорганизмов полости рта. Занятие № 6. МЕТОДЫ ИЗУЧЕНИЯ МИКРОФЛОРЫ ПОЛОСТИ РТА. Вопросы для самоподготовки: Особенности забора исследуемого материала из полости рта (ротовая жидкость, зубная бляшка, содержимое десневого желобка, пародонтального кармана, кариозной полости, корневых каналов и др.). Методы микробиологической диагностики заболеваний полости рта Условия транспортировки материала от больного анаэробной инфекцией. Информационный материал Характеристика методов микробиологической диагностики Выбор того или иного метода микробиологического исследования зависит от характера предполагаемого у больного патологического процесса, свойств возбудителя, места его максимальной концентрации и способов выделения из организма, а также интенсивности образования специфических антител против возбудителя в различные фазы заболевания. В современной клинико-лабораторной службе для постановки микробиологического диагноза в распоряжении врача имеется 6 методов диагностики: 1. Микроскопический (бактериоскопический, вирусоскопический). 2. Бактериологический (вирусологический). 3. Серологический. 4. Аллергологический. 5. Биологический. 6. Молекулярно-биологический. Микроскопические методы применяют для обнаружения бактерий, грибов и простейших в патологическом материале, взятом от больного, с помощью обработки специальными красителями (или в нативном препарате) под микроскопом. Ввиду того, что многие патогенные и условно-патогенные микроорганизмы, а также грибы и простейшие имеют внешнее сходство, микроскопические методы диагностики в чистом виде являются в большинстве случаев лишь ориентировочными и не дают основания для постановки окончательного диагноза. Бактериологические методы включают в себя выделение чистой культуры возбудителя с последующей идентификацией его по морфологическим, тинкториальным, культуральным, биохимическим, антигенным и ряду других свойств. При этом возможно установить чувствительность выделенного агента к тем или иным химиотерапевтическим препаратам. Бактериологический метод является основным для постановки этиологического диагноза при большинстве инфекционных заболеваний, внутрибольничных инфекций, бактериальных осложнений. Серологические методы основаны на обнаружении антител в сыворотке крови (серодиагностика) или антигенов в исследуемом материале (иммунохимический метод). Ввиду того, что иммунитет при большинстве инфекционных болезней развивается только с 5-7 дня, а максимальное нарастание титра антител в сыворотке крови происходит лишь в периоде реконвалесценции, серологические методы менее пригодны для ранней диагностики и используются, главным образом, в целях ретроспективного распознавания этиологии уже перенесённого инфекционного процесса. Однако кровь для серологического исследования берётся обязательно в первые дни поступления (первые дни болезни), чтобы в дальнейшем иметь возможность наблюдения за нарастанием титра антител в динамике. Повторные серологические исследования при бактериальных инфекциях проводятся не раньше чем через 5-7 дней. При вирусных заболеваниях берутся «парные сыворотки» с интервалом 2 недели. Нарастание титра антител не менее, чем в 3-4 раза подтверждает диагноз заболевания. Обнаружение антигенов в исследуемом материале (иммунохимический метод) позволяет достаточно быстро и точно поставить диагноз. Аллергологический метод направлен на выявление повышенной чувствительности организма к специфическому аллергену, которым является возбудитель заболевания. В основе метода лежит феномен гиперчувствительности I и IV типов. Биологический метод диагностики инфекционных заболеваний, основанный на заражении лабораторных животных, применяется в случаях, когда выделение возбудителя на питательных средах затруднено или невозможно в силу биологических особенностей микроорганизмов, либо, когда необходимо выявить факторы патогенности микроорганизмов (капсулы, токсин и т.д.). Молекулярно-биологический метод диагностики (ПЦР, гибридизация ДНК и др.) основан на обнаружении и идентификации нуклеиновой кислоты возбудителя. Этот метод позволяет быстро и точно поставить диагноз даже при небольшом содержании возбудителя в исследуемом материале. Общие правила забора и транспортировки проб для бактериологического исследования При взятии и транспортировке материала для проведения микробиологического исследования необходимо соблюдать ряд общих правил: 1. Брать материал до начала антибактериальной терапии или через 10-12 часов после отмены препарата. 2. Брать материал непосредственно из очага инфекции или исследовать соответствующее отделяемое (гной из фистулы, мокроту при пневмонии, мазки с миндалин при ангине и т.д.). 3. Брать материал во время наибольшего содержания в нём возбудителей заболевания. 4. Соблюдать строжайшую асептику во избежание загрязнения пробы микрофлорой окружающей среды. 5. Материал для выделения аэробов и факультативных анаэробов берут стерильными ватными тампонами (отделяемое из раны, мазки со слизистых оболочек, из глаз, носа, зева), шприцем (кровь, гной, экссудат), непосредственно в стерильную посуду. Материал для выделения строгих анаэробов получают из патологического очага путём пункции шприцем, из которого предварительно удаляют воздух; при исследовании кусочков тканей их берут из глубины очага и моментально погружают в транспортную среду. При необходимости использования тампонов, их сразу же после взятия материала также погружают в транспортную среду. 6. Количество материала должно быть достаточным для проведения исследования и для его повторения в случае необходимости. 7. Транспортировку нативного клинического образца в лабораторию следует производить в максимально короткие сроки (не позднее, чем через 2 часа от момента взятия пробы), т.к. это определяет эффективность микробиологического исследования. При длительном хранении материала происходит гибель наиболее требовательных к питательным веществам видов микробов, начинают размножаться менее требовательные и быстро растущие виды, что приводит к нарушениям количественного соотношения видов, и дезориентирует врача-микробиолога при интерпретации полученных результатов. Всё же, если материал нельзя в ближайшие 2-3 часа транспортировать в лабораторию, хранить его следует в холодильнике, используя консервирующие или транспортные среды (кроме проб крови и ликвора). 8. Клинические образцы для культивирования строгих анаэробов следует транспортировать в лабораторию, максимально защищая их от воздействия кислорода воздуха. Используют специальные флаконы, заполненные газом, не содержащим кислорода. Уколом иглы через резиновую крышку, плотно завальцованную, во флакон вносят исследуемый материал. Материал можно транспортировать прямо в шприце, на кончик которого надета стерильная пробка. Транспортировку материала осуществляют также в транспортных средах, например, в смеси 10% лизированной крови донора, 10% глицерина и 80% изотонического раствора хлорида натрия. Недопустимо транспортировать пробирки, шприцы и флаконы с патологическим материалом, взятым от больного, прямо в руках. Всю посуду, содержащую материал для микробиологического исследования, транспортируют в специально предназначенных для этого биксах, пеналах и т.д. 9. К клиническому образцу, направляемому в лабораторию, прилагают сопроводительный документ, содержащий основные сведения, необходимые для проведения микробиологического исследования (характер материала, фамилия, имя и отчество больного, название учреждения или отделения, номер истории болезни, предполагаемый диагноз заболевания, предшествующая антимикробная терапия, дата и время взятия материала, фамилия врача, направляющего материал на исследование). |
