нормофлора полости рта. Занятие 1 микрофлора полости рта, её состав и характеристика (микрофлора зубной бляшки, слюны, десневых карманов)
 Скачать 423.65 Kb. Скачать 423.65 Kb.
|
|
Профилактика кариеса Для профилактики кариеса разрабатывается ряд направлений: Применение антимикробных веществ. Применение сахарозаменителей (следствие – уменьшение образования молочной кислоты). Разработка вакцины. Профилактика кариеса может быть направлена на уменьшение количества кариесогенных микроорганизмов в полости рта. Механическое удаление зубных бляшек нецелесообразно, поскольку на очищенную поверхность сразу же оседают новые бактериальные клетки, что приводит к быстрому восстановлению микрофлоры. Более эффективно применение различных бактерицидных и бактериостатических препаратов. Хорошие результаты получают с помощью антисептиков, в частности 0,2% хлоргексидина. При этом количество клеток S. mutans в зубных бляшках снижается на 80-85%, а в слюне на 55%. Покрывая зубную поверхность, хлоргексидин не только оказывает на микроорганизмы бактерицидное действие, но и препятствует их адгезии, нарушая при этом микробное равновесие. Угнетающим действием на микроорганизмы обладает фтор и его соединения, особенно соли ZnF2 и CuF2, а также пятиатомный спирт - ксилит, который нарушает процесс гликолиза у бактерий. Для профилактики кариеса используют химические ингибиторы, подавляющие определенные метаболические реакции у S. mutans. Например, фтор угнетает действие ферментов, участвующих в процессе гликолиза, к которым относятся: фосфатазы, эндолазы и фосфоглицеромутазы. Это приводит к торможению кислотообразования. Подобным действием обладает Н-лаурилсаркозинат и гидроацетат натрия. Другой путь снижения кислотообразования и накопления глюканов - замена сахарозы другими углеводами, например, соединениями ксилита, при ферментативном расщеплении которых эти продукты не образуются. Основной защитный механизм местного иммунитета полости рта при кариесе состоит в способности секреторного IgA препятствовать адгезии S. mutans. Признание ведущей роли микробов группы "мутанс" в качестве этиологического агента кариеса позволило осуществить опыты по получению препаратов для иммунизации против кариеса (убитые вакцины, очищенные белки клеточной стенки, рибосомальные антигены, глюкозилтрансфераза, ДНК). Исследования, проведённые как на животных, так и на людях - добровольцах, показали определённую эффективность такой вакцинации. Продемонстрирована также защита от кариеса в результате пассивной передачи секреторного IgA и сывороточного IgG. Недостатки вакцинации: эти микробы содержат перекрёстные антигены с тканями сердца, почек, скелетных мышц человека и животных, что может обусловить различные патологические реакции аутоиммунного характера; ввиду общности антигенов стрептококков группы "мутанс" с другими оральными стрептококками выработка антител к St. mutans может привести к нарушению микробного биоценоза в полости рта. Рассматриваются также возможности создания вакцин против Actinomycis viscosus , принимающего активное участие в патогенезе кариеса. Микробиологические методы изучения микрофлоры при кариесе и его осложнениях. Исследование микрофлоры при кариесе проводят при помощи бактериоскопического и бактериологического методов. Материалом для исследования могут служить зубная бляшка, материал из кариозной полости, ротовая жидкость. Методические указания Особенности забора исследуемого материала при кариесе. Исследование зубной бляшки Перед снятием зубного налета необходимо провести тщательную гигиеническую обработку полости рта, используя различные механические методы и контролируя обработку определением индекса гигиены. С этой целью пользуются специальными красящими растворами, определяя зону зубного налета. При исследовании зубной бляшки необходимо учитывать: методику забора бляшки с поверхности зуба; методику дисперсии материала бляшки; методику микроскопического подсчета и подсчета выживаемости микробов при культивировании. Методика взятия материала зубной бляшки Бляшка, расположенная на доступной гладкой поверхности зуба (щечная, язычная), может быть снята путем соскабливания обычным стерильным инструментом: экскаватором, скейлером. Для снятия бляшки с проксимальных поверхностей можно использовать стерильную нитку. Бляшку из ямок, фиссур можно получить острым зондом или заостренной ортодонтической проволокой. В некоторых случаях материал берут маленькими стерильными ватными тампонами. Однако из-за плотности прилипания бляшки и трудности ее снятия этот способ годится только для изучения начальной стадии колонизации микробов на эмали. Наддесневую зубную бляшку можно снять стерильными экскаватором или скейлером. Для бактериологического исследования материал должен быть сразу после забора помещен в транспортную питательную среду с целью сохранения жизнеспособности микробов. Полученный материал взвешивается на аналитических весах с последующим разведением от 1:100 до 1:1000 и посевом на питательные среды. Методика дисперсии материала бляшки Точность определения количества и видов бактерий в бляшке зависит от тщательности дисперсии материала. Можно разбивать конгломераты бляшки путем встряхивания со стеклянными бусами в гомогенизаторе, обработкой материала в ультразвуковых дезинтеграторах. Однако ультразвук может вызвать гибель некоторых бактерий: особенно чувствительны к ультразвуковой обработке спирохеты и некоторые грамнегативные бактерии. В связи с этим обработку ультразвуком обычно проводят в течении 10 сек. Микроскопический подсчет, подсчет выживаемости микробов при культивировании Примой микроскопический подсчет суспензированных микробов можно осуществлять в камере Горяева.  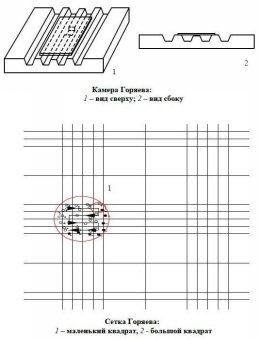 Рис. 2. Камера Горяева - это приспособление предназначенное для подсчета количества клеток в заданном объеме жидкости. Можно также изучать материал в темном поле или фазово-контрастном микроскопировании. Подсчет жизнеспособных клеток из взятого образца проводят методом серийных разведений в стерильном физиологическом растворе (1:10, 1:20 и так далее). Из каждого разведения определенный объем засевают на поверхность плотной среды. После инкубации подсчитывают количества КОЕ (колониеобразующие единицы) и пересчитывают количество на исходный объем. Успех метода зависит от использования подходящих питательных сред и условий культивирования, так как большая часть резидентов является строгими анаэробами и микроаэрофилами. Низкую высеваемость микробов можно объяснить недостаточной дисперсией, прилипанием микробов к поверхности стекла при приготовлении разведений и неудачным подбором питательной среды. Забор материала из кариозной полости Сначала из кариозной полости стерильным бором убирают поверхностные слои размягченного дентина, смоченного слюной. Не допуская попадания в исследуемый материал слюны, другим стерильным бором обрабатывают полость и помещают дентин с помощью стерильной гладилки в транспортную среду. Забор ротовой жидкости Ротовую жидкость обычно у больных утром (9-11 час.) через 2 часа после приема пищи собирают в течение 10 мин в стерильные пробирки. Эту слюну называют нестимулированной. Стимулированную слюну получают после нанесения на спинку языка 1-2 капель стерильного 2% раствора лимонной кислоты или жевания 5 г. парафина в течении 30 сек. Паротидную слюну получают путем введения в проток специальной стерильной канюли. Ротовая жидкость собирается в стерильную пробирку, исследуется 0,1 мл. Контрольные вопросы Что такое кариес? Каков механизм образования зубной бляшки? Охарактеризуйте патогенез кариеса. Какие микроорганизмы называют кариесогенными? Какова роль микроорганизмов различных групп в возникновении развитии кариеса? Какие основные направления профилактики кариеса Вы знаете? В чем недостаток разработанных вакцин против кариеса? Какой материал следует забрать для изучения микрофлоры при кариесе? Список литературы Обязательная: Борисов Л.Б. Медицинская микробиология, вирусология, иммунология. – М.: ООО «Медицинское информационное агентство», 2001. – 736 с. Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология: Учебник для мед. вузов. – СПб.: СпецЛит, 2002. – 591 с. Поздеев О.К. Медицинская микробиология / Под ред. В.И. Покровского. – М.: ГЭОТАР-Медиа, 2005. – 768 с. Дополнительная: Ахременко Я.А. Микробиология полости рта: Учебное пособие для студентов стоматологических факультетов. – Якутск: Изд-во Якутского госуниверситета, 2008. – 107 с. Зеленова Е.Г., Заславская М.И., Салина Е.В., Рассанов СП. Микрофлора полости рта: норма и патология: Учебное пособие. Нижний Новгород: Издательство НГМА, 2004. - 158с. Микробиология, вирусология и иммунология: учеб. для студентов мед. вузов / под ред. В. Н. Царёва. — М.: Практическая медицина, 2009. — 581 с.: ил. Практикум лабораторных работ с иллюстрированными ситуационными заданиями по микробиологии, иммунологии и вирусологии / под ред. А.А. Воробьева, В.Н. Царева. – М.: ООО « Медицинское информационное агентство», 2008. – 320 с.: ил. Занятие № 3. МИКРОБИОЛОГИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА Цели: рассмотреть роль резистентной микрофлоры при заболеваниях пародонта; познакомиться с особенностями микробиологической диагностики заболеваний пародонта. Знать: особенности состава микрофлоры при заболеваниях пародонта, свойства «пародонтопатогенных» микроорганизмов, механизм и условия возникновения заболеваний пародонта, микробиологические методы изучения микрофлоры при пародонтопатиях. Уметь: забирать материал для следования микрофлоры при заболеваниях пародонта. Обоснование темы: микроорганизмы – резиденты полости рта играют ведущую роль в развитии заболеваний пародонта. Вопросы для самоподготовки: Основные представители резидентной микрофлоры при отсутствии патологии тканей пародонта. Особенности состава микрофлоры при гингивите. Особенности состава микрофлоры при пародонтите. Пародонтопатогенные микробы (Porphyromonas gingivalis, Prevotella melaninogenica). Доказательства их участия в патогенезе заболевания. Механизм и условия возникновения заболеваний пародонта Методы изучения количественного и качественного состава микрофлоры десневого желобка и пародонтальных карманов. ПЛАН Программа: Микрофлора здорового пародонта. Болезни пародонта. Определение, классификация. Изучение свойств пародонтопатогенных микроорганизмов. .Микрофлора при гингивите. Микрофлора при пародонтите. Механизм и условия возникновения заболеваний пародонта. Методы изучения микрофлоры при заболеваниях пародонта. Демонстрация: 1. Мазки пародонтопатогенных видов микроорганизмов. Задание студентам: 1. Разобрать механизмы развития заболеваний пародонта и зарисовать схемы развития иммунных реакций (обратимая и необратимая фазы). Информационный материал Микрофлора пародонта при отсутствии патологий Ткани здорового пародонта связаны с довольно ограниченной флорой, расположенной под десной на поверхности зуба. Микробы пародонта составляют слой толщиной от 1 до 20 клеток. Исследование в области десневого желобка выявило довольно тонкий слой (около 60 нм.), состоящий на 3/4 из грамположительных кокков. Вместе с палочками они составляют 90% популяции. Спирохеты встречаются редко - около 1,8%. Соотношение подвижных форм к неподвижным составляет в здоровых тканях – 1/49. В десневом желобке бляшка состоит в основном из грамположительных факультативных анаэробных кокков (стрептококки, в меньших количествах - стафилококки, пептострептококки) и палочек (актиномицеты: A. israelii, A. naeslundii, A. viscosus, A. odontolyticus, а также пропионибактерии). Болезни пародонта. Определение, классификация Болезни пародонта – это разнородная группа заболеваний воспалительной и обменно-дистрофической природы, сопровождающихся разрушением тканей десны, включая коллагеновую основу периодонта и кости альвеолярного отростка. К заболеваниям пародонта относят: Гингивит (локальное воспаление десны). Пародонтит (прогрессирующий воспалительный процесс с деструкцией тканей пародонта и кости). Пародонтоз (преимущественно дистрофическое поражение тканей пародонта). Пародонтомы (опухолевые и опухолеподобные процессы тканей пародонта). Воспалительные заболевания пародонта (гингивит и пародонтит) широко распространены среди населения: 60-70% после 30 лет и 85-97% - после 65, и являются ведущей причиной потери зубов у большинства взрослых. Пародонтопатогенные микробы В патогенезе воспалительных заболеваний пародонта имеется взаимодействие двух патогенетических механизмов: воздействие анаэробной микрофлоры и иммунологической реактивности организма человека. Согласно рекомендациям ВОЗ 1994-1995 гг., среди резидентной микрофлоры полости рта с анаэробным типом дыхания следует выделять т.н. пародонтопатогенные виды, которые отличаются от других высокими адгезивными, инвазивными и токсическими свойствами по отношению к тканям пародонта. К ним относятся: Грамнегативные анаэробные бактерии группы бактероидов (Porphyromonas gingivalis, Prevotella melaninogenica, Tannerella forsythensis (ранее Bacteroides forsythus)), в меньшей степени - спирохеты и фузобактерии. Грампозитивные анаэробные бактерии группы актиномицетов, в меньшей степени - пептострептококки. Доказано, что развитие пародонтита наиболее часто ассоциируется с увеличением количества и персистенцией в тканях пародонта следующих видов бактерий: Porphyromonas gingivalis, Tannerella forsythensis (ранее Bacteroides forsythus), Aggregatibacter (ранее Actinobacillus) actinomycetemcomitans. Это пародонтопатогенные виды 1-го порядка. Они обладают высокой степенью адгезии к эпитериальным клеткам и коагрегации с грамположительными бактериями. Prevotella intermedia, Treponema denticola, Actinomyces israelii, Peptococcus niger, Peptostreptococcus micros и др. относятся к пародонтопатогенным видам 2-го порядка и оказывают действие при значительном увеличении числа микроорганизмов. Эксперименты на различных животных, в том числе на гнотобионтах, показали, что бактероиды полости рта (Porphyromonas gingivalis, Prevotella melaninogenica и др.) являются необходимым фактором для начала воспалительного процесса. Грамотрицательные бактерии, выделенные из пародонтального кармана, вызывали у животных резорбцию альвеолярной кости, тогда как грамположительные бактерии вызывали лишь образование большого количества зубного налёта и незначительную резорбцию кости. Пародонтопатогенные микроорганизмы обладают широким спектром факторов патогенности, что позволяет им индуцировать длительный воспалительный процесс. К ним относят: Факторы адгезии - способность прилипать в большом количестве к эпителиальным клеткам, гидроксиапатиту и к грамположительным бактериям. Их адгезивные свойства ингибируются в присутствии слюны и сыворотки крови. Однако способность к коагрегации с грамположительными бактериями при этом не ингибируется. Факторы инвазии – продукция гистолитических ферментов: гиалуронидаза, ДНК-аза, РНК-аза, коллагеназа, протеаза. Токсические факторы – грамотрицательные бактерии содержат эндотоксин, вырабатывают цитотоксические субстанции, включающие жирные кислоты, индол, амины, аммиак и др. Все эти вещества в той или иной степени оказывают разрушающее действие на ткани пародонта. Бактероиды выделяют летучие серные соединения, которые увеличивают проницаемость слизистой полости рта. Кроме того, благодаря содержанию специфических липополисахаридов, грамотрицательные микробы могут явиться причиной иммунопатологических механизмов, которые приводят к деструкции костной ткани. Такими свойствами in vitro обладают некоторые виды бактероидов, фузобактерии и др., что было установлено с помощью реакций бласттрансформации лимфоцитов. Протективные свойства, т.е. способность противодействовать защитным силам макроорганизма. Это свойство обеспечивается полисахаридной капсулой грамотрицательных микробов, ферментами, способными расщеплять иммуноглобулины и фракции комплемента. Многие виды бактероидов способны продуцировать ферменты, инактивирующие антибиотики, что затрудняет лечение. Микрофлора при гингивите Общее число микробов при гингивите в 10-20 раз больше, чем в здоровом пародонте. Ещё до появления клинических симптомов микроскопия позволяет выявить изменения состава микрофлоры: увеличение грамотрицательной флоры и смена кокковой флоры палочковидными формами. В этом смысле доклиническую фазу воспалительных заболеваний пародонта можно рассматривать как своеобразный дисбактериоз, к которому ведут неправильный образ жизни, обменные нарушения в тканях пародонта, эндокринные дисфункции. При длительном гингивите поддесневая флора характеризуется увеличением количества грамотрицательных палочек: фузобактерии, бактероиды и др. составляют около 45% всей культивируемой флоры. Грамположительные факультативно-анаэробные палочки, в основном, Actinomyces naeslundii, A. viscosus, A. israelii обнаруживаются с частотой около 25%. В небольших количествах выделяются пропионибактерии и эубактерии. В 27% случаев обнаруживаются грамположительные факультативно-анаэробные стрептококки. |
