нормофлора полости рта. Занятие 1 микрофлора полости рта, её состав и характеристика (микрофлора зубной бляшки, слюны, десневых карманов)
 Скачать 423.65 Kb. Скачать 423.65 Kb.
|
|
Общие правила забора и транспортировки проб для бактериологического исследования При взятии и транспортировке материала для проведения микробиологического исследования необходимо соблюдать ряд общих правил: Брать материал до начала антибактериальной терапии или через 10-12 часов после отмены препарата. Брать материал непосредственно из очага инфекции или исследовать соответствующее отделяемое (гной из фистулы, мокроту при пневмонии, мазки с миндалин при ангине и т.д.). Брать материал во время наибольшего содержания в нём возбудителей заболевания. Соблюдать строжайшую асептику во избежание загрязнения пробы микрофлорой окружающей среды. Материал для выделения аэробов и факультативных анаэробов берут стерильными ватными тампонами (отделяемое из раны, мазки со слизистых оболочек, из глаз, носа, зева), шприцем (кровь, гной, экссудат), непосредственно в стерильную посуду. Материал для выделения строгих анаэробов получают из патологического очага путём пункции шприцем, из которого предварительно удаляют воздух; при исследовании кусочков тканей их берут из глубины очага и моментально погружают в транспортную среду. При необходимости использования тампонов, их сразу же после взятия материала также погружают в транспортную среду. Количество материала должно быть достаточным для проведения исследования и для его повторения в случае необходимости. Транспортировку нативного клинического образца в лабораторию следует производить в максимально короткие сроки (не позднее, чем через 2 часа от момента взятия пробы), т.к. это определяет эффективность микробиологического исследования. При длительном хранении материала происходит гибель наиболее требовательных к питательным веществам видов микробов, начинают размножаться менее требовательные и быстро растущие виды, что приводит к нарушениям количественного соотношения видов, и дезориентирует врачамикробиолога при интерпретации полученных результатов. Всё же, если материал нельзя в ближайшие 2-3 часа транспортировать в лабораторию, хранить его следует в холодильнике, используя консервирующие или транспортные среды (кроме проб крови и ликвора). Клинические образцы для культивирования строгих анаэробов следует транспортировать в лабораторию, максимально защищая их от воздействия кислорода воздуха. Используют специальные флаконы, заполненные газом, не содержащим кислорода. Уколом иглы через резиновую крышку, плотно завальцованную, во флакон вносят исследуемый материал. Материал можно транспортировать прямо в шприце, на кончик которого надета стерильная пробка. Транспортировку материала осуществляют также в транспортных средах, например, в смеси 10% лизированной крови донора, 10% глицерина и 80% изотонического раствора хлорида натрия. Недопустимо транспортировать пробирки, шприцы и флаконы с патологическим материалом, взятым от больного, прямо в руках. Всю посуду, содержащую материал для микробиологического исследования, транспортируют в специально предназначенных для этого биксах, пеналах и т.д. К клиническому образцу, направляемому в лабораторию, прилагают сопроводительный документ, содержащий основные сведения, необходимые для проведения микробиологического исследования (характер материала, фамилия, имя и отчество больного, название учреждения или отделения, номер истории болезни, предполагаемый диагноз заболевания, предшествующая антимикробная терапия, дата и время взятия материала, фамилия врача, направляющего материал на исследование). Способы взятия исследуемого материала из полости рта Непосредственной причиной большей части заболеваний в полости рта являются резиденты (или их этиология вообще не выяснена) и поэтому предметом исследования в этих случаях является адаптированная к организму индигенная микрофлора, ее воздействие на организм и роль микробных ассоциаций в развитии оппортунистических болезней. Из этого своеобразия патологического процесса вытекают и особенности использования микробиологических методов. Использование микробиологических методов при стоматологических заболеваниях (кариесе, пародонтите, афтозном стоматите и т.п.) направленно не на диагностику болезней, а на изучение этиологии и патогенеза этих заболеваний. При одонтогенных воспалительных процессах (периодонтитах, абсцессах, флегмонах и т. п.) эти методы могут быть использованы для контроля проводимого лечения, прогнозирования исхода болезни. Эти методы позволяют определить чувствительность микробной ассоциации к антибиотикам и, соответственно, выбрать рациональную терапию. В стоматологии чаще всего используют бактериоскопический и бактериологический методы исследования. Идет разработка тест систем для диагностики возбудителей методом ПЦР. При стоматологических заболеваниях в качестве исследуемого материала можно изучать: зубную бляшку, ротовую жидкость, содержимое десневого желобка или патологического десневого кармана, материал из кариозной полости, материал из корневых каналов, гранулемы, гнойное отделяемое, пунктаты, соскобы, мазки-отпечатки со слизистой оболочки или элементов поражения. В практической стоматологии чаще исследуют: мазки-отпечатки со слизистой оболочки, гнойное отделяемое, пунктаты. Общие правила забора материала при стоматологических заболеваниях. При заборе материала из различных участков следует исключить попадание в пробу слюны. Для этого исследуемую область обкладывают стерильными ватными тампонами. Перед забором материала нельзя обрабатывать полость рта бактерицидными препаратами, а также необходимо выяснить у больного, не принимал ли он в течение последних 3 недель антибиотики. Учитывая, что большая часть резидентов полости рта является облигатными анаэробами, при заборе материала и его транспортировке необходимо соблюдать условия анаэробиоза. Исследование зубной бляшки Смотри тему: МИКРОБИОЛОГИЯ КАРИЕСА И ИССЛЕДОВАНИЕ МИКРОФЛОРЫ ПРИ КАРИЕСЕ Исследование ротовой жидкости Смотри тему: МИКРОБИОЛОГИЯ КАРИЕСА И ИССЛЕДОВАНИЕ МИКРОФЛОРЫ ПРИ КАРИЕСЕ Исследование кариозной полости Смотри тему: МИКРОБИОЛОГИЯ КАРИЕСА И ИССЛЕДОВАНИЕ МИКРОФЛОРЫ ПРИ КАРИЕСЕ Исследование корневых каналов Смотри тему: ГНОЙНО-ВОСПАЛИТЕЛЬНЫЕ ПРОЦЕССЫ ПОЛОСТИ РТА Исследование десневой жидкости Смотри тему: МИКРОБИОЛОГИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА Исследование соскобов со слизистой оболочки Смотри тему: ЗАБОЛЕВАНИЯ СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА. Для изучения орального микробиоценоза применяются следующие питательные среды: 5% кровяной агар для подсчета общего микробного обсеменения, желточно-солевой агар – для стафилококков, сахарный бульон и "Mitis Salivarius Agar” – для стрептококков, растительно-молочную среду для лактобактерий, среду Сабуро с полимексином - для грибов рода Candida, среду Вильсона-Блера для анаэробов, среду Эндо – для энтеробактерий. Посевы инкубируются в термостате 24 часа, среда Сабуро около 5 дней. Идентификация выделенных штаммов микроорганизмов осуществляют на основании морфологических, культуральных и биохимических признаков в соответствии с определителем бактерий Д. Берги (1988). Количественный учет плотности популяций различных экологических групп производится путем подсчета колониеобразующих единиц (КОЕ) в одном грамме зубного налета, 1 мл ротовой жидкости, на 1 см2 поверхности языка и слизистых оболочек щеки, десны и неба. Методические указания Изучение количественного состава различных биотопов полости рта Количественный учет плотности популяций различных экологических групп производится путем подсчета колониеобразующих единиц (КОЕ) при посеве на питательные среды. Ход работы. Забор материала со слизистых оболочек и поверхности языка для бактериологического метода проводится стерильным ватным тампоном с площади 1 см2 и последующим высевом на питательные среды. Ротовая жидкость собирается в стерильную пробирку, для посева исследуется 1 мл. Исследуемый материал тщательно растирают петлей в секторе А. После чего петлю прожигают и из "грязного" сектора А выполняют 4 линейных штриха во 1 сектор, затем также во 2 и 3. Схема посева. 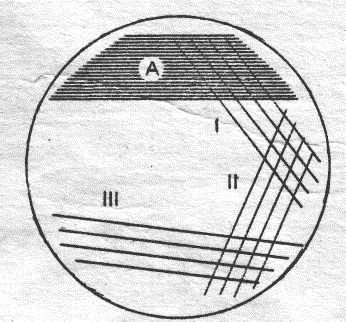 Посев инкубируют в термостате при 37°С в течении 12-18 часов. Подсчитать количество колоний в 3-ем (последнем) секторе. Общее количество жизнеспособных бактерий в 1 мл материала (КОЕ/мл, колониеобразующие единицы) вычислить, пользуясь формулой: N = n х 106 , где N — общее число бактерий, n — число колоний в секторе. 5. Сравнить количество микроорганизмов из различных биотопов полости рта. Контрольные вопросы Какие методы микробиологической лабораторной диагностики Вы знаете? Какие существуют особенности использования методов микробиологической диагностики в стоматологии? Как осуществляют забор материала из кариозной полости? Как забирают материал из десневого кармана? Какой исследуемый материал чаще всего используют в стоматологии? Как осуществляют количественный учет плотности популяций различных экологических групп? Список литературы Обязательная: Борисов Л.Б. Медицинская микробиология, вирусология, иммунология. – М.: ООО «Медицинское информационное агентство», 2001. – 736 с. Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология: Учебник для мед. вузов. – СПб.: СпецЛит, 2002. – 591 с. Поздеев О.К. Медицинская микробиология / Под ред. В.И. Покровского. – М.: ГЭОТАР-Медиа, 2005. – 768 с. Дополнительная: Ахременко Я.А. Микробиология полости рта: Учебное пособие для студентов стоматологических факультетов. – Якутск: Изд-во Якутского госуниверситета, 2008. – 107 с. Зеленова Е.Г., Заславская М.И., Салина Е.В., Рассанов СП. Микрофлора полости рта: норма и патология: Учебное пособие. Нижний Новгород: Издательство НГМА, 2004. - 158с. Микробиология, вирусология и иммунология: учеб. для студентов мед. вузов / под ред. В. Н. Царёва. — М.: Практическая медицина, 2009. — 581 с.: ил. Практикум лабораторных работ с иллюстрированными ситуационными заданиями по микробиологии, иммунологии и вирусологии / под ред. А.А. Воробьева, В.Н. Царева. – М.: ООО « Медицинское информационное агентство», 2008. – 320 с.: ил. Занятие № 7. ЗАБОЛЕВАНИЯ СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА. Цели: изучить возбудителей бактериальных, вирусных, грибковых стоматитов. Знать: классификацию заболеваний слизистой полости рта, характеристику основных возбудителей бактериальных, вирусных и грибковых стоматитов. Уметь: идентифицировать грибы рода Candida по культуральным, морфологическим и тинкториальным свойствам. Обоснование темы: поражения слизистой оболочки полости рта могут вызывать различные инфекционные агенты. Вопросы для самоподготовки: Заболевания слизистой оболочки полости рта бактериальной природы. Этиология. Патогенез. Лечение. Профилактика. Вирусные стоматиты. Этиология. Патогенез. Лечение. Профилактика. Заболевания слизистой оболочки полости рта грибковой природы. Этиология. Патогенез. Лечение. Профилактика. ПЛАН Программа: 1 Классификация стоматитов. Острые бактериальные инфекции. Хронические бактериальные инфекции. Вирусные стоматиты. Грибковые инфекции полости рта. Микробиологическая диагностика стоматитов. Демонстрация: Фотографии, характеризующие клинические проявления стоматитов различной этиологии. Рост Candida albicans на сахарном агаре. Готовые мазки из чистой культуры Candida albicans. Задание студентам: Заполнить таблицу: «Характеристика возбудителей бактериальных стоматитов».
Изучить культуральные, морфологические и тинкториальные свойства грибов рода Candida. Информационный материал Классификация стоматитов Стоматитом называется заболевания слизистой оболочки полости рта различного происхождения, характеризующиеся воспалением. Инфекции, поражающие слизистую оболочку рта и красную кайму губ, можно разделить на две группы: первичные и вторичные. К первичным относят такие заболевания, при которых входными воротами инфекции является слизистая оболочка рта и красная кайма губ, где развивается инфекционный процесс. При вторичных инфекциях слизистая оболочка является местом проявления общих, системных заболеваний человека - кишечных, респираторных и других. Инфекционные заболевания слизистой оболочки рта в зависимости от инфекционного агента можно разделить на бактериальные, вирусные и грибковые. Кроме того, стоматиты можно разделить на экзогенные (инфекционные) и эндогенные (оппортунистические). Острые бактериальные инфекции Гнойно-воспалительные процессы (фурункулы, гингивостоматит, заеда, хронические трещины губ, хроническая язвенная пиогенная гранулема) могут вызывать различные стафилококки (чаще S. aureus) и стрептококки (зеленящие стрептококки, S. pyogenes). Микроорганизмы являются грамположительными кокками, в мазке располагаются в виде скоплений (стафилококки) или цепочек (стрептококки). Спор и жгутиков не имеют. Факультативные анаэробы. Устойчивы во внешней среде. При всех выше перечисленных формах гнойно-воспалительных процессов появляются эрозии с гнойным отделяемым. Входными воротами для гноеродных кокков могут служить микротравмы. Смешанная стафило- и стрептококковая флора является причиной развития импетиго, при котором вначале обнаруживаются стрептококки, а затем - стафилококки. При этом гнойничковый процесс развивается на коже лица, красной кайме губ и далее может распространиться на слизистую оболочку рта. Заболевание чаще встречается у детей, а также пожилых людей, пользующихся съемными протезами. Лечение проводят антибактериальными химиопрепаратами. Специфическая профилактика отсутствует. Для диагностики кокковых пиодермий и нагноений слизистой оболочки полости рта используют бактериологический метод. Скарлатина. Возбудителем скарлатины является Streptococcus pyogenes. Представлен грамположительными кокками, расположенными в виде цепочки или попарно. На кровяном агаре дает бета-гемолиз, факультативные анаэроб. Основной фактор патогенности - эритрогенный токсин. Инфекция передается воздушно-капельным путем. У больного скарлатиной наблюдается яркая гиперемия слизистой оболочки миндалин и нёба («пылающий зев»). Язык покрыт белым налётом и на этом фоне выделяются грибовидные сосочки ярко-красного цвета. В тяжелых случаях могут быть изъязвления. На 2-3 день болезни на коже появляется яркорозовая или красная мелкоточечная сыпь. Через 10 дней изменения в полости рта проходят. Заболевания чаще встречается у детей дошкольного возраста. Лечение проводят антибактериальными химиопрепаратами. Специфическая профилактика отсутствует. Диагноз обычно ставят на основании клинических данных. Гонококковый стоматит вызывается гонококками (Neisseria gonorrhoeae) – грамотрицательные диплококки. Жгутиков не имеют, спор не образуют. Аэробы. Неустойчивы во внешней среде. Гонококковый стоматит передается контактно-половым и контактнобытовым путями, а также при прохождении ребенка через родовые пути инфицированной матери. Заболевание проявляется гиперемией, отеком на слизистой оболочке рта, небольшими эрозиями с вязким слизисто-гнойным секретом. На губах при гонорее могут быть язвенные поражения, десны отечны и воспалены. Язык, слизистая оболочка щёк могут быть гиперемированы и с изъявлениями. Возможно также поражение слюнных желез и глотки. Лечение проводят антибактериальными химиопрепаратами. Специфическая профилактика отсутствует. Для диагностики применяют бактериоскопический, бактериологический и молекулярно-биологический (ПЦР) методы. Гингивостоматит Симановского-Плаута-Венсана (фузоспирохетоз) относят к оппортунистическим инфекциям полости рта. Это микст-инфекция, вызываемая двумя обитателями полости рта - Treponema vincentii и Fusobacterium nucleatum. Местные проявления наблюдаются при снижении естественной резистентности организма. Болезнь возникает при ослаблении защитных сил организма человека (переохлаждение, различные стрессовые состояния, гиповитаминозы, недостаточность секреции slgA на слизистой рта). Заболевание чаще возникает у молодых людей, а также у истощенных лиц на фоне курения, хронического алкоголизма и хронических заболеваний. Но также может развиться как осложнение гингивита или кариеса. Существует мнение, что фузоспирохетоз возникает на фоне первоначального воспалительного процесса, вызванного банальной кокковой флорой. Затем происходит активное размножение фузиформных бактерий и спирохет, которые постоянно присутствуют в небольших количествах в складках слизистой оболочки и десневых карманах полости рта. Патогенетическое значение фузобактерий связано с наличием у них фермента коллагеназы, который участвует в разрушении коллагеновых волокон соединительной ткани. При этом азотсодержащие низкомолекулярные продукты, образовавшиеся в результате распада коллагена, могут усваиваться спирохетами. Анаэробные условия, создающиеся в некротизированных тканях, препятствуют быстрому выздоровлению и способствуют дальнейшему повреждению тканей размножившимися анаэробами (бактероидами, пептококками и пептострептококками). Клиническая картина характеризуется образованием плёнчато-язвенных поражений на миндалинах, слизистой оболочке щёк, дёсен, глотки. Лечение проводят антибактериальными химиопрепаратами, направленными, прежде всего, против микроорганизмов, вызвавших первичные поражения (стафилококки, стрептококки). Специфическая профилактика отсутствует. Диагностика проводится при помощи бактериоскопического исследования. Дифтерия. Возбудителями являются токсигенные штаммы Corynebacterium diphtheriae. Грамположительные палочки с утолщениями на концах, расположенные в виде латинских бук L, Y, V. Неподвижны, спор не образуют. Аэробы. В окружающей среде сохраняют жизнеспособность в течение нескольких дней. Заражение происходит воздушно-капельным путем. При островчатой форме дифтерии на миндалинах, нёбных дужках, язычке, иногда на месте прорезывающегося или удалённого зуба и на слизистой оболочке щек образуются плотно сидящие налёты в виде небольших бляшек или точек белого либо серовато-белого цвета. При распространенной форме дифтерии ротоглотки на фоне неяркой гиперемии отмечаются характерные плёнчатые налёты, цвет которых становится грязно-серым или желтовато-серым. Симптомы интоксикации могут быть слабо выражены, и больной переносит заболевание «на ногах». Довольно часто встречаются атипичные формы дифтерии, протекающие под видом катаральной, фолликулярной или лакунарной ангины, дифтерия носа и раневых поверхностей, нередко встречается и т.н. «здоровое» носительство токсигенных штаммов. Лечение проводят антитоксической сывороткой и антибактериальными химиопрепаратами. Специфическая профилактика – адсорбированная коклюшно-дифтерийно-столбнячная вакцина (содержит дифтерийный анатоксин). Диагностику дифтерии проводят при помощи бактериологического и бактериоскопического методов. |
