Занятие 7е тема нарушение кровообращения и изменение обмена веществ в очаге воспаления
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
ЗАНЯТИЕ 7-е ТЕМА 1. НАРУШЕНИЕ КРОВООБРАЩЕНИЯ И ИЗМЕНЕНИЕ ОБМЕНА ВЕЩЕСТВ В ОЧАГЕ ВОСПАЛЕНИЯ Цель занятия: сформировать представление о воспалении как типовом патологическом процессе; уяснить роль биологически активных веществ как активных участников воспалительной реакции; изучить последовательность сосудистых изменений при развитии острого воспалительного процесса в эксперименте; наблюдать краевое стояние и эмиграцию лейкоцитов; исследовать ферментативную активность и рН гнойного экссудата. ВОСПАЛЕНИЕ КАК ТИПОВОЙ ПАТОЛОГИЧЕСКИЙ ПРОЦЕСС Воспаление – это возникшая в ходе эволюции реакция организма (живых тканей организма) на местные повреждения; она состоит из сложных поэтапных изменений микроциркуляторного русла, системы крови и соединительной ткани, которые направлены в конечном счете на устранение и изоляцию повреждающего агента и восстановление (или замещение) поврежденных тканей (А.М. Чернух, 1979). 1. Сущностные признаки воспаления Воспаление – типовой патологический процесс, в котором имеет место сочетание как патологических, так и защитно-физиологический реакций. Воспаление, как правило, - местный процесс с определенными локальными признаками: tumor, rubor, kalor, doloretfunctiolesae. Будучи местным процессом,воспаление характеризуется рядом общих проявлений: лихорадкой, болью, анорексией, лейкоцитозом, возрастанием СОЭ, появлением в крови острофазовых реактантов (ОФР). Воспаление – универсальный процесс, который встречается в структуре различных заболеваний, в разных органах и тканях. Воспаление – стереотипный процесс, отражающий его запрограммированность и характеризующийся типическими проявлениями вне зависимости от этиологии и органной локализации. Воспаление – аутохтонный процесс, способный к саморазвитию независимо от продолжения действия его причинного фактора. Основу воспаления составляет сосудисто-мезенхимальная реакция, характеризующаяся множественностью и разнообразием участников, включая клетки мезенхимального происхождения (эндотелиоциты, гладкомышечные клетки сосудов, тучные клетки, тромбоциты, эозинофилы, нейтрофилы, моноциты/макрофаги, лимфоциты, фибробласты), а также локальные (эйкозаноиды, цитокины, биогенные амины и др.) и циркулирующие (системы комплемента, гемокоагулации, калликреин-кининовая и др.) медиаторы процесса. Воспаление характеризуется каскадным принципом включения и активации ряда систем, участвующих в его развитии (гемокоагулации, комплемента и др.). Воспаление – самоограничивающийся процесс при участии механизмов угнетения продукции, секреции и активности флогогенных факторов (ингибиторы комплемента калликреина, свертывания крови, цитокинов, антиоксиданты и др.). Врожденный или приобретенный недостаток механизмов самоограничения воспаления способствует его трансформации из местного в системный, генерализованный процесс : токсико-септический шок. Воспаление – фазоворазвивающийся процесс, в котором на основе морфологических изменений выделяют три стадии: альтерации, экссудации и пролиферации. В патофизиологии, моделирующей этот типический патологический процесс и исследующей его в динамике, выделяют четыре стадии (В.А. Черешнев, Б.Г. Юшков, 2001). Стадии развития воспаления I. Альтерация первичная вторичная II. ЭКССУДАЦИЯ кратковременный спазм (ишемия) а   ртериальная гиперемия ртериальная гиперемияв  енозная гиперемия енозная гиперемияс  таз тазп  овышение проницаемости и экстравазация жидкости овышение проницаемости и экстравазация жидкостиIII. эмиграция форменных элементов адгезия лейкоцитов к эндотелию приобретение лейкоцитами локомоторного фенотипа диапедез лейкоцитов направленное движение лейкоцитов в очаг повреждения (хемотаксис) скопление лейкоцитов в очаге повреждения. Образование инфильтрата - раннего (полиморфонуклеары) - позднего (мононуклеары) отграничение очага повреждения и его санация IV. ПРОЛИФЕрация реализация регуляторного действия макрофагов пролиферация и активация биосинтетической активности фибробластов стимуляция фиброплазии и ангиогенеза репарация УЧАСТНИКИ ВОСПАЛЕНИЯ Биогенные амины, участвующие в процессе воспаления, представлены, главным образом, гистамином и серотонином. При воспалении гистамин вызывает расширение артериол, повышение проницаемости венул, способствует освобождению кининов и метаболитов арахидоновой кислоты, инициирует зуд и боль, активацию хемокинеза и лимфотоксичности, стимулирует иммуносупрессивное действие лимфоцитов. Действуя на бронхи, гистамин усиливает секрецию слизи и вызывает бронхоспазм. СЕРОТОНИН у человека в тучных клетках отсутствует. Источником серотонина могут быть тромбоциты, эозинофилы, а в кишечнике – энтерохромаффинные клетки. Среди биогенных аминов, участвующих в воспалении, определенная роль отводится полиаминам: спермину, спермидину, путресцину, кадаверину. Эти вещества рассматриваются как противовоспалительные медиаторы и стимуляторы репарации, в том числе, как клеточные медиаторы ростового эффекта соматомединов. КАЛЛИКРЕИН–КИНИНОВАЯ СИСТЕМА Калликреин-кининовая система (ККС) – протеолитическая система, играющая ключевую роль в регуляции широкого спектра физиологических функций организма и развитии многих патологических состояний (Г.А. Яровая, 2002). ККС занимает центральное место в регуляции активности каскадных протеолитических систем плазмы крови: 1) гемокоагулации; 2) фибринолиза; 3) комплемента; 4) кининогенеза; 5) ангиотензиногенеза, обеспечивающих процессы адаптации и защиты организма. ККС контролирует различные стадии морфогенеза клеток некоторых тканей, иммунный ответ, тонус гладкой мускулатуры сосудов и гладкой мускулатуры ряда органов (бронхов), вызывает снижение АД, увеличение проницаемости сосудистой стенки, в том числе гематоэнцефалического барьера, участвует в развитии воспаления и шока различной этиологии, тромбогеморрагических состояний, трансформации клеток и других физиологических и патологических процессах. Главные компоненты ККС включают: 1) калликреины; 2) кининогены; 3) кинины (брадикинин); 4) рецепторы кининов (брадикинины); 5) ингибиторы калликреинов; 6) кининазы. Кининазы – высокоактивные металлоферменты, присутствующие в крови и в тканях и осуществляющие физиологический контроль уровня кининов путем гидролиза пептидных связей, приводящего к их полной или частичной инактивации.. При участии данных кининаз обеспечивается быстрая и эффективная инактивация кининов. В частности, период полураспада брадикинина в большом круге кровообращения составляет всего 17-24 секунды. Еще быстрее он разрушается вмалом круге кровообращения. СИСТЕМА КОМПЛЕМЕНТА Комплемент – система самособирающихся сывороточных белков с каскадным ферментативным действием, ключевые биологические эффекты которой сводятся к лизису бактерий и других клеток, участию в воспалении и стимуляции фагоцитоза, а также к регуляции функций клеток иммунной системы . КОМПОНЕНТЫ И ПУТИ АКТИВАЦИИ Компоненты системы включают непосредственно белки комплемента , расщепленные фрагменты , рецепторы на мембранах многих клеток, а также белки , регулирующие активность отдельных компонентов. 9 главных белков комплемента в порядке активации обозначены С1, С4, С2, С3, С5, С6, С7, С8 и С9. Расщепленные пептидные фрагменты С4, С2, С3, С5 обозначаются буквами «а», «b» и т.д. Факторы, усиливающие комплемент – D, B и P (пропердин). Рецепторы комплемента – CR1, CR2, CR3. Белки комплемента синтезируют многие клетки организма: гепатоциты (С3), макрофаги, моноциты, эпителий кишечника, почечных канальцев, клетки эндотелия, фибробласты и т.д. Более 90% комплемента в плазме происходит из печени. Многие компоненты комплемента (С1q, C4, C2 и др.) и, особенно, в функционально-активной форме в зоне воспаления вырабатывают макрофаги. Ключевым компонентом всей системы является С3. Известны, по крайней мере, 3 пути многоэтапного ферментативного каскада его активации. КЛАССИЧЕСКИЙ ПУТЬ. Быстро и эффективно активируется иммунными комплексами при участии IgM или IgG. В каскаде последовательно принимают участие все компоненты в следующем порядке: С1, С4, С2. Следствием такой активации является образование С3-конвертазы классического пути: С4bC2a. Участие молекул IgM и IgG в реализации классического пути активации обусловлено их способностью связывать С1q(а также С4b и C3b). Некоторые вещества способны связывать и активировать С1 в отсутствие специфических антител. К таким неиммунологическим активаторам относятся: С-реактивный белок, кристаллы мононатриевой соли мочевой кислоты, комплексы гепарина и протамина, некоторые вирусы (ВИЧ) бактериальные гликолипиды. Вариантом классического пути является ЛЕКТИНОВЫЙ ПУТЬ активации комплемента, который осуществляется без участия антител в присутствии особого белка MBL. Данный белок обладает сродством к маннозе и некоторым полисахаридам, которые в свободной форме присутствуют на поверхности микробных клеток, но не клеток макроорганизма. Активацию АЛЬТЕРНАТИВНОГО ПУТИ способны запустить агрегированные IgG, IgM, IgA, IgE, комплексы антигена с бивалентными фрагментами IgG-антител типа F(ab`)2, бактериальные и растительные полисахариды (ЛПС, декстран, инулин), вирусы, дрожжи (зимозан), клетки высших организмов и фактор яда кобры. В этом каскаде не участвуют ионы Са2+ и компоненты С1, С4 и С2. После инициации альтернативного пути, заканчивающейся формированием молекул комплекса С3iBb, следует его амплификация. Она обусловлена ферментативной деградацией этим комплексом молекул С3 с наработкой больших количеств С3b, вовлекаемых во взаимодействие с факторами В, D и образованием нового комплекса молекул - С3bBb, являющихся С3-конвертазой альтернативного пути. С3b, образовавшийся в результате активации комплемента по классическому пути и ковалентно фиксированный к молекуле IgG, также может присоединять к себе фактор В со всеми последующими превращениями и с образованием в конечном итоге С3bBb. В этом случае альтернативный каскад служит механизмом амплификации классического пути активации комплемента. Расщепление молекул С3 при участии С3-конвертаз классического и (или) альтернативного пути сопровождается образованием фрагментов С3а и С3b. Фрагмент С3а остается в жидкой фазе, а С3b (при активации классического пути) ковалентно фиксируется на молекуле иммуноглобулина G с образованием комплекса С4bС2аС3b, представляющего собой С5-конвертазу классического пути. При этом происходит отщепление С1q и солюбилизация иммунного комплекса. При активации альтернативного пути роль С5-конвертазы выполняет комплекс С3bBb, который одновременно является и С3-конвертазой этого пути. Результаты действия обеих С5-конвертаз идентичны: расщепление фактора 5 на более крупный (С5b) и мелкий (С5а) фрагменты, из которых первый связывается с комплексом компонентов комплемента на клеточной мембране, а второй остается в жидкой фазе. Активация С5 открывает терминальный этап активации комплемента - формирование литического комплекса, включающее присоединение к С5b С6-компонента комплемента с последующим связыванием других терминальных компонентов С7, С8 и С9. Последний из них (С9) представляет собой белок, гомологичный перфорину. Как и перфорин он способен полимеризоваться при контакте с фосфолипидами мембраны, в результате чего формируется цилиндрический комплекс, встраивающийся в мембрану как его интегральный компонент. Эти цилиндры образуют поры, которые нарушают целостность мембраны и создают возможность для поступления в клетку ионов Н+, Na+ и воды (но не белков), что и приводит к разрыву мембраны и к гибели клетки. РОЛЬ СИСТЕМЫ КОМПЛЕМЕНТА В РАЗВИТИИ ВОСПАЛЕНИЯ. ОСНОВНЫЕ ЭФФЕКТЫ (А.Ш. Зайчик, Л.П. Чурилов, 1999) Лизис мишеней, активирующих комплемент; Опсонизация объектов, фиксирующих факторы комплемента (С3b); Активация лейкоцитов и опосредование их адгезии; Хемотаксис и усиление фагоцитоза; Регуляция иммунного ответа; Освобождение других медиаторов воспаления; Взаимодействие с другими системами, участвующими в воспалении (калликреин-кининовая, свертывания крови, фибринолиза и др.). КЛАССИЧЕСКИЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА  Fab 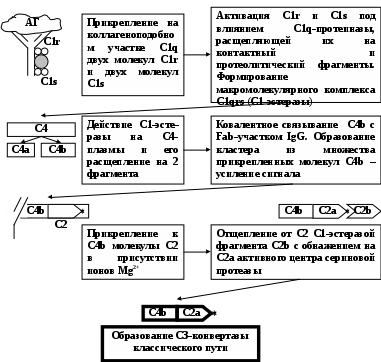 ЛЕКТИНОВЫЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА 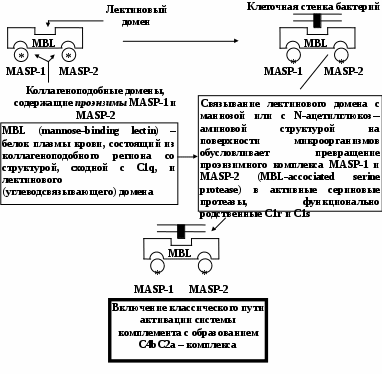 АЛЬТЕРНАТИВНЫЙ ПУТЬ АКТИВАЦИИ СИСТЕМЫ КОМПЛЕМЕНТА 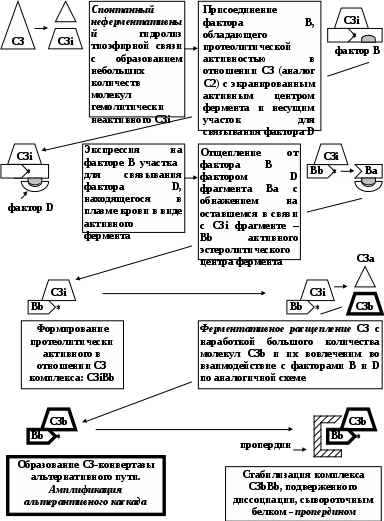 АКТИВАЦИЯ ТЕРМИНАЛЬНЫХ КОМПОНЕНТОВ СИСТЕМЫ КОМПЛЕМЕНТА И АТАКА КЛЕТОЧНОЙ МЕМБРАНЫ 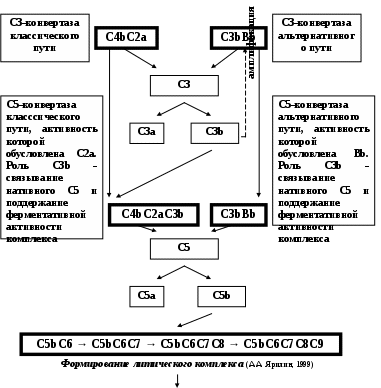 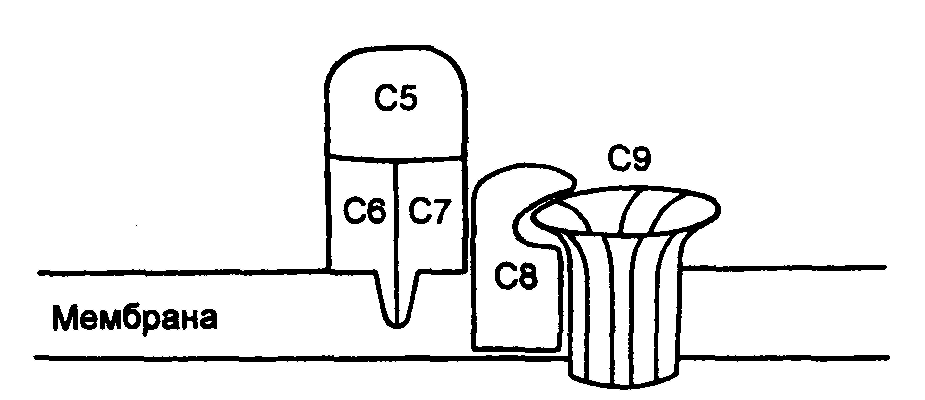 ФРАГМЕНТЫ КОМПЛЕМЕНТА КАК НЕЦИТОЛИТИЧЕСКИЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ 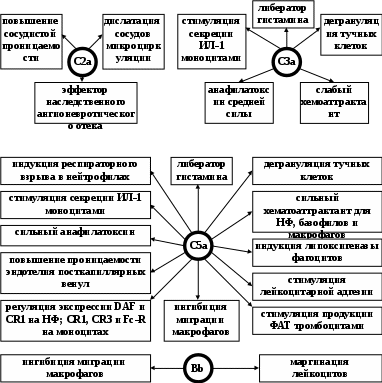 ЭЙКОЗАНОИДЫ ПУТИ МЕТАБОЛИЗМА АРАХИДОНОВОЙ КИСЛОТЫ И КЛЮЧЕВЫЕ ФЕРМЕНТЫ СИНТЕЗА Эйкозаноиды представляют собой продукты превращений арахидоновой кислоты (АК), специфическое высвобождение которой из фосфолипидов клеточных мембран происходит при участии фосфолипазы А2 (ФЛА2). Высвободившаяся АК может подвергаться метаболическим превращениям в двух направлениях: циклооксигеназном и липооксигеназном. Продуктами первого из них являются простагландины, простациклин и тромбоксан. Продуктами второго – липоксины, лейкотриены и гепоксилины. 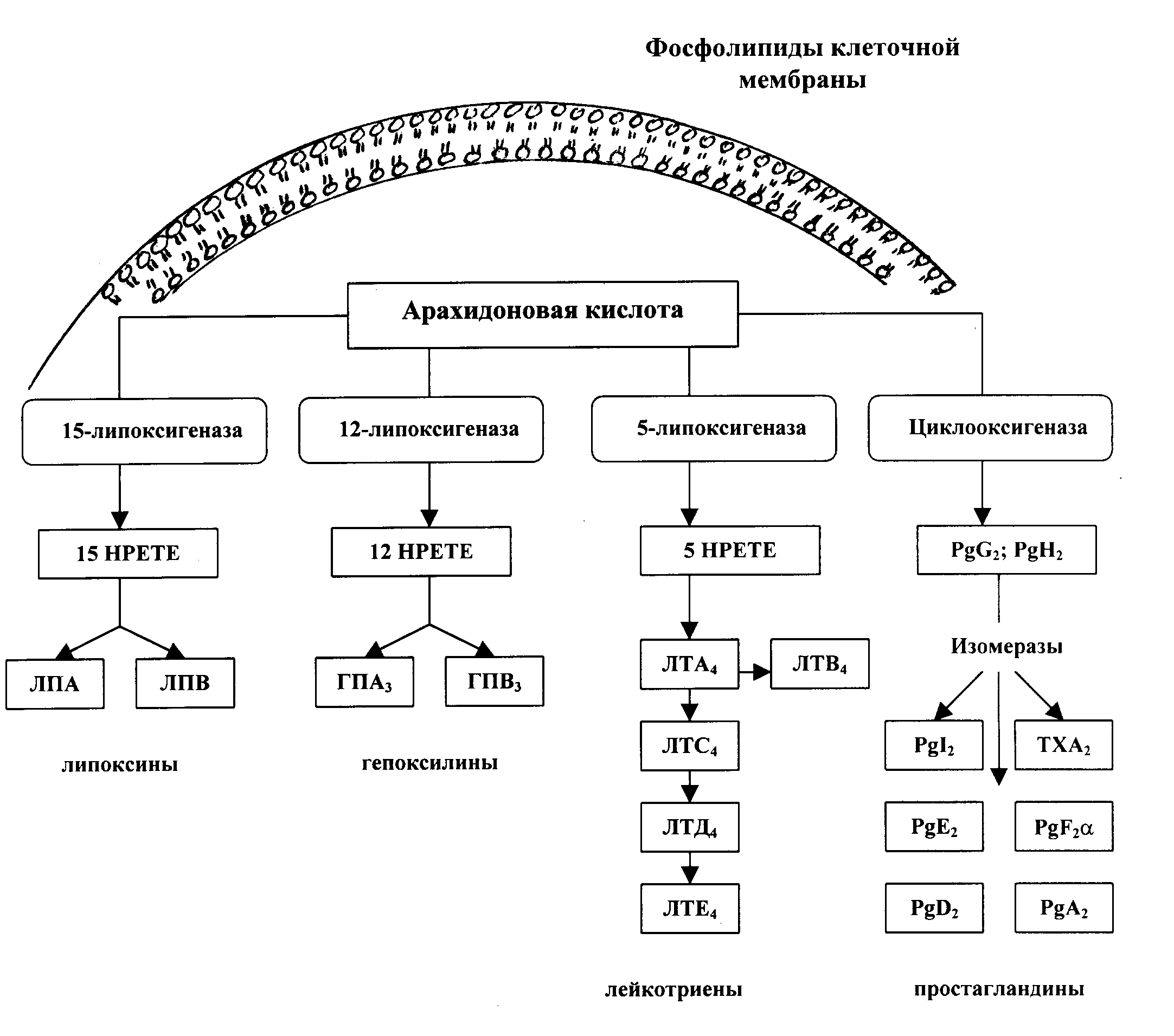 Ключевым ферментом, определяющим превращения АК в первом направлении является циклооксигеназа. Существуют две изоформы циклооксигеназных энзимов - СОХ-1 и СОХ-2, соответственно, выступают как регуляторы физиологических и воспалительных процессов. РОЛЬ МЕТАБОЛИТОВ ЛИПОКСИГЕНАЗНОГО ПУТИ ПРЕВРАЩЕНИЙ АРАХИДОНОВОЙ КИСЛОТЫ В РАЗВИТИИ ВОСПАЛЕНИЯ ЛЕЙКОТРИЕН В4  ЛЕЙКОТРИЕНЫ С4, D4, E4 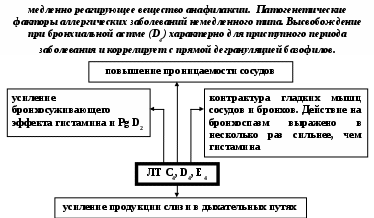 РОЛЬ МЕТАБОЛИТОВ ЦИКЛООКСИГЕНАЗНОГО ПУТИ ПРЕВРАЩЕНИЙ АРАХИДОНОВОЙ КИСЛОТЫ В РАЗВИТИИ ВОСПАЛЕНИЯ ПРОСТАГЛАНДИН Е2  ТРОМБОКСАН А2  ПРОСТАЦИКЛИН (PgI2) 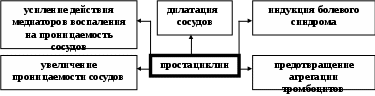 ФАКТОР АКТИВАЦИИ ТРОМБОЦИТОВ (ФАТ) Факторы активации тромбоцитов представляют собой семейство сходных стабильных нейтральных липидов. Их активные молекулы являются ацетилалкил-глицерильными эфирами фосфорилхолинов. Отсюда их второе сокращенное название – АГЭФХ. Основные клетки-продуценты ФАТ: нейтрофилы, базофилы, эозинофилы, тучные клетки, эндотелий. |
