2. Строение и функции белков
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
|
2.Строение и функции белков. Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Трёхмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка : * Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, важных для функции белка. * Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями *Третичная структура — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие: * ковалентные связи (между двумя цистеинами — дисульфидные мостики); * ионные (электростатические) взаимодействия (между противоположно заряженными аминокислотными остатками); * водородные связи; * гидрофобные взаимодействия. *Четверичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Все белки разделяют на две большие группы — простые и сложные белки. Простые белки содержат только аминокислоты, сложные белки имеют также неаминокислотные группы. Эти дополнительные группы в составе сложных белков называются «простетическими группами». Функции белков:
3. Свойства белков. Изоэлектрическая точка белка. Цвиттер ионы. 1. Высокая молекулярная масса (53 кДа) 2. Гидрофильность --> набухание (глобулярные) 3. Гидролиз - ферментативный 4. Кислотно основные свойства 5.высокая вязкость растворов 6. Низкое осмотическое давление. 7.Денатурация - разрушение пространственной структуры белка: Ренатурация возможно, если 1ая структура сохранилась 8. Конформационность (лабильность) 9. Спсобность взаимодействия с лигандами : Фермент + субстрат (гемоглобин + кислород) 10. Способность превращаться в гели Белки также являются амфотерными полиэлектролитами (полиамфолитами) Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды рН, при которой молекула данного белка не несёт электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 считаются основными ЦВИТТЕР-ИОНЫ (биполярные ионы), нейтральные молекулы, содержащие одновременно положит. и отрицат. ионные центры. Цвиттер-ионную структуру с пространственно разделенными зарядами имеют аминокислоты, существующие в виде внутр. солей - бетаинов, а также мезоионные соединения. Особый тип цвиттер-ионов представляют илиды, в к-рых карбанион непосредственно связан с гетероатомом, несущим положит. Заряд. 4 — 1 5. Диализ. Гемодиализ. Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемую мембрану, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной и окр.раствором. После многократной замены внешнего раствора состав среды в диализном мешочке будет тот же, что и в окр. растворе. Гемодиализ — механическое очищение крови от отходов, солей, жидкостей.Гемодиализ — метод внепочечного очищения крови при острой ихронической почечной недостаточности. Во время гемодиализа происходит удаление из организма токсических продуктов обмена веществ, нормализация нарушений водного и электролитного балансов. 6. Свойства растворов белков. Механизм осаждения белков из их растворов Белки являются коллоидными частицами и образуют коллоидные растворы. К свойствам белковых растворов относятся: Рассеивание света вследствие дифракции на коллоидных частицах- опалесценция . Особенно это заметно при поражении луча света через белковый раствор, когда виден светящийся конус( эффект Тиндаля) Белковые растворы в отличии от истинных обладают малой скоростью диффузии Не способность белковых частиц проникать через мембраны, поры которых меньше диаметра белков( полунепроницаемые мембраны). Это используется в диализе. Очистка белковых препаратов от посторонних примесей лежит в основе работы «искусственной почки» при лечении острой почечной недостаточности. Создание онкотического давления, т. е. Перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отека при повышении проницаемости сосудистой стенки. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется например, при образовании гелей и студней. Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка и потере его функций. Некоторые способы осаждения позволяют впоследствии восстановить нативные свойства и работоспособность белков. Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация). Иногда для ренативации достаточно просто удалить повреждающий агент. Высаливание Высаливание – это добавление к раствору белка нейтральных солей (Na2SO4, (NH4)2SO4). Механизм высаливания заключается во взаимодействии анионов (SO42-) и катионов (Na+, NH4+) с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению. Осаждение водоотнимающими средствами При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки, но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, в этом заключается антисептическое действие этанола. Изменение рН Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда, сопутствующему уменьшению гидратной оболочки и, как следствие, снижению растворимости молекулы. 7. Денатурация белков. Типы денатурации. Белки-шапероны. Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. 1. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. 2. Химическая денатурация Зависит от природы денатурирующего реагента: кислоты и щелочи образуют водородные связи с пептидными группами, органические растворители образуют водородные связи и вызывают дегидратацию, алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей, тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей. Белки-Шаперо́ны— класс белков, главная функция которых состоит в восстановлении правильной нативной третичной или четвертичной структуры белков, а также образование и диссоциация белковых комплексов. 8. Сложные белки. Строение и биологические функции. Сложные белки содержат два компонента: белковую и небелковую части, называемые простетической группой. В зависимости от характера этой группы различают: хромопротеины, нуклеопротеины, металлопротеины, фосфопротеины, гликопротеины, липопротеины. Липопротеины – сложные белки, содержащие в качестве простетической группы липиды и их производные. Представителями служат хиломикроны и другие фракции липопротеинов крови. Липопротеины являются транспортными формами липидов в крови. Нуклеопротеины – сложные белки, содержащие в качестве простетической группы нуклеиновые кислоты. Нуклеопротеинами являются вирусы, рибосомы, хроматин клеточного ядра. Существуют две разновидности нуклеопротеинов: 1) рибонуклеопротеины, в состав которых входит рибонуклеиновая кислота (РНК); 2) дезоксирибонуклеопротеины, в состав которых входит дезоксирибонуклеиновая кислота (ДНК) Фосфопротеины содержат в своём составе остатки фосфорной кислоты, соединённые с остатками гидроксиаминокислот (серин, треонин) при помощи сложноэфирных связей. К этой группе сложных белков относятся казеиноген молока, яичные белки овальбумин и вителлин. Металлопротеины. Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеинами. Ионы металлов соединены координационными связями с функциональными группами белка и участвуют в поддержании его пространственной структуры. Металлопротеины часто являются ферментами. Трансферрин – водорастворимый железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит 2 иона Fe3+; этот белок служит переносчиком железа в организме. Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Гликопротеины – содержат в качестве простетической группы углеводы и их производные. Они присоединяются либо N-гликозидной связью к амидогруппе остатка аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина или треонина. Углеводная часть имеет нерегулярное строение. Гликопротеины выполняют в организме следующие функции: структурную (коллаген, эластин), защитную (антитела, интерфероны), рецепторную, гормональную (гормоны гипофиза), ферментативную, транспортную. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина - витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем. 9. Муцин, строение. Биологическая роль. Муцины - гликопротеины, секретируемые рвэличными тканями организма и образующие вязкие растворы. Примерами могут служить слюна, секреты кишечника и бронхов. Ими выстланы полости дыхательного и пищеварительного трвктов. Муцины выполняют роль смазки, а также защищают ткани от повреждений Гликопротеины, в которых много остатков пролина (до 50%), серина, треонина и углеводных цепей полисахаридов (50-70%).Короткие полисахаридные цепи крепятся к серину и треонину О-гликозидными связами.Аминокислотные остатки пролина вызывают изгибы полипептидной цепи. В слюне присутствует муцин-1 (Mr 250 кДа) и муцин-2 (Mr 100 кДа). 10. Казеин, строение. Биологическая роль. Казеин – сложное соединение аминокислот, в которых имеются свободные аминные (основные) и кислотные группы. Казеин – амфотерный электролит, способный диссоциировать как кислота и как основание в зависимости от реакции среды. При щелочной реакции раствора казеин заряжается отрицательно, вследствие чего он способен реагировать с кислотами: R – СH – NH2 + HCl => R – CH – NH3Cl COOH NH3OH Наоборот, в кислом растворе казеин приобретает способность реагировать со щелочами, т.е. катионами, при этом он заряжается отрицательно: R – СH – NH2 + NaOH => R – CH – NH3OH COOH COONa Следовательно, казеин может образовывать соли и с основаниями, и с кислотами. Вследствие того, что количество карбоксильных групп больше, чем аминных, реакция казеина кислая; для нейтрализации его в растворе нейтральных солей при индикаторе фенолфталеине требуется около 8,1 мл 0,1 н. раствора щелочи на 1 г казеина. В кислотах как минеральных, так и органических (уксусная, муравьиная и т.д.) казеин растворяется. Растворы казеина – это вязкие коллоидные трудно фильтрующиеся жидкости. Из соединений казеина наибольший интерес представляют соли щелочных и щелочноземельных металлов. Соли казеина со щелочными и щелочноземельными металлами называют казеинатами. Соли казеина со щелочными металлами, растворяясь в воде, образуют прозрачные или слегка опалесцирующие (рассеивающие свет) жидкости. В молоке казеин находится в форме кислых солей – кальциевых казеинатов. Наличие у казеина аминогруппы NH2 (дающие с водой гидроксильные ионы NH2 + HOH = NH3+ + OH-) обусловливает образование с кислотами двойных растворимых солей: H2SO4 + NH2 – R – COOH => H2SO4 * NH2 – R – COOH 11. Гемопротеиды. Гемоглобин. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем. 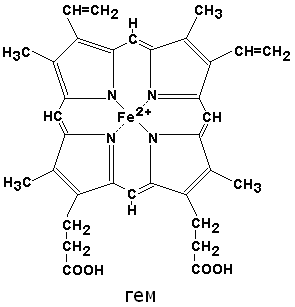 По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX - органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). равните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. |
