Ферменты и коферменты, заполнив таблицу
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
2.10 Для закрепления теоретических знаний и овладения практическими навыками необходимо выполнить индивидуальное задание по теме «Ферменты и коферменты», заполнив таблицу. «Классификация ферментов и коферментов»
3.8 Тема: Катаболизм белков осетровой икры Ответ составьте по следующему плану:
Содержит все аминокислоты. Стpуктуpные элeменты пeптидов и белков. В состав белков входят 20 протеиногенных аминокислот, которые кодиpyютcя генетичеcким кодом и постоянно oбнapyживaютcя в белкax. Некоторые из них пoдвеpгaютcя посттрансляционной модификации, т.е. мoгyт быть фocфopилиpовaны, aцилиpoваны или гидpoксилирoваны. Структурные элeмeнты дpyгих природных соeдинeний.Аминoкиcлoты и их производные входят в cocтaв коферментов, желчных кислот, антибиотиков. Пepeнoсчики сигналов. Некоторые из aминoкиcлoт являются нейромедиаторами или предшественниками нейромедиаторов, медиаторов или гормонов. Метаболиты.Аминoкиcлоты — важнейшие, а некоторые из них жизненно важные компоненты питания. Некоторые aминoкиcлoты принимают участие в обмене веществ, нaпpимep, cлyжaт донорами азота. Непротеиногенные aминoкиcлoты oбpaзyютcя в качестве прoмeжyточныx продуктов при биоcинтeзе и деградации протеиногенных аминокислот или в цикле мочевины.
Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электричекого заряда.
Специфической реакцией на содержание белка является биуретовая реакция, так как ее дают полипептидные связи. Она получила свое название от производной мочевины — биурета, который образует в щелочном растворе медного купороса окрашенное комплексное соединение. Интенсивность окрашивания пропорциональна содержанию пептидных связей, а, следовательно, и концентрации белка в растворе. Биуретовую реакцию дают все белки, пептоны и полипептиды, начиная с тетрапептидов. Эта реакция длительное время использовалась как качественная реакция на белок. В дальнейшем она стала применяться для количественного определения белка в различных объектах. Биуретовый метод применяют в различных модификациях, различающихся условиями экстрагирования белка, способами внесения биуретового реактива и техникой колориметрирования. Ниже приводится биуретовый метод определения массовой доли белка в муке в модификации Дженнингса, экспериментальная проверка которого выявила ряд его преимуществ перед другими модификациями. Биуретовый реактив – 15 см3 10 н. раствора КОН и 25 г сегнетовой соли, взятой с погрешностью ±0,01 г, растворяют примерно в 900 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3. Медленно добавляют при постоянном перемешивании 30 см3 4 %-ного раствора CuSO4, отмеренных цилиндром, и доводят объем колбы до метки дистиллированной водой. Техника определения. Взвешивают около 1,5 г муки с погрешностью ±0,001 г и помещают в сухую коническую колбу вместимостью 250—300 см3, снабженную пробкой. Отмеривают цилиндром с ценой деления 0,1 см3 под тягой 2 см3 четыреххлористого углерода для извлечения жира из образца, добавляют пипеткой 100 см3 биуретового реактива. Закрытую пробкой колбу встряхивают на механическом встряхивателе в течение 60 мин. Далее вытяжку центрифугируют в течение 10 мин при частоте вращения 4500 мин-1. Прозрачный центрифугат помещают в кюветы фотоэлектроколориметра с толщиной слоя раствора 5 мм. Измерение оптической плотности производят при длине волны 550 нм. По величине оптической плотности белковой вытяжки определяют содержание белка в навеске (мг) с помощью калибровочной кривой
При переваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинается в желудке и продолжается в тонком кишечнике под действием ферментов пептидгидролаз (пептидаз). Основные пептидазы синтезируются в клетках желудка, поджелудочной железы и кишечника. В желудке белки пищи денатурируются и гидролизуются с образованием олигопептидов. Вкишечнике панкреатические пептидазы продолжают гидролиз олигопептидов до ди- и трипептидов и свободных аминокислот. Короткие пептиды расщепляются до свободных аминокислот в пристеночном слое или в клетках кишечного эпителия. Затем происходит их всасывание. Все пептидазы, в зависимости от места расположения в пептиде гидролизуемой связи, делятся на эндопептидазы и экзопептидазы: • эндопептидазы - расщепляют пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза); • экзопептидазы - гидролизуют пептидные связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидазы А и В), а также расщепляют ди- и трипептиды. Ферменты, участвующие в переваривании белков, обладают относительной субстратной специфичностью и гидролизуют пептидные связи; при этом каждая пептидаза преимущественно расщепляет связи, образованные определенными аминокислотами. 2. Желудочные и панкреатические пептидазы вырабатываются в неактивной форме (проферменты), секретируются к месту действия, где активируются путем частичного протеолиза (отщепление пептида различной длины, чаще с N-конца молекулы профермента). Место синтеза проферментов (клетки слизистой оболочки желудка, поджелудочная железа) и место их активации (полость желудка, тонкого кишечника) пространственно разделены. Такой механизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания. 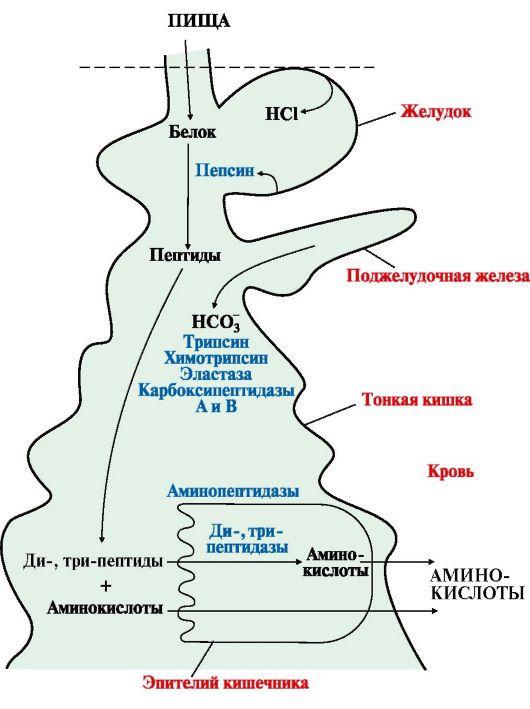
Всасывание аминокислот: Транспорт двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной проток. Всасывание L – аминокислот (не D – изомеров) – активный транспорт, с затратами энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Перенос через щёточную каёмку переносчиками, многие из которых работают при участии Na – зависимых механизмав симпорта, подобно переносу глюкозы. Механизм всасывания аминокислот в кишечнике: L – аминокислота поступает в энтероцит симпортом с ионом Na. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично – активного транспорта с помощью Na/K – АТФ-азы. дна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, полчках и, по-видимому, мозге. Эта система – γ – глутамильный цикл. В ней участвует 6 ферментов, один из которых находится в клеточной мембране, остальные – в цитозоле. Ключевая роль в транспорте аминокислот принадлежит ферменту γ – глутамилтрансферазе – гликопротеин, катализирует перенос γ – глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Аминокислота, связанная с γ – глутамильным остатком, оказывается внутри клетки. Происходит отщепление γ – глутамильного остатка под действием фермента γ – глутамилциклотрансферазы. Дипептид цистеинглицин расщепляется под действием пептидазы на 2 аминокислоты – цистеин и глицин. В результате - перенос одной молекулы аминокислоты в клетку (внутриклеточную структуру). Следующие три реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной аминокислоты с участием γ – глутамильного цикла затрачивается 3 молекулы АТФ.
Окислительное дезаминирование глутамата. 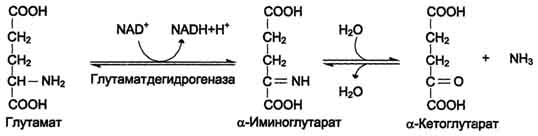 Витамин – никотинамид.
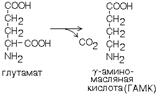 Глутаматдекарбоксилаза - высокоспецифичный фермент. Работает в клетках серого вещества головного мозга. Катализирует реакцию превращения глутаминовой кислоты в гамма-аминомасляную кислоту (ГАМК). Витамин В6- пиридоксальфосфат.
Индол, скатол, фенол и др.
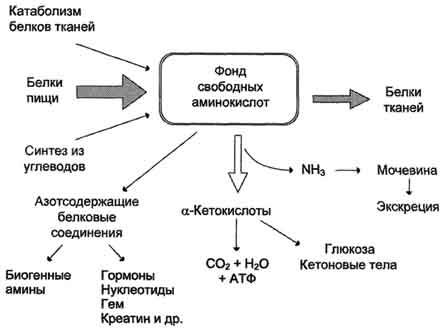
Образование транспортных форм аммиака в тканях. Аммиак, образующийся в тканях, сначала превращается в нетоксичное соединение и в таком виде переносится кровью к печени или почкам. Такими транспортными формами являются аминокислоты глутамин, аспарагин и аланин. Образование глутамина и аспарагина из глутамата и аспартата соответственно происходит во многих тканях, включая головной мозг: 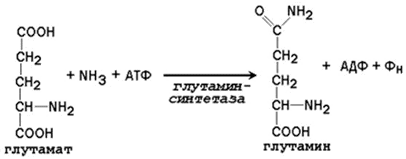 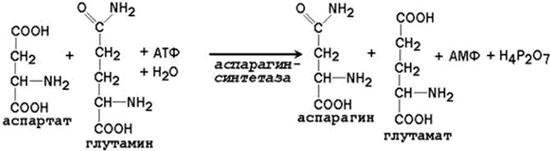 Глутамин - нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. В крови здоровых людей содержание глутамина существенно превышает содержание других аминокислот. Глутамин, помимо участия в синтезе белка, служит источником азота в биосинтезе гистидина, глюкозамина, пуриновых и пиримидиновых нуклеотидов. С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. При участии аспарагиназы также происходит образование аммиака из аспарагина. Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования, катализируемой глутаматдегидрогеназой:  Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой. Глутамат + Пируват Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат. α-Кетоглутарат + Аланин Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину. 2.2.3. Экскреция аммиака с мочой. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака.  Образующийся глутамат может в дальнейшем подвергаться дезаминированию при участии глутаматдегидрогеназы. Таким образом, из одной молекулы глутамина всего может образоваться две молекулы аммиака. Аспарагин аналогичным образом подвергается гидролизу при участии аспарагиназы, присутствующей в клетках канальцев почек. Аммиак секретируется в просвет почечных канальцев и выводится в виде солей минеральных и органических кислот, например: NН3 + НСl Образование солей аммония в почечных канальцах является важным механизмом регуляции кислотно-основного состояния организма. Оно резко возрастает при метаболическом ацидозе - накоплении в организме кислот и снижается при потере кислот организмом (алкалозе). 4.10 Пептид:
Ответ составьте по следующему плану:
ДНК ГЦЦ-ГАУ-ГГУ иРНК ЦГГ-ЦУА-ЦЦА тРНК ГЦЦ-ГАУ-ГГУ ДНК в ядре ЦГГ-ЦТА-ЦЦА
тРНК ГЦЦ-ГАУ-ГГУ
Для каждой из 20 аминокислот имеется соответствующий фермент, называемый аминоацил-т-РНК-лигазой (АРСазой, или кодазой), который катализирует соединение определенной аминокислоты с соответствующей ей специфической т-РНК (специфичность т-РНК определяется составом нуклеотидов антикодона в антикодоновой петле т-РНК). Процесс активации аминокислот называют термином «рекогниция», т.е. узнавание. Активация аминокислот необходима не только по тому, что только в активированном состоянии они способны к образованию пептидных связей, но и потому, что аминокислоты сами по себе не способны узнавать кодоны м-РНК (как было отмечено выше, эту роль выполняют т-РНК). Активация аминокислот локализована в цитоплазме, осуществляется в две стадии. На первой стадии аминокислота связывается в активном центре кодазы, специфичной к этой аминокислоте, и реагирует с АТФ, образуя высокоэнергетический ангидрид – аминоациладенилат (аа-аденилат). Например, активацию пролина можно представить следующей упрощенной схемой: 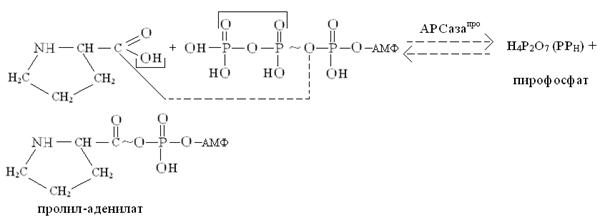 На второй стадии активированный остаток аминокислоты (в нашем случае –остаток пролина) переносится за счет энергии АТФ с аминоациладенилата (аа) (в нашем случае – с пролил-аденилата) на концевую 3′-ОН-группу концевого остатка рибозы т-РНКаа (у нас т-РНКпро), в результате образуется сложноэфирная связь между остатком аминокислоты и остатком рибозы 3′-концевого остатка аденозина, входящего в последовательность нуклеотидов 3′-конца т-РНК (-ЦЦА 3′). Процесс переноса можно отразить следующей схемой: 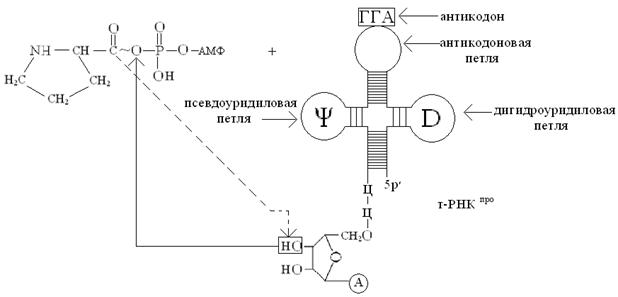 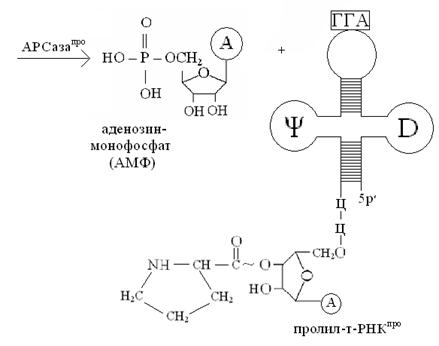 Обратите внимание, что присоединение аминокислот к специфичным т-РНК сопровождается переносом энергии, которая используется на образование пептидных связей (– CONH –) между аминокислотами в процессе биосинтеза белка на рибосоме.
1 этап. Транскрипция ДНК. На транскрибируемой цепи ДНК с помощью ДНК-зависимой РНК-полимеразы достраивается комплементарная цепь мРНК. Молекула мРНК является точной копией нетранскрибируемой цепи ДНК с той разницей, что вместо дезоксирибонуклеотидов в ее состав входят рибонуклеотиды, в состав которых вместо тимина входит урацил. 2 этап. Процессинг (созревание) мРНК. Синтезированная молекула мРНК (первичный транскрипт) подвергается дополнительным превращениям. В большинстве случаев исходная молекула мРНК разрезается на отдельные фрагменты. Одни фрагменты – интроны – расщепляются до нуклеотидов, а другие – экзоны – сшиваются в зрелую мРНК. Процесс соединения экзонов «без узелков» называется сплайсинг. Сплайсинг характерен для эукариота и архебактерий, но иногда встречается и у прокариота. Существует несколько видов сплайсинга. Сущность альтернативного сплайсинга заключается в том, что одни и те же участки исходной мРНК могут быть и интронами, и экзонами. Тогда одному и тому же участку ДНК соответствует несколько типов зрелой мРНК и, соответственно, несколько разных форм одного и того же белка. Сущность транс–сплайсинга заключается в соединение экзонов, кодируемых разными генами (иногда даже из разных хромосом), в одну зрелую молекулу мРНК. 3 этап. Трансляция мРНК. Трансляция (как и все матричные процессы) включает три стадии: инициацию (начало), элонгацию (продолжение) и терминацию (окончание).
тРНК ГЦЦ-ГАУ-ГГУ Пиримидиновые 4 Пуриновые 5 ДНК в ядре ЦГГ-ЦТА-ЦЦА Пиримидиновые 5 Пуриновые 4
  5.14 тема: Энергетический эффект окисления фруктозы-1,6-дифосфата Ответ составьте по следующему плану:
Углеводы => глюкоза=>  Е1 - гексокиназа или глюкокиназа Е2 - глюкозофосфатизомераза
Образование пирувата (гликолиз).
См вопрос 2.
-
Окислительный.
Глюкоза 36/38 АТФ, при окислении данного вещества будет 37/39. |
