Свойства ферментов (чувствительность к pH, термолабильность, специфичность и др.)
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
СВОЙСТВА ФЕРМЕНТОВ (ЧУВСТВИТЕЛЬНОСТЬ К pH, ТЕРМОЛАБИЛЬНОСТЬ, СПЕЦИФИЧНОСТЬ И ДР.)Белковая природа определяет многие свойства ферментов. К таким свойствам относятся высокая чувствительность к pH (рисунок 1), термолабильность (высокая чувствительность к действию температуры), специфичность, многоуровневая разнообразная регуляция. Чувствительность ферментов к pH среды связана с: Ионизацией функциональных групп АК в активном центре ферментов, Изменением заряда поверхностных групп молекул АК ферментов и субстратов. Ионизация групп и изменение заряда приводит к изменению конформации фермента (в первую очередь его активного центра) и субстрата, т.е. влияет на сродство субстрата к активному центру фермента. 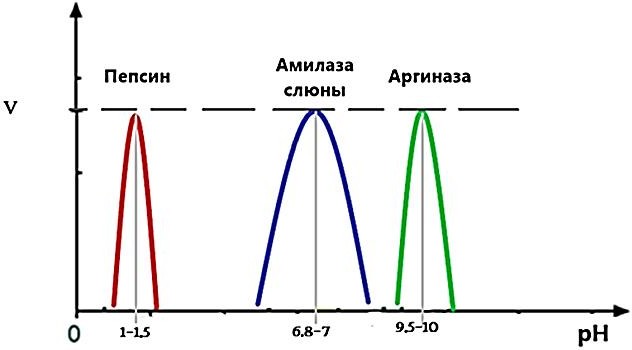 Рисунок 1 — Зависимость активности ферментов от изменения рН среды Каждый фермент характеризуется оптимальным значением рН, при котором его активность максимальна. Для большинства ферментов оптимум рН составляет от 6 до 8. Чувствительность ферментов к температуре (термолабильность). С увеличением t˚ на 10°C скорость реакции возрастает в 2 раза (правило Вант-Гоффа). Однако после 40-50°C фермент денатурирует с потерей каталитической активности. Специфичность ферментов. В клетке одновременно протекает несколько тысяч реакции. Благодаря специфичности фермент способен ускорять протекание одной определенной реакции, не влияя на скорость остальных. Специфичность бывает субстратной и каталитической:Субстратная специфичность. Обеспечивается пространственным соответствием структуры субстрата и активного центра фермента. Субстратная специфичность бывает абсолютной, относительной и стереоспецифичностью. Абсолютная – фермент катализирует реакцию только с одним субстратом. Абсолютной субстратной специфичностью характеризуется уреаза и аргиназа. Групповая – фермент катализирует превращение нескольких субстратов, имеющих один тип связи. Например, пепсин, ферменты ЖКТ, расщепляет белки животного и растительного происхождения. АлкогольДГ катализирует окисление различных спиртов (этанол, метанол и др.) Стереоспецифичность – фермент катализирует реакцию только с одним стереоизомером. Большинство ферментов катализируют реакции L-АМК и не катализируют реакции с D-аминокислотами. Относительная – фермент катализирует превращение субстратов, относящихся к самым разным группам химических соединений. Напрмер цитохром Р450 участвует в реакции гидроксилирования более 7000 различных субстратов. Каталитическая специфичность (специфичность путей превращения). Специфичность путей превращения (по типу катализируемой реакции). Обеспечивает преобразование одного и того же субстрата под действием разных ферментов в различные продукты реакции. При этом каждый фермент превращает субстрат в строго определенный продукт реакции. Например, глюкозо-6-фосфат – это субстрат 4 разных ферментов: фосфоглюкомутаза (метаболический путь синтеза гликогена), гл-6-фосфатаза, гл-6- фосфат изомераза, гл-6-фосфатДГ [1,6,7]. Дополнительную информацию по теме вопроса вы можете узнать из [11-18]. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ. ФОРМИРОВАНИЕ ФЕРМЕНТ- СУБСТРАТНОГО КОМПЛЕКСА. ЭТАПЫ ВЗАИМОДЕЙСТВИЯ ФЕРМЕНТА И СУБСТРАТА. ТЕОРИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ. ОСНОВЫ ТЕРМОДИНАМИКИ КАТАЛИЗА Механизм действия ферментов можно разобрать с точки зрения событий, происходящих в активном центре фермента (I) или с позиции изменения энергетики химических реакций (II). |
