БИОХИМИЯ методичка. Учебнометодическое пособие введение
 Скачать 0.89 Mb. Скачать 0.89 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| № | Аминокислота | Трехбуквенное сокращенное обозначение | Однобуквенное обозначение | |
| 1 | Аланин | ала | Ala | A |
| 2 | Аргинин | арг | Arg | R |
| 3 | Аспарагин | асн | Asn | N |
| 4 | Аспарагиновая кислота | асп | Asp | D |
| 5 | Валин | вал | Val | V |
| 6 | Гистидин | гис | His | H |
| 7 | Глицин | гли | Gly | G |
| 8 | Глутамин | глн | Gln | Q |
| 9 | Глутаминовая кислота | глу | Glu | E |
| 10 | Изолейцин | иле | Ile | I |
| 11 | Лейцин | лей | Leu | L |
| 12 | Лизин | лиз | Lys | K |
| 13 | Метионин | мет | Met | M |
| 14 | Пролин | про | Pro | P |
| 15 | Серин | сер | Ser | S |
| 16 | Тирозин | тир | Tyr | Y |
| 17 | Треонин | тре | Thr | T |
| 18 | Триптофан | три | Trp | W |
| 19 | Фенилаланин | фен | Phe | F |
| 20 | Цинтеин | цис | Cys | C |
Протеиногенные аминокислоты делят на 4 группы по полярности радикалов: 1) неполярные (гидрофобные) (рисунок 1);2)полярные (гидрофильные) незаряженные (рисунок 2);3) отрицательно заряженные (рисунок 3);4)положительно заряженные(рисунок 4).
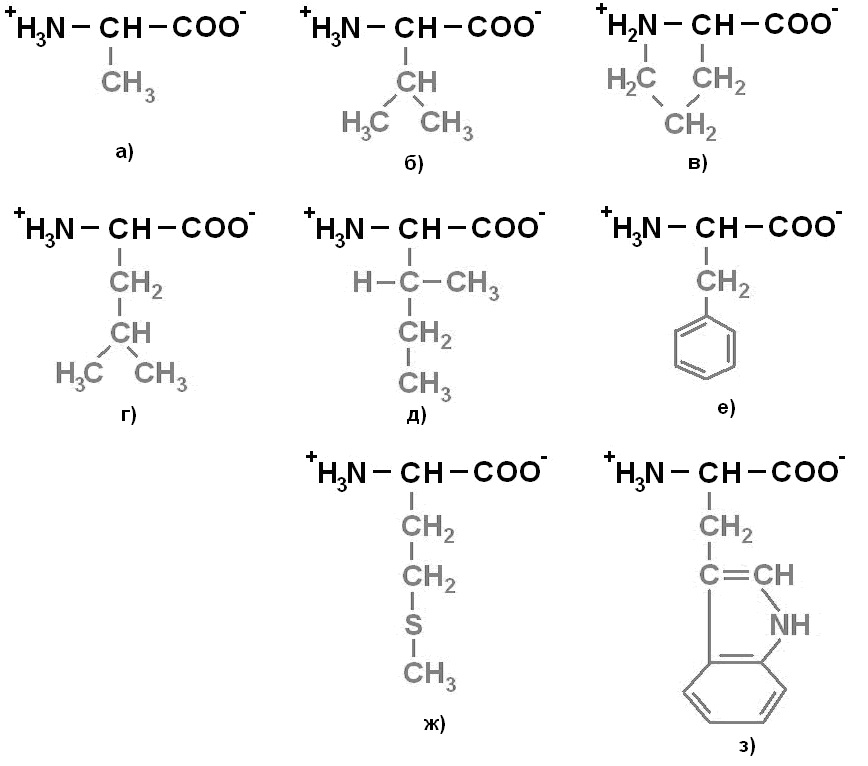
Рисунок 1. Неполярные (гидрофобные) аминокислоты: а) Аланин (Ala) – Ала; б) Валин (Val) – Вал; в) Пролин (Pro) – Про; г) Лейцин (Leu) – Лей; д) Изолейцин (Ile) – Иле; е) Фенилаланин (Phe) – Фен; ж) Метионин (Met) – Мет; з) Триптофан (Trp) – Три.
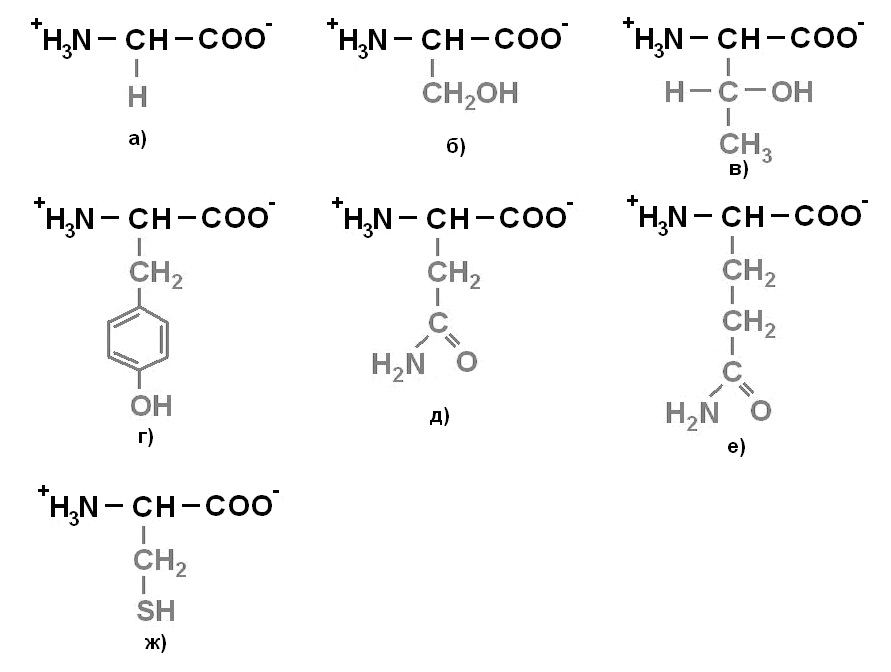
Рисунок 2. Незаряженные полярные аминокислоты: а) Глицин (Gly)- Гли; б) Серин (Ser) – Сер; в) Треонин (Thr) – Тре; г) Тирозин (Tyr) – Тир; д) Аспарагин (Asn) – Асн; е) Глутамин (Gln) – Глн; ж) Цистеин (Cys) - Цис
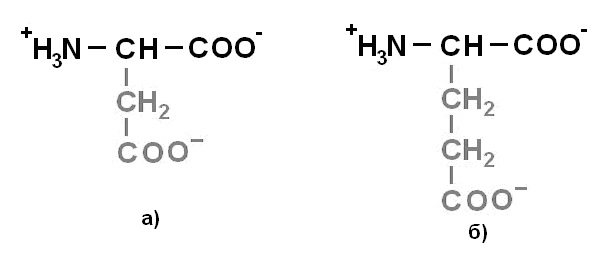
Рисунок 3. Отрицательно заряженные аминокислоты: а) Аспарагиновая кислота (Asp) – Асп; б) Глутаминовая кислота (Glu) – Глу.
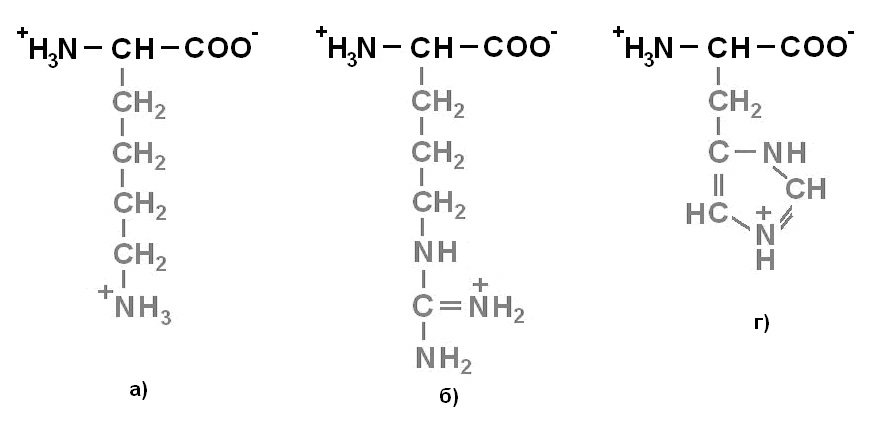
Рисунок 4. Положительно заряженные аминокислоты: а) Лизин (Lys) – Лиз; б) Аргинин (Arg) – Арг; г) Гистидин (His) – Гис.
Радикалы аминокислот участвуют в образовании связей: 1) гидрофобные радикалы участвуют в гидрофобных взаимодействиях; 2) гидрофильные радикалы формируют водородные связи; 3) полярные (заряженные) радикалы образуют ионные связи; 4) сближение двух радикалов цистеина цис-SH + цис-SH ведет к образованию дисульфидной связи цис-S–S-цис.
Лабораторная работа №1
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
ПРИНЦИП РАБОТЫ:
Цветные реакции дают возможность обнаружить присутствие белка в биологических жидкостях и получить представление о его аминокислотном составе.
1.1 Биуретовая реакция открывает пептидную связь в белке. Ее способны давать вещества, которые содержат не менее двух пептидных связей. При добавлении сернокислой меди к сильнощелочному раствору белка или полипептида образуются соединения меди с пептидной группировкой, окрашенные в красно- или сине-фиолетовый цвет в зависимости от длины полипептидной цепи. Раствор белка дает сине-фиолетовое окрашивание, а продукты неполного его гидролиза (пептоны) - розовое или красное.
1.2 Нингидриновая реакция характерна для α-аминогрупп. Растворы белка, α-аминокислот и пептидов при нагревании с нингидрином дают синее или фиолетовое окрашивание. В этой реакции α-аминокислоты и пептиды окисляются нингидрином и подвергаются окислительному дезаминированию и декарбоксилированию с образованием аммиака, альдегида и СО2. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий цвет (комплекс Руэмана). Нингидриновая реакция используется для количественного определения α-аминокислот в аминокислотных анализаторах.
1.3 Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот - триптофана, фенилаланина, тирозина, содержащих бензольное ядро. Большинство белков при нагревании с концентрированной азотной кислотой дает желтое окрашивание, переходящее в оранжевое при подщелачивании вследствие образования натриевой соли динитротирозина. Реакция обусловлена нитрованием бензольного кольца этих аминокислот с образованием нитросоединений желтого цвета.
1.4 Реакция на серусодержащие аминокислоты (реакция Фоля).
Реакцияуказывает на присутствие в белке аминокислот цистина и цистеина, содержащих слабосвязанную серу. Метионин, хотя и является содержащей серу аминокислотой, этой реакции не дает, поскольку сера в нем связана прочно. Реакция состоит в том, что при кипячении белка под действием щелочи от цистеина или цистина легко отщепляется сера в виде сернистого натрия, который с плюмбитом дает черный или бурый осадок сернистого свинца.
1.5 Реакция Паули. Эта реакция на аминокислоту гистидин основана на взаимодействии гистидина с диазобензолсульфоновой кислотой с образованием соединения вишнево-красного цвета.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) NaOH, 10 %, 30 %; 2) CuSO4, 1 %; 3) раствор нингидрина, 0,1 % водный раствор; 4) HNO3, конц.; 5) (CH3COO)2Pb, 5 %; 6) сульфониловая кислота, 1 % раствор в 5 % растворе НСl; 7) NaNO2, 0,5 %; 8) Na2CO3, 10 %; 9) раствор яичного белка для цветных реакций; 10) дистиллированная вода; 11) пробирки, пипетки, спиртовки, держатели.
ХОД РАБОТЫ:
В четыре пробирки наливают по 5 капель раствора белка.
1. В первую пробирку добавляют 3 капли 10 % раствора NaOH и 2 капли 1 % раствора CuS04; содержимое перемешивают. Развивается фиолетовая окраска характерная для биуретовой реакции. Проделывают эту же реакцию с водой. Какая окраска?
2. Ко второй пробирке приливают 5 капель 0,1 % водного раствора нингидрина и кипятят 1-2 минуты. Наблюдают за развитием окраски, свойственной нингидриновой реакции. Проделывают эту же реакцию с водой. Какая окраска?
3. К третьей пробирке добавляют 5 капель концентрированной азотной кислоты и осторожно кипятят. Вначале появляется осадок свернувшегося белка, который при нагревании окрашивается. После охлаждения в пробирку наливают по каплям 10 % раствора едкого натра. Наблюдают за изменением цвета. Проделывают эту же реакцию с водой. Какая окраска?
4. К четвертой пробирке добавляют 5 капель 30 % раствора NaOH и 5 капель 5 % раствора (CH3COO)2Pb, содержимое доводят до кипения. Появляется бурый или черный осадок сульфида свинца. Проделывают эту реакцию с волосом и кусочком ногтя. Проделывают эту же реакцию с водой. Какая окраска?
5. В пятую пробирку наливают 5 капель 1 % раствора сульфаниловой кислоты в 5 % растворе НСl. Затем приливают 10 капель 0,5 % раствора NaNO2, сильно встряхивают и немедленно добавляют 10 капель раствора белка, а после перемешивания 30 капель 10 % раствора Na2CO3. После смешивания растворов наблюдают за развитием окрашивания, свойственного для реакции Паули. Проделывают эту же реакцию с водой. Какая окраска?
Результаты занести в таблицу 2.
Таблица 2
| № | Название реакции | Использованные реактивы | Окраска | Какие группировки открыты в белках |
| 1. | Биуретовая | | | |
| 2. | Нингидриновая | | | |
| 3. | Ксантопротеиновая | | | |
| 4. | Фоля | | | |
| 5. | Паули | | | |
ВЫВОД:
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Что такое белок? Как связаны между собой аминокислоты в молекуле белка?
Назовите функции аминокислот. Охарактеризуйте структуру и общие свойства функциональных групп аминокислот.
Кислотно-основные свойства аминокислот. Какие химические реакции характерны для аминокислот?
Классификация аминокислот по свойствам радикалов.
Особенности оптической изомерии аминокислот. Сколько стереоизомеров имеют аминокислоты?
Что открывает нингидриновая реакция? Напишите уравнение реакции.
Что открывает биуретовая реакция? Напишите уравнение реакции.
Что открывает ксантопротеиновая реакция? Напишите уравнение реакции.
Напишите аминокислоты, содержащие серу. С помощью какой реакции можно их открыть?
С помощью какой реакции можно обнаружить аминокислоту гистидин в белке?
Покажите образование пептидной связи на примере любого трипептида. Охарактеризуйте особенности и свойства пептидной связи.
Тема 2
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. МЕТОДЫ ОСАЖДЕНИЯ БЕЛКОВ. ВЫСАЛИВАНИЕ И ДЕНАТУРАЦИЯ
Белки образуют коллоидные растворы (размеры частиц - 0,1-0,001 мкм), для которых важны следующие характеристики: низкое осмотическое давление, высокая вязкость, низкая способность к диффузии.
Коллоидные свойства белков характеризуют способность белков образовывать устойчивые коллоидные растворы. Коллоидный раствор (раствор ВМС) - размеры частиц дисперсной среды и дисперсной фазы различаются в десятки и сотни раз. Коллоидный раствор состоит из жидкой фазы (золь) и студенистой (гель).
Растворы белков способны к осаждению (коагуляции).
Различают 2 вида реакции осаждения:
1) обратимое осаждение. Белковая молекула в растворе удерживается двумя факторами: зарядом и гидратной оболочкой. При высаливании нарушается гидратная, или водная оболочка, белка. Суммарный заряд белковой молекулы, его структура и свойства при этом не изменяются. Обратимое осаждение вызывается действием нейтральных солей аммония, щелочных и щелочноземельных металлов (высаливание), спирта, ацетона, эфира и некоторых других органических растворителей. Осажденные таким образом белки могут быть вновь растворены, например, если соли удалить методом диализа.
2) необратимое осаждение – денатурация. При этом нарушается гидратная оболочка белковой молекулы и изменяется ее суммарный заряд. Для большинства белков изоэлектрическая точка соответствует слабокислой среде (рН около 5,0). Снятие заряда осуществляется путем подведения рН к изоэлектрической точке. Удаление гидратной оболочки производится водоотнимающими средствами (органические растворители, соли щелочноземельных металлов в высокой концентрации), изменением температуры и др.
Лабораторная работа №2
ДИАЛИЗ РАСТВОРОВ БЕЛКОВ
ПРИНЦИП РАБОТЫ:
С помощью диализа очищают высокомолекулярные растворы белковых веществ от примеси низкомолекулярных соединений (солей, сахаров и др.).
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор яичного белка с хлористым натрием; 2) AgNO3, 0,5 % (в склянке из темного стекла); 3) HNO3, 10 %; 4) NaOH, 10 %; 5) CuSO4, 1 %; 6) кусочки целлофана размером 12,5х12,5 см; 7) дистиллированная вода; 8) стакан, стеклянные палочки.
ХОД РАБОТЫ:
В мешочек из целлофана наливают до половины раствор яичного белка (с хлористым натрием). Мешочек подвешивают на стеклянной палочке и погружают в стакан с дистиллированной водой. Диализ проводят при комнатной температуре. Через 40-60 минут из стакана берут в две пробирки по 2 мл воды. В одной пробирке проводят реакцию на ионы хлора, для чего воду подкисляют несколькими каплями 10 % раствора азотной кислоты и добавляют 2-3 капли раствора азотнокислого серебра, выпадает осадок хлористого серебра. С пробой во второй пробирке производят биуретовую реакцию. Если диализ проводится правильно, биуретовая реакция будет отрицательной.
РЕЗУЛЬТАТЫ и ВЫВОД:
Лабораторная работа №3
ОСАЖДЕНИЕ БЕЛКОВ ВЫСАЛИВАНИЕМ
ПРИНЦИП РАБОТЫ:
Высаливание – это обратимый процесс. Нейтральные соли аммония, щелочных и щелочноземельных металлов – Na2SO4, (NH4)2SO4, NaCl, MgSO4 и другие нейтрализуют заряд белковых частиц и вызывают их дегидратацию, что ведет к выпадению в осадок. Осадки можно снова растворить в воде, при этом наблюдается значительная степень восстановления свойств белков (например, ферментативной активности, антигенных свойств и т.д.). Высаливанием пользуются для разделения белковых фракций, очистки белков, получения их в кристаллическом виде.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор яичного белка с хлористым натрием; 2) NaCl, кристаллический, тонко растертый порошок (в виде пудры); 3) (NH4)2SO4, кристаллический, тонко растертый порошок; 4) (NH4)2SO4, насыщенный раствор; 5) MgSO4, кристаллический, тонко растертый порошок; 6) СН3СООН, 1 %; 7) NaOH, 10 %; 8) CuSO4, 1 %; 9) пробирки, бумажные фильтры.
ХОД РАБОТЫ:
1. Осаждение сернокислым аммонием. В пробирку наливают 2-3 мл раствора белка, добавляют равный объем насыщенного раствора сернокислого аммония и перемешивают. Выпадает осадок глобулинов, альбумины остаются в растворе. Осадок отфильтровывают через бумажный фильтр.
К фильтрату добавляют тонко растертый порошок сернокислого аммония до получения насыщенного раствора (последняя порция соли уже не растворяется). Выпадает осадок альбуминов, который также отфильтровывают.
С фильтратом проделывают биуретовую реакцию. При полном осаждении белков она должна быть отрицательной.
2. Осаждение сернокислым магнием или хлористым натрием. В 2 пробирки наливают по 2-3 мл раствора яичного белка и добавляют (до получения насыщенного раствора) в одну пробирку порошок хлористого натрия, в другую – сернокислого магния. Через 5-6 мин. в пробирках замечается выпадение осадков (глобулины). Альбумины в нейтральных растворах солей щелочных и щелочноземельных металлов не осаждаются.
Содержимое пробирок отфильтровывают через бумажные фильтры. В фильтратах – альбумины. Фильтраты подкисляют 1 % раствором уксусной кислоты – появляются осадки альбуминов. Их отфильтровывают, а в фильтратах с помощью биуретовой реакции доказывают отсутствие белка.
РЕЗУЛЬТАТЫ и ВЫВОД:
Лабораторная работа №4
ОСАЖДЕНИЕ БЕЛКОВ ПРИ КИПЯЧЕНИИ
ПРИНЦИП РАБОТЫ:
Воздействие высокой температуры ведет к тепловой денатурации белков, в результате которой происходят необратимые изменения физико-химических и биологических свойств макромолекул.
На скорость и интенсивность процесса будут влиять рН и добавление электролитов. Быстро и наиболее полно белки денатурируют в изоэлектрической точке. Сдвиги рН в кислую и щелочную стороны затормаживают процесс осаждения белков. В сильно кислых и сильно щелочных растворах осаждения белков при кипячении практически не происходит. При добавлении кислот молекулы белка заряжаются положительно, в щелочных растворах они приобретают отрицательные заряды. Прибавление электролитов (например, хлористого натрия) ускоряет процесс осаждения даже в кислой среде.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор яичного белка (без добавления хлористого натрия); 2) CH3COOH, 1 %; 10 %; 3) NaOH, 10 %; 4) NaCl, насыщенный раствор; 5) пробирки; спиртовки; держатели.
ХОД РАБОТЫ:
В пять пробирок наливают по 5 капель раствора яичного белка.
1. В первой пробирке нейтральный раствор белка нагревают до кипения. Жидкость мутнеет, поскольку разрушаются водные оболочки вокруг молекулы белка, и происходит укрупнение его частиц.
2. Во вторую пробирку добавляют 1 каплю 1 % раствора CH3COOH и нагревают. Хлопьевидный осадок белка выпадает скорее и полнее, т.к. при подкислении рН раствора приблизится к изоэлектрической точке белка.
3. В третью пробирку добавляют 0,5 мл 10 % раствора CH3COOH и нагревают. Даже при кипячении осадка не образуется, поскольку белковые мицеллы перезаряжаются и несут положительный заряд, что повышает их устойчивость.
4. В четвертую пробирку приливают 5 капель 10 % CH3COOH и 2 капли насыщенного раствора NaCl и нагревают. Выпадает белый хлопьевидный осадок, т.к. частицы белка теряют заряд вследствие взаимодействия белка с разноименно заряженными ионами хлористого натрия, а так же теряют гидратную оболочку.
5. В пятую пробирку добавляют 2 капли 10 % раствора NaOH, создавая щелочную среду. При кипячении жидкости осадка не образуется, поскольку в щелочной среде отрицательный заряд на частицах белка увеличивается.
Результаты занести в таблицу 3. Отметить положительную реакцию осаждения плюсом, а отрицательную - минусом. Указать в каждом случае причины появления или отсутствия осадка белка.
Таблица 3
| Нейтральная среда | Слабокислая среда | Сильнокислая среда | Сильнокислая среда + электролит | Щелочная среда |
| | | | | |
ВЫВОД:
Лабораторная работа №5
ОСАЖДЕНИЕ БЕЛКОВ СОЛЯМИ ТЯЖЕЛЫХ МЕТАЛЛОВ
ПРИНЦИП РАБОТЫ:
Осаждение белков солями тяжелых металлов (в отличие от высаливания) происходит при небольших концентрациях солей. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя с ними солеобразные и комплексные соединения, растворимые в избытке этих солей (за исключением солей AgNO3, HgCl2), но нерастворимые в воде. Соли тяжелых металлов вызывают необратимое осаждение белков, т.е. денатурацию. Растворение осадка в избытке солей называется адсорбционной пептизацией. Данное явление происходит вследствие возникновения одноименного положительного заряда на частицах белка.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор яичного белка; 2) CuSO4, 5 %; 3) (CH3COO)2Pb, 5 %; 4) AgNO3, 3 %; 5) FeCl3, 5 %; 6) пробирки.
ХОД РАБОТЫ:
В 4 пробирки наливают по 1-2 мл раствора белка и по каплям добавляют растворы солей: в 1-ую – уксуснокислого свинца; во 2-ую - сернокислой меди; в 3-ю – хлорного железа; в 4-ую – азотнокислого серебра (до выпадения осадков).
Затем прибавляют избыток указанных солей.
РЕЗУЛЬТАТЫ и ВЫВОД:
Лабораторная работа №6
ОСАЖДЕНИЕ БЕЛКОВ
КОНЦЕНТРИРОВАННЫМИ МИНЕРАЛЬНЫМИ КИСЛОТАМИ
ПРИНЦИП РАБОТЫ:
Концентрированные минеральные кислоты вызывают резкую дегидратацию белковых частиц и нейтрализацию их заряда, при этом происходит образование комплексных соединений. В результате происходит денатурация белка. Ортофосфорная кислота осадка не дает. В избытке всех минеральных кислот, за исключением азотной, выпавший в осадок белок растворяется.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор яичного белка; 2) HNO3, конц.; 3) H2SO4, конц.; 4) HCl, конц.; 5) пробирки.
ХОД РАБОТЫ:
В 3 пробирки наливают по 1 мл кислот: в 1-ую – серной; во 2-ую – азотной; в 3-ю – соляной. Пробирки наклоняют под углом 45 º и осторожно (из пипетки) наслаивают по стенке раствор белка (пробирку следует держать отверстием от себя!). На границе белка и кислоты появляется белое кольцо.
Пробирки осторожно встряхивают и добавляют в них избыток соответствующих кислот.
РЕЗУЛЬТАТЫ и ВЫВОД:
Лабораторная работа №7
ОСАЖДЕНИЕ БЕЛКОВ ОРГАНИЧЕСКИМИ ВЕЩЕСТВАМИ
ПРИНЦИП РАБОТЫ:
Органические кислоты вызывают необратимое осаждение белков, чаще используют растворы трихлоруксусной и сульфосалициловой кислот. Сульфосалициловая кислота кроме белков осаждает также продукты их распада - высокомолекулярные пептоны и полипептиды. Трихлоруксусная кислота способна осаждать только белки и не осаждает продукты распада белков.
В органических растворителях(спирт, ацетон и др.) белки не растворяются и выпадают в осадок. В зависимости от природы белка для его осаждения требуются различные концентрации спирта. Спирт связывает воду, вызывая дегидратацию мицелл белка и неустойчивость их в растворе. При осаждении спиртом раствор белка должен быть нейтральным или слабокислым, но не щелочным. Реакция облегчается присутствием электролита хлористого натрия вследствие снятия заряда с частиц белка. Реакция осаждения белка спиртом или кратковременным действием спирта обратима при охлаждении. Если осадок быстро отделить от спирта, то белок может сохранить нативное состояние.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) сульфосалициловая кислота, 20 %; 2) трихлоруксусная кислота, 10 %; 3) этиловый спирт; 4) раствор яичного белка; 5) пробирки.
ХОД РАБОТЫ:
В 3 пробирки отбирают по 5 капель раствора яичного белка.
В 1-ую пробирку добавляют 2 капли раствора сульфосалициловой кислоты. Во 2-ую – 2 капли трихлоруксусной кислоты. В 3-ю приливают 15-20 капель этилового спирта (раствор мутнеет), затем добавить 1 каплю насыщенного раствора хлористого натрия.
РЕЗУЛЬТАТ и ВЫВОД:
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Объясните факторы устойчивости коллоидного раствора белка.
От чего зависит заряд белка в водном растворе?
Что такое изоэлектрическая точка белка? Какой заряд будут иметь водные растворы белка с избыточным количеством свободных карбоксильных групп?
Какой заряд будут иметь водные растворы белка с избыточным количеством аминогрупп? В какой среде будет ИЭТ такого белка?
Чем обусловлены реакции осаждения белков? При каких температурных условиях возможно осаждение белков?
Что такое обратимое и необратимое осаждение белков?
Что такое денатурация белка? Дайте характеристику денатурирующим агентам?
Что происходит с белковой молекулой при высаливании?
Тема 3
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА. ОЦЕНКА НА ОСНОВАНИИ ФОТОМЕТРИИ ПРОДУКТОВ ЦВЕТНОЙ РЕАКЦИИ. ПОСТРОЕНИЕ КАЛИБРОВОЧНЫХ ГРАФИКОВ
Наиболее распространенным методом количественного определения белка является метод, основанный на биуретовой реакции, с последующей фотометрией цветных продуктов реакции. Биуретовая реакция открывает пептидную связь в белке.
Метод оценки количества вещества базируется на использовании калибровочного графика, а также концентрации стандартных проб, обрабатываемых параллельно с опытными в одинаковых с ними условиях.
Построение калибровочного графика:
1. Построение калибровочной кривой начинается с приготовления ряда разведений стандартного раствора исследуемого вещества. Стандартный раствор содержит вещество в известной концентрации. Разведения стандартного раствора должны охватывать диапазон физиологических концентраций и выходить за пределы их минимальных и максимальных величин.
(!) Например, при исследовании содержания белка в сыворотке крови концентрация стандартного вещества (альбумина) должна быть в интервале от 40 до 120 г/л (при физиологической концентрации общего белка 65-85 г/л).
Ряд калибровочных разведений получают путем разбавления основного стандартного раствора.
2. Затем ведут обработку стандартных растворов аналогично опытным пробам. Измеряют оптическую плотность калибровочных растворов и опытной пробы на одном и том же приборе. Измерения оптической плотности начинают со стандартного раствора наименьшей концентрации.
3. Усредненные (соответствующие отдельным концентрациям) значения оптической плотности - D (абсорбции - А, экстинкции - Е) наносят на миллиметровую (калибровочную) бумагу. На оси абсцисс (горизонтальной) с соблюдением одинаковых интервалов в равномерно возрастающей концентрации откладывают показатели содержания вещества в стандартном растворе; на оси ординат (вертикальной) - соответствующие им величины оптической плотности (рисунок 5).
Зависимость между концентрацией вещества в стандартных (калибровочных) пробах и оптической плотностью, соответствующей этим пробам, отражается линией, построенной по точкам. Строить калибровочный график следует не менее чем по пяти точкам.
Калибровочная кривая прокладывается таким образом, чтобы по возможности большее число точек (например, 3 из 5) лежало на линии, а остальные располагались близ нее, равномерно отклоняясь в ту и другую стороны. Отдельные точки, значительно смещающиеся от калибровочной кривой и обычно являющиеся результатом грубой ошибки в определении, исключаются из учета.
Расположение кривой определяют так, чтобы она исходила из нулевой отметки под углом 45 ° к осям координат: при этом достигается наибольшая точность измерений. Последней способствует также выбор оптимального, достаточно крупного масштаба.
Определение количества вещества в опытной пробе с использованием калибровочного графика:
1. Определение оптической плотности раствора вещества с неизвестной концентрацией (опытной пробы). Исследование проводят против контроля, либо, если опытная проба слабоокрашенная, смотрят против дистиллированной воды.
2. Полученное значение откладывают на калибровочном графике путем опускания перпендикуляров: - с оси ординат на калибровочную кривую; - с кривой на ось абсцисс.
3. Полученное в результате значение концентрации на оси абсцисс и является искомой концентрацией.

Рисунок 5. Схема построения калибровочного графика.
Лабораторная работа №8
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА
ПРИНЦИП МЕТОДА:
Белки реагируют в щелочной среде с сернокислой медью с образованием соединений, окрашенных в фиолетовый цвет (биуретовая реакция). Реакция обусловлена образованием биуретового комплекса в результате соединения меди с пептидной группировкой белка.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) NaCl, 0,9 %; 2) биуретовый реактив: 0,15 г CuSO4 · 5H2O и 0,6 г NaKC4H4O6 · 4H2O (виннокислый натрий-калий, или сегнетова соль) растворяют в 50 мл Н2О, при энергичном перемешивании приливают туда 30 мл 10%-ого раствора NaOH (свободного от Na2CO3), добавляют 0,1 г KI и раствор доводят водой до 100 мл. Хранят в полиэтиленовой склянке; 3) стандартный раствор альбумина (БСА – бычий сывороточный альбумин), 10 мг белка в 1 мл; 4) раствор сыворотки с разведением в 10 раз: взять 1 мл сыворотки крови довести дистиллированной водой или 0,9 % раствором NaCl до объема 10 мл. Полученная концентрация белка будет соответствовать 6,5-8,5 г/л; 5) пробирки, пипетки; 6) ФЭК.
ХОД РАБОТЫ:
1. Опытная проба: к 4 мл биуретового реактива добавляют, избегая образования пены, 1 мл приготовленного раствора сыворотки крови с 10-ти кратным разведением.
2. Контрольная проба: к 1 мл раствора хлорида натрия приливают 4 мл биуретового реактива.
Пробы делают в 2-х повторениях!
Через 45-50 мин опытную пробу колориметрируют на ФЭКе при длине волны 540 нм против контрольной пробы (либо против дистиллированной воды).
3. Расчет ведут по калибровочной кривой. Данные для построения калибровочного графика приведены в таблице 4.
Таблица 4
Данные для построения калибровочного графика
| № пробы | Рабочий р-р биуретового реактива (мл) | Стандартный р-р белка (мл) | 0,9 % р-р NaCl или дист Н2О (мл) | Содержание белка в пробе (г) | Концентрация белка (г/л) |
| 1. | 4 | 0,2 | 0,8 | 0,002 | 2,0 |
| 2. | 4 | 0,4 | 0,6 | 0,004 | 4,0 |
| 3. | 4 | 0,6 | 0,4 | 0,006 | 6,0 |
| 4. | 4 | 0,8 | 0,2 | 0,008 | 8,0 |
| 5. | 4 | 1,0 | 0 | 0,010 | 10,0 |
При построении калибровочной кривой серию стандартных растворов обрабатывают так же, как и опытные пробы. Пробы перемешивают и оставляют при комнатной температуре на 30 мин, после чего колориметрируют на ФЭКе при 540 нм против дистиллированной воды.
Измерения оптической плотности стандартных растворов начинают с растворов наименьшей концентрации.
Пробы делают в 2-х повторениях!
По результатам измерений строится калибровочная кривая. Средние значения оптической плотности (А) 2-х повторений (соответствующие различным концентрациям) наносят на миллиметровую бумагу на оси ординат, на оси абсцисс откладывают значения концентрации стандартных растворов белка (С).
Полученную по графику концентрацию белка в исследуемой опытной пробе умножают на величину разведения (х10).
Значения концентрации общего белка в сыворотке крови практически здоровых людей составляет 65-85 г/л.
РЕЗУЛЬТАТЫ и ВЫВОД:
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Опишите физико-химическую характеристику пептидной связи. Почему пептидные связи являются основой строения белка?
Как определить количество вещества с использованием калибровочной кривой?
Какова концентрация общего белка в сыворотке крови здорового человека?
Тема 4
ГИДРОЛИЗ БЕЛКА. ХАРАКТЕРИСТИКА ПЕПТИДНОЙ СВЯЗИ
Гидролиз – распад сложного вещества на более простые составные части, связанный с присоединением воды по месту разрыва связей. В зависимости от применяемого катализатора различают кислотный, щелочной и ферментативный гидролиз. При гидролизе простого белка конечными продуктами являются только аминокислоты. В организме гидролиз белка постоянно происходит в процессе, как пищеварения, так и жизнедеятельности клеток под действием протеолитических ферментов.
При кислотном гидролизе белка разрушаются некоторые аминокислоты: триптофан подвергается полному разрушению, а серин, треонин, цистин, тирозин, фенилаланин – частичному. Однако процент разрушения этих аминокислот невелик. При щелочном гидролизе белка отмечается более сильное разрушение аминокислот. Гидролизаты белка применяются в качестве лечебных препаратов.
Лабораторная работа №9
КИСЛОТНЫЙ ГИДРОЛИЗ ПРОСТОГО БЕЛКА
ПРИНЦИП РАБОТЫ:
При кислотном гидролизе белки распадаются сначала на высокомолекулярные пептиды, затем на низкомолекулярные пептиды, дипептиды и, наконец, на аминокислоты.
Полный гидролиз белка протекает при многочасовом кипячении раствора в круглодонной колбе с воздушным холодильнике в присутствии соляной или серной кислоты.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор яичного белка; 2) HCl, конц.; 3) NaOH, 10 %; 4) H2SO4, 1 %; 5) круглодонная колба с воздушным холодильником; 6) электрическая плитка с асбестовой сеткой; 7) штатив.
ХОД РАБОТЫ:
1. Кислотный гидролиз простого белка. Для гидролиза в круглодонную колбу отмеривают 20 мл раствора яичного белка и 5 мл концентрированной соляной кислоты, колбу закрывают пробкой с длинной стеклянной трубкой и закрепляют на штативе с асбестовой сеткой. Содержимое кипятят (под тягой) 45-90 мин.
2. Открытие промежуточных продуктов распада белка в гидролизате при помощи биуретовой реакции. По окончании кипячения в пробирку наливают 5 капель гидролизата белка и нейтрализуют 10 % раствором щелочи по красному лакмусу (опускают кусочек лакмуса в пробирку и помешивают стеклянной палочкой). После нейтрализации гидролизата (при посинении лакмуса) проводят биуретовую реакцию, прибавляя 2 капли CuSO4.
Промежуточные продукты распада белка – пептоны – при проведении биуретовой реакции дают розовое или красное окрашивание, а белки – сине-фиолетовое.
При полном гидролизе белка (2,5 часа до аминокислот биуретовая реакция с гидролизатом белка отрицательная.
По окончании гидролиза гидролизат используют для лабораторной работы №10.
Лабораторная работа №10
ФОРМОЛОВОЕ ТИТРОВАНИЕ (по Серенсену)
ПРИНЦИП РАБОТЫ:
При гидролизе белка вследствие разрыва пептидных связей в нем происходит нарастание одновременно карбоксильных и аминных групп в эквивалентных количествах. Для определения количества карбоксильных групп используется метод Серенсена.
Аминокислоты в водных растворах образуют внутримолекулярные соли, поэтому без предварительного блокирования аминогрупп формальдегидом непосредственно титровать карбоксильные группы аминокислот щелочью невозможно. В процессе реакции с формальдегидом аминогруппа теряет свои основные свойства.
Образующееся метиленовое соединение (метиленаминокислота) легко может быть оттитровано щелочью.
Определяя количество карбоксильных групп титрованием, одновременно можно судить и о содержании аминных групп, так как количество титруемых карбоксильных групп эквивалентно количеству связанных формальдегидом аминных групп. Метод формолового титрования позволяет следить за ходом гидролиза белка и изучать действие протеолитических ферментов.
Конец гидролиза белка совпадает с моментом, когда количество аминных и карбоксильных групп в гидролизате перестанет увеличиваться и наблюдается отрицательная биуретовая реакция.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) животный уголь, тщательно измельченный; 2) CH3COOH, 1 %; 3) формалин нейтральный, 20 %; 4) фенолфталеин; 5) NaOH, 0,005 н.; 6) HCl или CH3COOH, 1 %; 7) конические колбы на 50 мл; 8) пипетки на 1 и 2 мл; 9) микробюретки; 10) цилиндр мерный на 25 мл.
ХОД РАБОТЫ:
1. Титрование карбоксильных групп в растворе белка до гидролиза. Отмеривают в колбочку 1 мл раствора яичного белка, приливают 5 капель 20 % нейтрального раствора формалина и 3 капли 0,5 % раствора фенолфталеина. Титруют из микробюретки 0,005 н. раствором NaOH до устойчивой бледно-розовой окраски.
2. Титрование карбоксильных групп после гидролиза белка (т.е. в гидролизате). Через 45 или 90 минут гидролиз прерывают, а в колбочку всыпают (на кончике ножа) животный уголь для обесцвечивания буроватого раствора, взбалтывают и кипятят 5 минут. Затем гидролизат охлаждают, выливают в цилиндр, доводят объем жидкости до 25 мл дистиллированной водой и фильтруют.
Отмеривают в колбочку 1,25 мл гидролизата, добавляют 3 капли раствора фенолфталеина и нейтрализуют 10 % раствором NaOH из макробюретки до слабо-розовой окраски. Если при нейтрализации окраска делается ярко-красной, то добавляют до обесцвечивания по каплям 1 % раствор уксусной кислоты, избыток которой нейтрализуют 1 % раствором NaOH до слабо-розовой окраски. Затем приливают 5 капель нейтрального 20 % раствора формалина и обесцвеченный раствор титруют 0,005 н. раствором NaOH до бледно-розового цвета и точно отмечают количество затраченной щелочи.
3. Расчет азота аминогрупп производят по количеству затраченной щелочи, исходя из ее нормальности.
Заполнить таблицу 5.
Таблица 5
| Ход работы | Количество мл щелочи (до гидролиза белка) | Количество мл щелочи (после 45 минут гидролиза белка) | Количество мл щелочи (после 90 минут гидролиза белка) | Расчет азота аминогрупп по количеству затраченной щелочи |
| | | | | |
ВЫВОД:
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Что такое гидролиз белка и как его производят?
Как установить конец гидролиза белка?
Какое значение имеет определение карбоксильных групп методом формолового титрования?
Каков принцип и химизм формолового титрования?
Как различаются белки по форме их молекул?
Что понимают под первичной структурой белка? Какие связи формируют эту структуру?
Что представляет собой вторичная структура белка? Какие связи ее формируют?
Что такое водородная связь?
Что понимают под третичной структурой белка? Какие связи формируют эту структуру?
Чем различаются структуры молекул глобулярных и фибриллярных белков?
Что понимают под четвертичной структурой белка?
Какими методами изучают структуру белковой молекулы?
Тема 5
ХРОМАТОГРАФИЧЕСКОЕ РАЗДЕЛЕНИЕ АМИНОКИСЛОТ
Хроматографические методы применяются для сорбционно-динамического разделения смеси аминокислот, белков (а также углеводов, липидов и их метаболитов).
Различают несколько видов хроматографии:
1) адсорбционная – основана на различной способности отдельных компонентов смеси адсорбироваться на поверхности твердой фазы сорбента (М.С. Цвет, 1903 г.);
2) распределительная – основана на различной растворимости разделяемых веществ в двух малосмешивающихся жидкостях;
3) ионообменная – основана на различной способности разделяемых веществ к обмену их ионов на ионы неподвижной фазы сорбента;
4) осадочная – основана на образовании труднорастворимых осадков в определенной последовательности;
5) диффузионная – основана на разделении веществ по скорости диффузии внутрь сорбента в зависимости от размера молекул.
Различают хроматографические методы и по технике выполнения: колоночная и плоскостная. В зависимости от агрегатного состояния фаз: газовая, жидкостная и газожидкостная хроматография. По направлению движения растворителя: восходящая, нисходящая, одномерная, двумерная и радиальная.
Лабораторная работа №11
ХРОМАТОГРАФИЧЕСКОЕ РАЗДЕЛЕНИЕ АМИНОКИСЛОТ НА БУМАГЕ
ПРИНЦИП РАБОТЫ:
С помощью хроматографии можно выделить отдельные вещества из небольшого количества сложной смеси.
Отдельные аминокислоты обладают различной растворимостью в двух частично смешивающихся жидкостях, одной из которых является вода, а другой – водонасыщенный органический растворитель, например фенол. Из них один растворитель должен быть полярный (неподвижная фаза), а другой – неполярный (подвижная фаза). Более гидрофобные аминокислоты, лучше растворяющиеся в неполярном растворителе, движутся с большей скоростью от линии старта, чем гидрофильные аминокислоты. В результате этого смесь аминокислот по окончании хроматографического разделения оказывается на разном расстоянии от линии старта.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) растворы аминокислот; 2) смесь бутанола, уксусной кислоты и воды (15:3:7) или водонасыщенный раствор фенола; 3) нингидрин, 0,2 % спиртовой раствор; 4) вертикальные хроматографические камеры; 5) полоски хроматографической бумаги (длина 20-30 см, ширина 10-12 см); 6) капилляры для нанесения аминокислот; 7) пинцеты; 8) сушильный шкаф, нагретый до 70-90 ºС; 9) линейка с делениями.
ХОД РАБОТЫ:
На полоске хроматографической бумаги простым карандашом проводят стартовую линию на расстоянии 2-3 см от нижнего края. В точки 1,2,3 (обозначенные карандашом на расстоянии 2 см друг от друга) наносят специальной пипеткой (или стеклянным капилляром) аминокислоты: в точку 1 - триптофан (аланин или аргинин), в точку 2 - глицин (аргинин или лизин), в точку 3 - их смесь. Нанесение проводят в несколько приемов, следя за тем, чтобы пятно раствора при каждом прикосновении капилляра к бумаге не растекалось более чем на 3 мм. Каждую последующую порцию раствора наносят после полного высыхания предыдущей. Диаметр пятна не должен превышать 5 мм. Расстояние точек от бокового края хроматографической бумаги должно быть не менее 2 см. Полоску бумаги следует держать за края (!)
Полоску хроматографической бумаги с нанесенными на нее растворами (после высушивания) помещают в хроматографическую камеру, в которую предварительно (за сутки) налита разделительная система бутанола, уксусной кислоты и воды (15:3:7) или водонасыщенный фенол. Нижний край хроматограммы погружают в жидкость примерно на 3-5 мм и подвешивают в камере, которую затем закрывают.
После достижения фронтом растворителя (водной смеси, бутанола и уксусной кислоты или фенола) верхнего конца бумаги (1-1,5 часа), полоску просушивают в сушильном шкафу, предварительно отметив границу фронта растворителя. После этого опускают её в 0,2 % спиртовой раствор нингидрина на 3 секунды. Затем просушивают в сушильном шкафу при температуре 70-90 ºС (15 минут). Позиции аминокислот на хроматограмме выявляются в виде сине-фиолетовых пятен.
Вклейте хроматограмму в тетрадь. Идентифицируйте пятна, рассчитав для каждого пятна коэффициент распределения Rf или скорость перемещения по формуле:
Rf = а/ b,
где а – расстояние в мм, пройденное аминокислотой от места нанесения аминокислоты до середины ее пятна; b – расстояние в мм от места нанесения аминокислоты до фронта растворителя.
РЕЗУЛЬТАТЫ и ВЫВОД:
КОНТРОЛЬНЫЕ ВОПРОСЫ:
В чем принцип метода хроматографии?
Перечислите методы хроматографического разделения аминокислот?
Как проводится восходящая хроматография на бумаге?
Какие системы растворителей используются для распределительной хроматографии на бумаге?
Какая цветная реакция лежит в основе хроматографического выявления аминокислот на бумаге?
Объясните принцип разделения аминокислот методом тонкослойной ионообменной хроматографии?
В чем состоит принцип метода электрофореза?
