химия экзамен. все билеты химия учить. Виды энергии Механическая Тепловая Электрическая Световая
 Скачать 3.4 Mb. Скачать 3.4 Mb.
|
|
Билет 1. Предмет и место химии в системе естественно-научных дисциплин. Формы существования материи – вещество и поле. Масса и энергия (различные виды энергии), единицы измерения. Температура, шкалы Кельвина, Цельсия, Фаренгейта. Закон сохранения материи, массы, энергии. Соотношение Эйнштейна. Химия –естественно-научная дисциплина, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи. Таким образом, главным объектом химии как науки являются вещества и их превращения. Известны две формы существования материи как объективной реальности: вещество и поле. Вещество – материальный объект, имеющий собственную массу (меру инертности материи) или массу покоя. Поле – материальная среда, в которой осуществляется взаимодействие частиц. Поле характеризуется и проявляется в различных видах энергии. Масса является свойством материи, мерой ее инерции, так же как энергия – мера ее движения. И поэтому масса и энергия неотделимы от материи, но они не эквивалентны и не превращаются друг в друга. В системе СИ масса измеряется в кг, а энергия в Дж (Ньютон/метр). Виды энергии:· Механическая· Тепловая Электрическая· Световая Механическая энергия делится на потенциальную (связана с гравитационным полем и определяется положением тела относительно других тел, а так же строением тела. En=mgh) и кинетическую (определяется движением тела относительно других тел. Ек=mV²/2) энергии. [Дж] Тепловая энергия – мера способности совершения работы, которая определяется как полная кинетическая энергия молекул вещества. В системе СИ Дж или Калории (Кал) 1кал=4,184Дж. Кал – количество энергии, которая потребуется для повышения температуры 1 грамма воды на 1° от 14,5° до 15,5°С. Электрическая энергия – это кинетическая энергия ускоренного из состояния покоя электрона под действием электрического поля с разностью потенциалов 1В. 1эВ=1,6*10-19Дж. [эВ] Электрохимическая энергия – это энергия хим реакций, в результате которых появляется напряжение. Еэлх=UIr, где U-напряжение (Вольт), I-сила тока (Ампер), r-время превращения (Цельсия). [Дж] Энергия электро-магнитного излучения [Гц] – энергия, заключенная в электромагнитном поле.[Дж] Еэм=hV, где h-постоянная планка=6,626*10-34Дж*с, V-частота(1/с, Гц) Е  эм=hc/Л, где h-/-, c-скорость света=3*10^8м/с, Л-длина волны, м. эм=hc/Л, где h-/-, c-скорость света=3*10^8м/с, Л-длина волны, м.Температура – это мера средней кинетической энергии молекул, определенная по условной температурной шкале. Температурные шкалы: Шкала Цельсия t, °C Шкала Кельвина T, K (Термодинамическая) Шкала Фаренгейта t, °F T K= t°C +273,15; T(F)=9/5*t°C+32 Н.у.: t=0°C; T=273,15K; t(F)=32°F; p=1атм=101,3кПа=760мм.рт.ст Ст.у.: t=25°C; T=298,15K; T(F)=9/5*25+32=77°F; p=1атм Закон сохранения материи. (1748 год – Ломоносов) Материя не берется ни откуда и не исчезает, а переходит из одной формы в другую. Закон сохранения массы. (1748г М. В. Ломоносов) Масса исходных компонентов реакции равна массе продуктов. Закон сохранения энергии. (1748 год – Ломоносов) Энергия не появляется ни откуда и не исчезает, а переходит из одного вида в другой. Е=mc² - Уравнение Эйнштейна. Полная энергия вещества равна массе на скорость света в 2. Уравнение Энштейна hV=Aвых+mV2/2 Смысл уравнения Энштейна: Энергия кванта тратится на работу выхода электрона из металла(полупроводника) и сообщение электрону кинетической энергии. v – частота, m – масса электрона, V – скорость электрона, h – постоянная Планка, A – работа выхода электрона Билет2. Основные положения атомно-молекулярного учения и стехиометрические законы. Количественные характеристики химических элементов и их соединений: относительная атомная и молекулярная масса, моль, молярный объём, эквивалент, эквивалентная масса и объём. Основные положения атомно-молекулярного учения 1) Все вещества состоят из молекул, а они из атомов. 2) Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида, в том числе и по свойствам. 3) Частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц. 4) При взаимодействии атомов образуются молекулы: гомоядерные – при соединении атомов одного вида (например, H2, O2), образующиеся при этом вещества называются простыми; гетероядерные – при взаимодействии атомов разного вида (например, H2O, H2SO4), образующиеся при этом вещества называются сложными. 5) При физических явлениях молекулы сохраняются, при химических – разрушаются (или образуются новые), атомы же и при физических, и при химических реакциях остаются неизменными. 6) Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества. 7) Атомы одного элемента не превращаются в атомы другого в результате химического взаимодействия. 8) Атомы разных элементов взаимодействуют друг с другом по законам наибольшей простоты. Стехиометрические законы – это законы о количественном составе веществ и количественных соотношениях между реагирующими веществами. 1748г. М. В. Ломоносов. Закон сохранения материи (материя не берется ни откуда и не исчезает, а переходит из одной формы в другую) и Закон сохранения массы (масса исходных компонентов реакции равна массе продуктов) 1793г. Рихтер. Закон эквивалентов (элементы химически взаимодействуют между собой в строго определенных количествах, сохраняющихся в виде неизменных пропорциональных чисел при переходе от одного сложного тела к другому) 1799г. Пруст. Закон постоянства состава вещества (любое чистое вещество, независимо от способа получения, имеет постоянный качественный и количественный состав.) 1804г. Дж. Дальтон. Закон кратных отношений (если два элемента образуют между собой несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как небольшие целые числа). 1808г. Гей-Люссак. Закон простых объемных отношений (объемы реагирующих газов относятся друг к другу и к объемам газообразных продуктов как небольшие целые числа. аА+bВ→сС+dD V(A):V(B)=a:b. 1811г. Авогадро. Закон Авогадро (в равных объемах различных газов при одинаковых условиях содержится одинаковое количество молекул). Из этой гипотезы следует, что 1 моль любого газа занимает объем 22,4 л/моль, а массы двух различных газов, занимающих одинаковый объем относятся между собой как их молярные массы. 1801 год – Дальтон. Закон парциальных давлений – общее давление смеси газов, не вступающих в реакцию друг с другом равно парциальному давлению ее составляющих частей. Относительная атомная масса – среднее значение массы атома химического соединения, выраженное в атомных единицах массы [г]. Дальтон определил атомную массу элемента как отношение массы атома данного элемента к массе атома водорода. В настоящее время относительной атомной массой называется безразмерное число, показывающее, во сколько раз масса данного атома больше, чем масса 1/12 атома изотопа углерода 12С. Молекулярная масса – масса молекулы, выраженная в атомных единицах массы. Молекулярная масса в действительности представляет собой среднюю массу молекулы с учетом изотопного состава всех элементов, образующих данное соединение. М  оль – количество вещества, содержащее столько формульных единиц (молекул, атомов, ионов, электронов, и др), сколько содержится атомов в 12 г (точно) изотопа углерода 12С. оль – количество вещества, содержащее столько формульных единиц (молекул, атомов, ионов, электронов, и др), сколько содержится атомов в 12 г (точно) изотопа углерода 12С.При одинаковых условиях 1 моль любого газообразного вещества занимает один и тот же объем, при нормальных условиях(0°С и 101 кПа) молярный объем равен 22,4л. Эквивалент – это такое количество вещества, которое соединяется или замещает один моль атома водорода. Эквивалент - нечто равноценное или соответствующее в каком-либо отношении чему-либо, заменяющее его или служащее его выражением. {\displaystyle {\ce {NaOH + HCl = NaCl + H2O}}} {\displaystyle {\ce {Na^+}}}{\displaystyle {\ce {Zn(OH)2 + 2HCl = ZnCl2 + 2H2O}}}{\displaystyle {\ce {{\frac {1}{2}}Zn(OH)2}}}Эквивалентная масса – масса одного эквивалента вещества. Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентном вещества. Эквивалент водорода=1моль, значит, в 22,4 л Н2 содержится 2 эквивалента водорода. Эквивалентный объем водорода равен 22,4/2=11,2л/моль. Эквивалентным Билет 3. Сложность строения атома: катодные лучи и их свойства, определение массы и заряда электрона. Открытие радиоактивности и её основные типы (α, β, γ). Модель строения атома Томсона.Экв 1 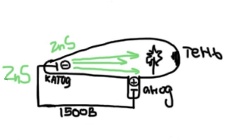 850г (Массон) Ввел понятие катодных лучей, которые испускаются из области катода в вакууме. 850г (Массон) Ввел понятие катодных лучей, которые испускаются из области катода в вакууме. 1870-1895гг (Крукс) Провел наглядный опыт, и детально изучил катодные лучи. 1897г (Томпсон) Проводит опыты над катодными лучами в магнитном поле и определяет их свойства. Свойства лучей: О 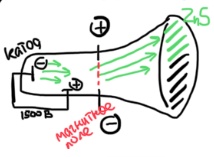 тклоняются под действием электрического и магнитного полей. тклоняются под действием электрического и магнитного полей.не зависят от материала катода не зависят от природы газа. Отрицательно заряжены, потому что движутся по направлению к положительному полюсу трубки. Вызывают свечение некоторых веществ, нанесенных на внутреннюю поверхность трубки Обладают кинетической энергией, способны передавать механическое движение верхушке с лопастями. В 1897 г. Дж. Томсон впервые определил удельный заряд электрона е/m почти по такой схеме, использовав газоразрядную трубку. Электронный пучок проходил через отверстие в аноде и попадал в область однородного электрического поля конденсатора и перпендикулярного ему магнитного поля, создаваемого катушкой с током. E=V0*B Наиболее ярким свидетельством сложного строения атома явилось открытие явления радиоактивности, сделанное французским физиком Антуаном Анри Беккерелем в 1896 г. Радиоактивность – самопроизводное превращение изотопа 1 химического элемента в изотоп другого химического элемента, сопровождающееся испусканием потока элементарных частиц, обладающих высокой проникающей способностью.Явление радиоактивности – явление испускания некоторыми электронами излучения, способного проникать сквозь вещества, ионизировать воздух, вызывать почернение фотопластинок. 1896г(Беккерель/Рентген) Альфа и гамма излучение. Почернение фотопластинки сквозь черный ящик. Рентгеновские лучи (x-ray лучи). Положительно заряженные частицы назвали a-частицами, отрицательно заряженные — b-частицами, а нейтральные — g-частицами или g -квантами. Также Резерфорд выяснил, что излучение первого вида едва проходило сквозь лист бумаги, второго — проникало сквозь алюминиевую пластинку толщиной до 1 мм, а третье было способно проходить через слой свинца толщиной в несколько сантиметров. Ему удалось доказать, что a-лучи являются потоком ядер атомов гелия. В том же году Беккерель доказал, что b-лучи являются потоком электронов. g 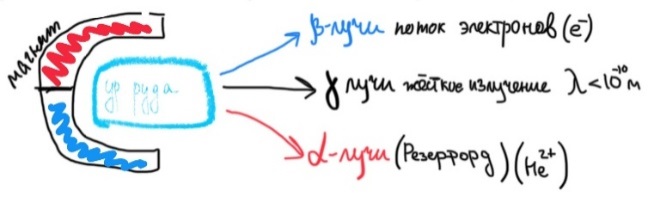 – лучи нейтрально заряжены. – лучи нейтрально заряжены.1898г (Мария и Пьер Кюри) открывают полоний (²¹⁰ 84 Po) и радий (²²⁵88Ra). В 1899 г. в результате опыта, проведенного под руководством английского физика Эрнеста Резерфорда, было обнаружено, что радиоактивное излучение радия неоднородно, т. е. оно имеет сложный состав. 1 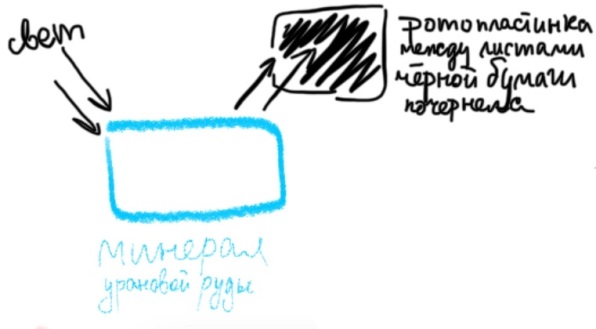 869г Периодический закон. 869г Периодический закон.1 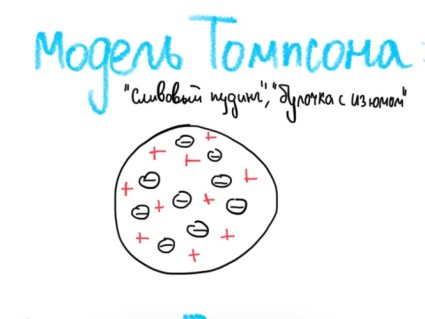 909г Модель Томпсона. «Сливовый пудинг» « булочка с изюмом» 909г Модель Томпсона. «Сливовый пудинг» « булочка с изюмом» Атом – шар, по всему объему которого равномерно распределен положительный заряд. Внутри шара находятся электроны. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю. Недостатки модели атома Томпсона: 1. Не объясняет дискретный характер излучения атома и его устойчивость. 2. Не дает возможности понять, что определяет размеры атомов. 3. Противоречит опытам Резерфорда по исследованию распределения положительного заряда в атоме. Б 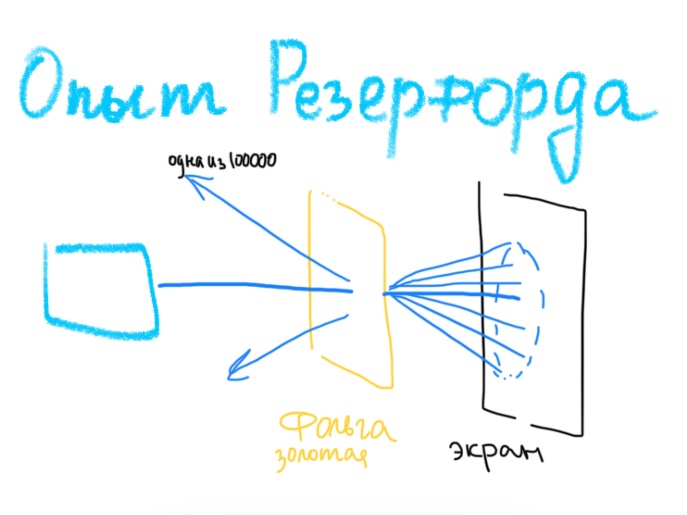 илет 4. Опыты Резерфорда. Планетарная модель атома. Соотношение Мозли и его использование для определения заряда ядра атомов химических элементов. илет 4. Опыты Резерфорда. Планетарная модель атома. Соотношение Мозли и его использование для определения заряда ядра атомов химических элементов.Опыт Резерфорда доказал, что частицы, которые проходили сквозь лист фольги, вызывали изменения на экране. Этим он объяснил, что положительный заряд не распределен равномерно, как это предполагали ранее, а сосредоточен в центральной части атома – ядре. На основе своих опытов Резерфорд предложил планетарную модель строения атома. Планетарная модель атома. 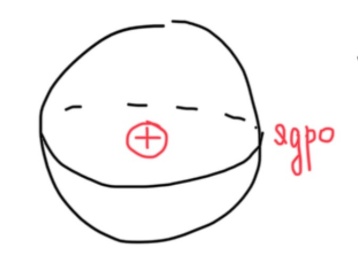 Размер атома ≈10-10м(=1А°=10нм) Размер ядра ≈ 10-15м В центре атома находится очень маленькое положительное ядро. Весь положительный заряд и почти вся масса сосредоточены в ядре В 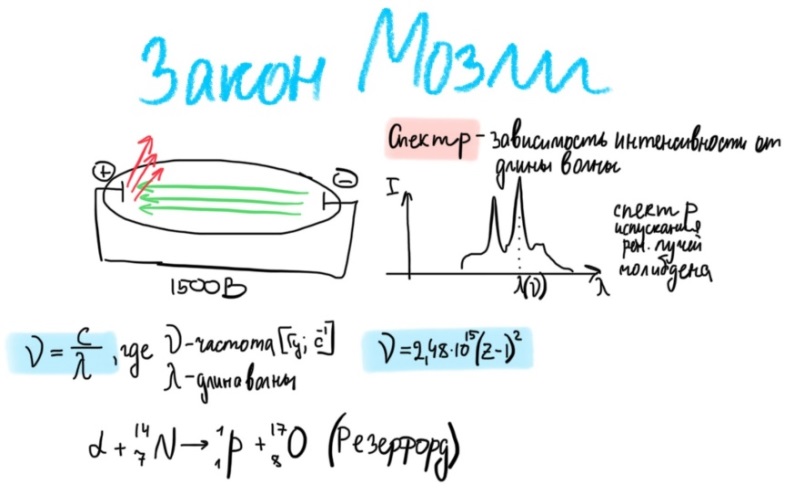 округ ядра по круговым орбитам вращаются электроны, при этом Fк(кулоновая сила)=z*e/r²; Fц=mV²/r → Fк=Fц е²/r²=mV²/r округ ядра по круговым орбитам вращаются электроны, при этом Fк(кулоновая сила)=z*e/r²; Fц=mV²/r → Fк=Fц е²/r²=mV²/rНедостатки модели: не объясняет почему электрон, теряя энергию, не падает на ядро. Не объясняет дискретный характер испускания и поглощения атомами энергии. Соотношение Мозли. Положение наиболее эффективного (интенсивного) максимума полосы в спектре испускания прямо пропорционально заряду ядра атома. К примеру, если материал катода, из которого как раз и будут испускаться эти рентгеновские лучи, изготовлен из меди, то его максимум на графике спектра испускания и будет прямо пропорционален чистоте поглощения наиболее интенсивного максимума и заряду ядра. Зако́н Мо́зли — закон, связывающий частоту спектральных линий рентгеновского излучения атома химического элемента с его порядковым номером. Изучая спектры испускания рентгеновского излучения из материала анода, Мозли определил зависимость между частотой испускания наиболее интенсивного максимума и его номером. Спектр излучения показывает интенсивность излучения от длины волны или частоты Соотношение Мозли: n = Const(Z-1)^2 Закон мозли: квадратный корень из частоты характеристического излучения есть линейная функция порядкового номера элемента. Билет 5. Корпускулярно-волновые свойства электромагнитного излучения. Уравнение Планка. Фотоэффект. Понятие о фотоне и его характеристиках. Корпускулярно-волновые свойства электромагнитного излучения: XVII век. Ньютон вводит корпускулярную теорию, согласно которой свет является потоком частиц. XIX век. Х. Гюйгенс вводит волновую теорию, противоречащую Ньютону и говорящую о том, что свет является волной. Волновая природа света: Дифракция – отклонение света от направления при преграде. Интерференция – сложение волн, приводящее к усилению/понижению колебаний. Поляризация – направленное колебания векторов напряженности электрического поля или напряженности магнитного поля. Корпускулярная природа света: излучение черного тела, фотоэффект, эффект Комптона ( увеличение длин волн ЭМ излучения) 1900 г. (Планк) идея о квантовом характере электромагнитного излучения. Энергия электромагнитного излучения должна излучаться и поглощаться только дискретными порциями (квантами): Е=hV, где h-постоянная Планка= 6,626*10-34Дж*с 1887 год. (Герц). Открытие фотоэффекта. Явление фотоэффекта состоит в том, что при действии на металлы электромагнитного излучения (света) они испускают электроны. Екин=hV-A (работа выхода) Закон Эйнштейна. 1923 год. (Комптон) При облучении рентгеновскими лучами длина волны увеличивается, а энергия падает. Что говорит об упругом столкновении фотона и электрона. Электромагнитное излучение, наряду с волновыми свойствами, приводящими к явлению дифракции и интерференции длины волны, обладает и корпускулярными свойствами, которые могут быть описаны в рамках квантовых представлений, использующих понятие о фотоне. Л=h/mc=h/p. Фотон – элементарная частица, квант электромагнитного излучения. Его масса равна 0, движение – скорости света, его особенность, что он постоянно в движении. Билет 6. Свойства электромагнитного излучения и его взаимодействие с веществом: атомные спектры, уравнение Ридберга, опыты Франка и Герца, противоречия с планетарной моделью строения атома. Электромагнитное излучение представлено одноименными волнами, которые приводятся в возбуждение под воздействием различных объектов излучения в виде молекулярных, атомных и заряженных частиц. Свойства ЭМ излучения: Свет может распространяться прямолинейно по однородной прозрачной среде. Свет отражается и преломляется в неоднородной среде. Дифракция, интерференция, рассеивание. высокая проникающая способность, быстрая скорость распределения в веществе, негативное и благотворное влияние на человека. А 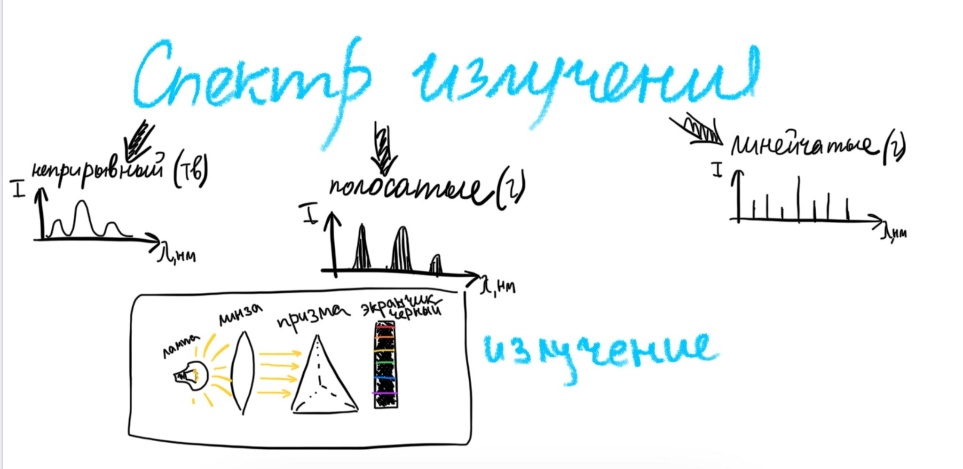 томные спектры – спектры поглощения и испускания свободных атомов; содержат информацию о состояниях, свойствах и строении атома, используются для спектрального анализа вещества. Также их определяют как набор длин волн ЭМ излучения, которые может испускать атом. томные спектры – спектры поглощения и испускания свободных атомов; содержат информацию о состояниях, свойствах и строении атома, используются для спектрального анализа вещества. Также их определяют как набор длин волн ЭМ излучения, которые может испускать атом. Атомные спектры бывают непрерывные (для твердых и жидких веществ), полосатые (для газов), линейчатые (для газов). При излучении спектров испускания атомарного водорода была выявлена зависимость между волновыми числами и некими целыми числами (серия Лайнела, Бальмера). На основании этого строится формула Ридберга – эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. 1/Л=R*(1/n1²-1/n2²) Где Л(лямбда)-длина волны света в вакууме, R-постоянная Ридберга=1096781/м, n1, n2 – целые числа. Суть опытов, предложенных и проведенных Франком и Герцем в 1913 году, состояла в определении энергии ускоренного электрона, который, сталкиваясь с атомом ртути, мог отщепить слабосвязанный с ним внешний (валентный) электрон. Существование дискретных энергетических уровней атома наиболее ярко и непосредственно подтверждено в опытах Дж. Франка и Г. Герца. |
