Вопросы к экзамену по химии Предмет и задачи химии. Химия и окружающая среда. Значение химии для инженеров вашей специальности
 Скачать 2.48 Mb. Скачать 2.48 Mb.
|
|
Вопросы к экзамену по химии 1. Предмет и задачи химии. Химия и окружающая среда. Значение химии для инженеров вашей специальности. Предмет изучения химии: химия изучает химическую форму движения материи, под которой понимают качественное изменение веществ, т. е. разрушение одних химических связей и образование других. В результате химических процессов возникают новые вещества с новыми химическими и физическими свойствами. Задачи химии: 1. Получение веществ с заранее заданными свойствами (для развития новой техники необходимы материалы с особыми свойствами, которых нет в природе: сверхчистые, сверхтвердые, жаростойкие, сверхпроводящие). 2. Повышение эффективности производства и качества продукции. 3. Создание безвредных, безотходных технологий. 4. Рациональное использование энергии химических превращений (в настоящее время электрическую и механическую энергию получают в основном преобразованием химической энергии природного топлива). Нет почти ни одной отрасли производства, не связанной с применением химии. Природа даёт нам лишь исходное сырьё – дерево, руду, нефть, газ и др. Подвергая природные материалы химической переработке, получают разнообразные вещества, необходимые для сельского хозяйства, промышленности, домашнего обихода – удобрения, металлы, пластические массы, краски, лекарственные вещества, мыло, соду и т.д. Химия нужна человечеству для того, чтобы получить из веществ природы, по возможности, всё необходимое – металлы, цемент и бетон, керамику, фарфор и стекло, каучук, пластмассы, искусственные волокна, фармацевтические средства. Для химической переработки природного сырья необходимо знать общие законы превращения веществ, а эти знания даёт химия. Знание полимеров необходимо для понимания их электрозащитных свойств, горючести в электродуге или при пожаре, накопление и увод статического электричества разными материалами. Свойства металлов необходимы для понимания химической и электрохимической коррозии, условий спаиваимости металлов, защитных свойств покрытий. 2. Основные понятия химии: химический элемент, атом, молекула. Простые сложные вещества. Аллотропия. Относительные атомные и молекулярные массы. Химия – наука о свойствах вещества и его превращениях, она включает в себя законы и принципы, описывающие эти превращения, а также представления и теории, позволяющие дать им объяснение. По составу вещества подразделяют на простые и сложные. Простые вещества — это химические вещества, образованные атомами одного химического элемента. Например: Н2, О2, С2 Сложные вещества- это химические вещества, образованные атомами разных химических элементов. Например: Н2О, НСl, H2SO4. Атом (от греч. слова «неделимый») -это мельчайшая частица химического элемента, состоящая из ядра и электронов. Молекула - мельчайшая частица вещества, имеющая все его основные химические свойства. Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. Аллотропия - способность атомов одного химического элемента образовывать несколько простых веществ. Причины аллотропии: 1) различное число атомов в молекуле (кислород О2 и озон О3) 2) образование различных кристаллических форм (фосфор Р - белый, красный, черный; сера S–пластическая, кристаллическая; углерод С –графит, алмаз) Относительная атомная масса (Ar)- это число, которое показывает во сколько раз масса данного атома больше 1/12 массы атома С.  Относительная молекулярная масса (Mr) – это число, которое показывает во сколько раз масса молекулы этого вещества больше 1/12 массы атома углерода. 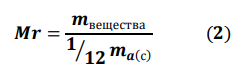 Например: Mr(CO2)=Ar(C)+2*Ar(O)=12+2*16=44 3. Периодический закон и электрическое строение атома. Причина периодичности свойств.  (порядкового номера). Причина периодичности свойств элементов, как показал Бор, заключалась в периодическом повторении строения внешнего электронного уровня атома. 4. Периодический закон и периодическая система элементов. Современная формулировка закона и структура периодической системы. Менделеев считал, что главной характеристикой элемента является его атомная масса. Располагая элементы в порядке возрастания их атомных весов, Д. И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон: «Свойства элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов» Современная формулировка выглядит следующим образом: «Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величин зарядов ядер их атомов». Структура периодической системы элементов Д.И. Менделеева. Периодическая система состоит из 7 периодов и 8 групп. ( 1ый период – сверхмалый, 2-3-малые, 4-5-большие,6- сверхбольшой, 7 – незавершённый). Порядковый номер элемента в периодической системе равен заряду ядра, или количеству протонов в нем, а также количеству электронов в оболочке нейтрального атома. Период –горизонтальный ряд элементов с одинаковым значение n. Каждый период начинается типичным металлом и завершается благородным газом. Принадлежность элементов к группам и деление их на подгруппы зависит от структуры двух внешних слоев. В соответствии с количеством электронов в этих слоях элементы периодической системы разделены на 8 групп. Номер группы совпадает с числом валентных электронов элемента. Валентными являются в первую очередь ns- и np-электроны (n – номер внешнего электронного слоя), а затем (n–1)d-электроны. 5. Периодический закон Д.И. Менделеева. Закон Г. Мозли. Закон Мозли — закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером. Согласно Закону Мозли, корень квадратный из частоты 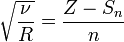 где Закон Мозли явился неопровержимым доказательством правильности размещения элементов в периодической системе элементов Д. И. Менделеева и содействовал выяснению физического смысла В соответствии с Законом Мозли, рентгеновские характеристические спектры не обнаруживают периодических закономерностей, присущих оптическим спектрам. Это указывает на то, что проявляющиеся в характеристических рентгеновских спектрах внутренние электронные оболочки атомов всех элементов имеют аналогичное строение. Более поздние эксперименты выявили некоторые отклонения от линейной зависимости для переходных групп элементов, связанные с изменением порядка заполнения внешних электронных оболочек, а также для тяжёлых атомов, появляющиеся в результате релятивистских эффектов (условно объясняемых тем, что скорости внутренних электронов сравнимы со скоростью света). В зависимости от ряда факторов — от числа нуклонов в ядре атома (изотопический сдвиг), состояния внешних электронных оболочек (химический сдвиг) и пр. — положение спектральных линий на диаграмме Мозли может несколько изменяться. Изучение этих сдвигов позволяет получать детальные сведения об атоме. 6. Главное и орбитальное квантовые числа, s,p,d,f-орбитали, их форма. Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
Электроны с одинаковым значением l образуют подуровень. Квантовое число l определяет квантование орбитального момента количества движения электрона Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений. s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μ= 0. p-Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz. d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d-Орбитали, ориентированные лопастями по осям координат, обозначаются dz² и dx²–y², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz.  7. Правила заполнения электронной структуры атома: принцип Паули, правила Гунда и Клечковского. Пример. Согласно правилу Хунда, устойчивому состоянию электронов в атоме соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина электронов максимально. Правило Хунда (Гунда): заполнение орбиталей данного подуровня осуществляется так, чтобы суммарный спин был максимален. Орбитали данного подуровня заполняются сначала по одному электрону. Электронные конфигурации атомов можно записать по уровням, подуровням, орбиталям. Например, электронная формула Р(15ē) может быть записана: а) по уровням)2)8)5; б) по подуровням 1s22s22p63s23p3; в) по орбиталям Примеры электронных формул некоторых атомов и ионов: V(23ē) 1s22s22p63s23p63d34s2; V3+(20ē) 1s22s22p63s23p63d24s0. Для первого энергетического уровня n=1, l=0, следовательно, возможно существование только s-подуровня, на котором может разместиться не более 2 электронов, что отразим записью 1s2. На втором энергетическом уровне может быть только два подуровня: s и p, на которых максимальное число электронов равно, соответственно, 2 и 6. Поэтому 8 электронов второго энергетического уровня распределены таким образом: 2s22p6. Следующие 18 электронов находятся на третьем уровне, на котором должно быть уже три подуровня: s, p и d, на которых максимальное число электронов составляет 2, 6 и 10. Следовательно, электронную конфигурацию третьего 18-электронного уровня можно представить в виде: 3s23p63d10. Для последнего 4-го уровня могут существовать 4 подуровня: s,p,d,f, на которых может находиться 2, 6, 10 и 14 электронов. Но в атоме цинка на 4 уровне находится всего 2 электрона. Эти два электрона займут самый низший подуровень 4s. Поэтому электронное строение 4 уровня можно записать в виде: 4s2. Соединив все полученные фрагменты электронного строения по всем уровням, получаем детализированную картину распределения электронов в атоме цинка: 30Zn 1s22s22p63s23p63d104s2. Таким образом, основные особенности заполнения электронных оболочек атомов в периодической системе следующие: 1. Начало периода совпадает с началом образования нового энергетического уровня электронного слоя. Период представляет собой последовательный ряд элементов, атомы которых различаются числом электронов в наружных слоях. Каждый период завершается благородным газом. У благородных газов наружная оболочка состоит из 8 электронов, за исключение гелия, у которого на внешней оболочке только 2 электрона. 2. Элементы главных и побочных подгрупп отличаются порядком заполнения электронных оболочек. У всех элементов главных подгрупп заполняются только внешние оболочки. При этом у элементов I и II групп заполняются s-оболочки, поэтому эти элементы называются s-элементами. А у элементов III-VII групп заполняются p-оболочки, поэтому эти элементы называются р-элементами. У элементов первых подгрупп (за исключением Mn, Zn, Tc, Ag, Cd, Hg) заполняются внутренние d-оболочки. Такие элементы называются d-элементами. Элементы, у которых заполняются внутренние f-оболочки, называются f-элементами (лантаноиды и актиноиды). Правило Клечковского: заполнение электронных подуровней осуществляется в порядке возрастания суммы (n + l), а в случае одинаковой суммы (n + l) – в порядке возрастания числа n. Согласно правилу Клечковского, заполнение подуровней осуществляется в следующем порядке: 1s, 2s, 2р, 3s, Зр, 4s, 3d, 4р, 5s, 4d, 5р, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s,… Хотя заполнение подуровней происходит по правилу Клечковского, в электронной формуле подуровни записываются последовательно по уровням: 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4р, 4d, 4f и т. д. Таким образом, электронная формула атома брома записывается следующим образом: Br(35ē) 1s22s22p63s23p63d104s24p5. Электронные конфигурации ряда атомов отличаются от предсказанных по правилу Клечковского. Так, для Сr и Cu: Сr(24ē) 1s22s22p63s23p63d54s1 и Cu(29ē) 1s22s22p63s23p63d104s1. Принцип Паули - В атоме не может быть двух электронов, обладающих одинаковыми свойствами. Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой Из правила Паули следует, что на орбитали могут располагаться не более двух электронов, на подуровне может содержаться не более 2(2l + 1) электронов, на уровне содержится не более 2n2 электронов. 8. Основные типы кристаллических решеток: ионная, атомная, молекулярная, металлическая. Примеры веществ. |
