|
|
Вопросы к экзамену по химии Предмет и задачи химии. Химия и окружающая среда. Значение химии для инженеров вашей специальности
Закон постоянства состава. Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества. 2НCl+ Mg(OH)2=MgCl2 +2H2O
Закон Авогадро. В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул. (Закон справедлив только для газообразных веществ.)
Следствия.
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Закон эквивалентов. Эквивалент элементов и соединений.
Вещества взаимодействуют друг с другом в эквивалентном количестве (количестве пропорциональном их эквивалентам). Массы реагирующих веществ пропорциональны их эквивалентным массам.
+
Закон сохранения энергии: Энергия не возникает из ничего и не исчезает, а только переходит из одного вида в другой.
Этот закон — результат работ А. Эйнштейна. Он установил связь между энергией и массой вещества (1905 г.):
Е = тс2,
где с — скорость света в вакууме, равная -300 000 км/с. Поскольку в результате химической реакции выделяется или поглощается энергия, то, в соответствии с уравнением Эйнштейна, изменяется и масса веществ. Однако это изменение столь мало, что на практике не учитывается (так называемый дефект массы).
Закон кратных отношений: Если 2 элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого относятся между собой как небольшие целые числа.
Гей-Люссак Закон простых объемных отношений: Объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
15. Теория электролитической диссоциации. Сильные и слабые электролиты. Примеры. Степень и константа диссоциации.
Криоскопия и эбуллиоскопия
Электролиты – вещества, проводящие электрический ток. Сами по себе твердые соли и основания, а также безводные кислоты не обладают или обладают очень слабой электрической проводимостью.Процесс распада вещества на ионы под действием растворителя называется электролитической диссоциацией и является обратимым. Например, диссоциация кислот, оснований, солей:
NaOHNa+ + OH- ; H2SO4H+ + HSO4- ; HSO4H+ + SO4- ; Al2(SO4)32Al+ + 3SO4-
Электролитами являются растворы солей, кислот, оснований, расплавленные соли, оксиды и гидроксиды, некоторые соли и оксиды в твердом состоянии.
Согласно теории электрической диссоциации, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы (катионы и анионы). Ионы в растворе находятся в состоянии неупорядоченного теплового движения.
Распадаются на ионы могут только те молекулы, химическая связь в которых имеет достаточную высокую степень ионности.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация может протекать по-разному. Наиболее типичны два случая:
- диссоциация солей (диссоциация кристаллов с ионной структурой);
- диссоциация при растворении кислот
Сильные электролиты - Это в-ва, которые при растворении в воде практически полностью распадаются на ионы (ионные или сильно полярные связи). К ним отн: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2). Слабые электролиты – В-ва, частично диссоциирующие на ионы. отн-ся: 1) почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2) некоторые неорганические кислоты (H2CO3, H2S и др.); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); 4) вода. Они плохо (или почти не проводят) электрический ток.
Результат диссоциации - вследствие диссоциации увеличивается число частиц. Отсюда появляется изотонический коэффициент i. P=iCRT, DТкип. = iЕm, DТзам. = iКm, и т.д. Изотонический коэффициент связан со степенью диссоциации электролита a - отношение числа распавшихся на ионы молекул к общему числу молекул: a=(i-1)/(n-1)
Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N): α = n / N и выражается в долях единицы или в %.
Электролиты делятся на: сильные a
1, средние a
30%, слабые a<0.1. Сильные электролиты : соли, некоторые кислоты - HClO4, H2SO4, HNO3, HI, HBr, HCl, гидроксиды щелочных металлов, кальция, стронция и бария. Остальные кислоты и основания - средние или слабые электролиты. Рассмотрим равновесие в растворе слабого электролита. KA « K+ + A- (на самом деле KA + aq « K+aq+ A-aq) Концентрация раствора С моль/л.
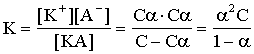
Теория электролитической диссоциации: при растворении в воде электролиты распадаются (диссоциируют) на положительно(катионы) и отрицательно(анионы) заряженные ионы.
электролитическая диссоциация- это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении. Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях.
аВ =f*хВ , аВ =γ*см , аВ =y*cВ , где f, γ,y-рациональный,моляльный, молярный коэффициент.
хВ, см, cВ – молярная доля, моляльная и молярная концентрации. Температура кипения - темп-ра, при которой давление насыщенных паров растворителя над раствором равно внешнему атмосферному давлению. Повышение темп-ры кипения и понижение температуры закипания прямо пропорционально молярной концентрации неэлектролитов. T кип=Em, E – эбуллиоскопическая постоянная (зависит только от природы р-ля). T закип=Km, K– криоскопическая постоянная равна понижению темп замерзания р-ра, а к-м на 1 моль раств-го в-ва приходится 1 кг растворителя. Для каждого растворителя этот коэф-т постоянен и не зависит от природы раств. в-ва. EH20=0,52, KH20=1,86
16. Химическая связь. Энергия, длина связи, валентный угол.
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
Более точно химическую связь можно определить как взаимодействие атомов, обусловленное перекрыванием их электронных облаков, и сопровождается уменьшением полной энергии системы.
Основными параметрами химической связи является её длина, прочность и валентные углы, характеризующие строение веществ, которые образованы из отдельных атомов.
Длина связи – это межъядерное расстояние между химическими связанными атомами.
Угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется валентным углом. Энергия связи – энергия, необходимая для разрыва такой связи.
17. Реакции обмена в растворах электролитов. Условия протекания, примеры.
Электроли́т — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Реакция обмена в растворе может изображаться тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении малорастворимые вещества, газы и электролиты изображаются молекулярными формулами.
Пример: обменная реакция растворимой соли со щёлочью. В результате реакции образуется нерастворимое вещество.
Если смешать растворы двух диссоциирующих веществ, то положительно заряженные ионы (катионы) взаимодействуют с ионами, заряженными отрицательно (анионы). Все участвующие в реакции вещества находятся в виде ионов. Связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима. Приведенные примеры свидетельствуют о том, что необходимыми условиями протекания реакций ионного обмена до конца являются: 1) образование осадка; 2) выделение газа; 3) образование малодиссоциирующих молекул воды. Естественно, что в ходе ответа можно приводить другие примеры реакций ионного обмена, но при этом важно помнить об использовании таблицы «Растворимость кислот, оснований и солей в воде», из которой видно, какое вещество растворимо, а какое — нет. Отличительной особенностью реакции ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
18. Зависимость скорости реакции от температуры, правило Вант-Гоффа.
Для ферментов характерна термолабильность-зависимость и активация от температуры. Это объясняетя тем, что при высокой темп. Происходит денатурация белка.
Правило Вант-Гоффа-эмпирическое правило, позволяющее в первом приближении оценить влияние t на скорость хим.реакции в небольшом интервале: при повышении t на каждые 10 градусов константа скорости гомогенной реакции увеличивается в 2-4 раза.
V2=V1 γ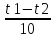
Температурный коэффициент различных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4. Это на первый взгляд небольшое значение температурного коэффициента обусловливает, однако, большое возрастание скорости реакции при значительном повышении температуры. Например, если температурный коэффициент равен 2,9, то при возрастании температуры на 100 градусов скорость реакции увеличивается на 2,9'°, т.е. приблизительно в 50000 раз.
19. Катализ гомогенный и гетерогенный. Примеры. Причины ускоряющего действия катализатора.
Гомогенный катализ- катализатор и реакционная смесь находятся в одной фазе. Скорость пропорциональна катализатору, хотя его количество в системе невелико. Гомогенный катализ в растворах и биосредах может вызываться ионами Н (кислотный катализ) и гидроксила (основный катализ). Реакции омыления сложных эфиров и амидов. ОВР обычно катализируются катионами тех d-металлов для которых характерна переменная степень окисления (Fe+3; Fe+2; Сu+; Сu+2). Примеры: процесс окисления SO2 и SO3 при помощи газообразных оксидов азота, омыление сложных эфиров, гидролиз дисахаридов при участии небольших количеств сильных кислот или щелочей.
Гетерогенный катализ- катализатор обычно твердый и реакция протекает на его поверхности. Скорость реакции сильно зависит от площади и состояния поверхности катализатора, т.к. реакция происходит не на всей поверхности, а только на её активных центрах. Примеры: синтез спиртов из смеси окиси углерода в H2 в присутствии катализатора; процессы дегидрирования, дегидратации в присутствии окиси металлов; разложение пероксида водорода в присутствии платины.
Главной причиной ускоряющего действия катализаторов является снижение энергии активации, необходимой для протекания реакции.
20. Электролиз расплавов, примеры. Применение электролиза.
Электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы, и некоторые их сплавы.
При высокой температуре электролит и продукты электролиза могут вступать во взаимодействие друг с другом, с воздухом, а также с материалами электродов и электролизера. В результате этого простая, в принципе, схема электролиза (например, электролиз MgCl2 при получении магния) усложняется.
Электролитом обычно служат не индивидуальные расплавленные соединения, а их смеси. Важнейшим преимуществом смесей является их относительная легкоплавкость, позволяющая проводить электролиз при более низкой температуре.
В настоящее время электролизом расплавов получают алюминий, магний, натрий, литий, бериллий и кальций. Для получения калия, бария, рубидия и цезия электролиз расплавов практически не применяется из-за высокой химической активности этих металлов и большой их растворимости в расплавленных солях. В последние годы электролизом расплавленных сред получают некоторые тугоплавкие металлы.
21. Свойства ковалентной связи. Направленность связи, насыщаемость.
Длинна связи– определяется экспериментально, чем меньше длинна связи тем оно прочнее. Однако мерой прочности является энергия связи.
Энергия связи – количество энергии которая необходима для разрыва связи. С увеличением кратности энергия увеличивается, а длинна уменьшается.
Насыщаемость – это способность атомов образовывать ограниченное число ковалентных связей.
Направленностьковалентной связи обуславливает пространственную структуру молекулы.
Так например молекула HCl - линейна, молекула Н2О – нелинейная. Так как связь образована р элементами атома кислорода, облака которых расположены по осям ординат т. е. Под углом 90°. Таким образом их угол в молекуле Н2О должен быть 90°. Но в действительности 104°. В молекуле аммиака угол равен 107° 3', а молекула имеет вид пирамиды. Ковалентные связи образованные много валентными атомами и всегда имеют пространственную направленность. Между направлениям ковалентных связей образуется валентный угол.
Отклонение реального валентного угла от теоретического навело на мысль о существовании гибридизации.
BeCl2

Ковалентная связь которая образуется при перекрывании облаков вдоль линии соединяющих центры называется сигма связью(δ- связь).
Ковалентная связь может быть полярной и не полярной. Полярная связь в молекуле Н2О, H2S, HCl, NH3.
22. Ионная связь, свойства. Примеры соединений.
Ионная связь– связь за счет электростатического взаимодействия противоположно заряженных ионов: катионов и анионов. Ионная связь возникает при взаимодействии атомов с разностью электроотрицательности > 2. В этом случае за счет смещения электронной плотности атомы превращаются в ионы (электронная пара полностью переходит во владение наиболее электроотрицательного атома) Rb + F → Rb+ : F-
NaCl; χ (Na)=0,9; χ (Cl)=3,1; χ =χ (Cl)- χ (Na)=3.1-0.9=-2,2.
Ионы-это заряженные частицы, превращающиеся в атомы путем принятия или отдачи электронов. Ионы принято рассматривать , как заряды со сферической симметрией силового поля, а взаимодействие таких зарядов ненасыщаемо и ненаправляемо.
Каждый ион в ионном кристалле окружает себя на близком расстоянии таким числом противо-ионов, которое может геометрически разместить.
Понятие молекулы для ионного соединения : из-за ненасыщенности и ненаправленности молекулы ионной связи носят условный характер.
Формула в молекуле ионного соединения показывает лишь простейшие соотношения между количествами катионов и анионов в макрокристалле вещества.
Строение
1 . Ионны в кристале упаковываются таким образом, чтобы одноименные находились как можно дальше (мин отталкивались), а различные как можно ближн (мах притяжение). . Ионны в кристале упаковываются таким образом, чтобы одноименные находились как можно дальше (мин отталкивались), а различные как можно ближн (мах притяжение).
По этой причине ионные кристалы характерезуются принципом плотнейшей упаковки.
Вокруг каждого ионна может располагаться ограниченное число противо-ионнов.
Это число называется координационным чилом (к.ч.) f (rкатион/rанион).
2. В ионном кристале нельзя выделить реально существующую структурную единицу (молекулу). Молекула для ионного вещества – условная формульная единица. Она лишь показывает соотношение кол-ва катионов и анионов в макрокристале вещества. NaCl AlCl3
1:1 1:3
Свойства веществ с ионной связью
1) Прочные и Твердые, Есв = 500÷1000 кДж/моль;
2) Хрупкие - не выдерживают воздействий, приводящих к смещению ионных слоев;
3) Не проводят эл ток и тепло (с твердом состоянии), т.к нет свободных электронов

Примеры веществ с ионной связью.
К веществам с ионной связью относятся все соли, образованные органически и неорганически,
соединения между наиболее активными Ме и НеМе,
Если НеМе более активен чем Ме => между ними ионная связь.
23. Электрохимическая коррозия металлов. Методы защиты от коррозии.
Коррозией называют процесс самопроизвольного разрушения поверхности материалов вследствие взаимодействия с окружающей средой. Ее причиной является термодинамическая неустойчивость химических элементов к определенным веществам.
Она является следствием контакта металла с жидкой средой, способной проводить электрический ток. Вследствие окисления материал претерпевает структурные изменения, приводящие к образованию ржавчины (нерастворимого продукта), либо частицы металла переходят в раствор ионов.
|
|
|
 Скачать 2.48 Mb.
Скачать 2.48 Mb.

