|
|
Вопросы к экзамену по химии Предмет и задачи химии. Химия и окружающая среда. Значение химии для инженеров вашей специальности
Ионные:
NaCl n=8
В узлах находятся ионы
Атомные (ковалентные)
Решетка алмаза (гране-центрированный куб)
Атомы углерода расположены в междоузлиях
Алмаз – неплотно упакованная решетка (плотность 34%)
В решетке графита связь между слоями дисперционная, а в слоях ковалентная ( по мере увелич т происходит разрыв ковалентной связи и увелич проводимость)
Металлические:
В узлах решетки распол положит ионы.
Связь за счет полусвободных электронов
Гранецентр куб – металлич
Молекулярная решетка:
В узлах распол молекулы. Все связи внутри мол-лы насыщены. Связаны силами межмол взаимодействия:
1) если решетки образ неполярными мол-лами (H2,N2,Cl2), то сущ за счет дисперсионных сил
2) если полярны (NH3,H2O,HCl) то дисперс силы и водородные связи
Кроме сил межмол взаимодейств сущ дисперсионные силы и водородная связь.
9. Энергия ионизации, энергия сродства к электрону, электроотрицательность, радиусы атомов. Как они изменяются в группах и периодах.
Энергия ионизации атома Еu – это минимальная энергия,
необходимая для отрыва от невозбужденного атома наиболее слабо связанного электрона внешнего слоя. Она обычно изме-
ряется в кДж моль и характеризует проявление металлических свойств у атомов тех или иных элементов.
Изменение величины Еu с увеличением атомного номера элемента имеет явно выраженный периодический характер. В периодах в целом слева направо энергия ионизации атомов возрастает, а в А группах – уменьшается сверху вниз.
У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра возрастает, а радиус атома постепенно уменьшается. В связи с этим электроны внешнего слоя сильнее притягиваются ядром, что вызывает увеличение Еu и ослабление металлических свойств.
Энергия сродства к электрону
Для атомов неметаллов присуща способность присоединять к себе электроны при протекании химических реакций. В резуль-
45
тате этого нейтральный атом превращается в отрицательно заряженный ион. Количественной характеристикой возможности протекания такого процесса является энергия сродства к элек- трону Еср..
Энергия сродства к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому. Как и энергия ионизации, она обычно измеряется в кДж моль. Чем больше энергия сродства к электрону, тем
легче атом присоединяет электрон и тем сильнее проявляются неметаллические свойства элементов.
Для нейтрального атома (Э) Еср. численно равна, но противоположна по знаку энергии ионизации отрицательно заряженного иона Э-.
В периодах и группах периодической системы энергия сродства к электрону изменяется закономерно, как и Еu: растет слева направо в первом случае и уменьшается сверху вниз – во втором. Причем, локальные максимумы и минимумы Еср. в периодах по сравнению с Еu смещены на один элемент влево.
Для неметаллов Еср. всегда положительна, так как силы притяжения к ядру дополнительного электрона оказываются большими, чем силы отталкивания между дополнительным электроном и электронной оболочкой. Наибольшую энергию сродства к электрону имеют элементы VII А группы. У большинства металлов и у элементов VIII А группы энергия сродства к электрону небольшая и даже может быть отрицательной. Поэтому эти эле-
менты не образуют устойчивых отрицательно заряженных ионов
(Э-).
Электроотрицательность
Отдача или присоединение электронов атомами обычно происходит в процессе их взаимодействия друг с другом при образовании химических связей. В ходе такого взаимодействия атомы конкурируют между собой за смещение общей электронной пары в ту или иную сторону. Комплексной характеристикой атома, способной качественно и количественно оценивать эту конкуренцию, является электроотрицательность элемента
(обозначается греческой буквой (xи)).
Электроотрицательность элемента – это условная величина, характеризующая способность его атомов в химических соединениях смещать к себе электроны от атомов других элементов при образовании между ними химических связей.
В периодах слева направо электроотрицательность элементов увеличивается (особенно хорошо это наблюдается на примере малых периодов ,а в группах сверху вниз уменьшается.
10. Энтропия, энтальпия, энергия Гиббса. Связь между ними. Определение направления химического процесса в стандартных условиях.
Энтальпия (H) ― функция состояния термодинамической системы, изменение которой (изменение теплосодержания ∆H) представляет собой тепловой эффект процесса (Qp), протекающего при постоянном давлении (p = const, изобарный процесс). ∆H = Qp

Энтропия (S) ― функция состояния термодинамической системы, характеризующая степень (меру) упорядоченности частиц в системе. Увеличение энтропии (∆S > O, Дж/моль·K) увеличивает неупорядоченность расположения частиц. Любая система стремится к переходу в наиболее вероятное состояние (т.е к увеличению беспорядка). S(газ) > S(ж) > S(тв)
Возможность самопроизвольного протекания процесса в изолированных системах определяется изменением энтропии (∆S), а в закрытых и открытых (неизолированных) системах― изменением энергии Гиббса (∆G).
Энергия Гиббса (G) ― обобщенная функция состояния термодинамической системы, учитывающая (а) изменение энергетики и (б) неупорядоченности системы при постоянном давлении и температуре (p, T = const, изобарно-изотермический процесс)


11. Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия для гомогенных и гетерогенных обратимых реакций. Примеры.
Все химические реакции можно разделить на два вида: необратимые и обратимые. Необратимые реакции протекают до полного исчезновения одного или нескольких реагирующих веществ. Примером необратимой реакции может быть реакция разложения нитрата аммония: NH4NO3 =N2O + 2H2O.
Реакции, которые при одной и той же температуре в зависимости от соотношения реагентов могут протекать как в прямом, так и в обратном направлении, называются обратимыми.
Примером обратимой реакции может быть реакция взаимодействия водорода с газообразным иодом: Н2 (г) + I 2 (г) < = > 2HI (г)
В данной обратимой гомогенной химической реакции соотношение скоростей прямой и обратной реакций, согласно закону действующих масс, зависит от соотношения концентраций реагирующих веществ. Скорость прямой реакции выражается уравнением:
 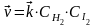 , ,
где 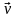 - скорость прямой реакции, моль·л-1·с-1; - скорость прямой реакции, моль·л-1·с-1;
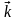 - константа скорости прямой реакции; - константа скорости прямой реакции;
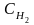 и и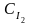 - концентрации водорода и иода, моль·л-1; - концентрации водорода и иода, моль·л-1;
скорость обратной реакции:
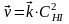
где - скорость обратной реакции, моль·л-1·с-1;
- константа скорости обратной реакции;
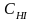 - концентрация иодоводорода, моль·л-1. - концентрация иодоводорода, моль·л-1.
По мере прохождения реакции наступает такой момент времени, когда скорости прямой и обратной реакции окажутся равными. Такое состояние системы называется состоянием химического равновесия, т.е. число образуемых и распадающихся молекул HI в единицу времени и в единицу объема становится одинаковым. Химическое равновесие является динамическим равновесием. При химическом равновесии концентрации всех участников реакции постоянны и не изменяются со временем, хотя одновременно осуществляется прямая и обратная реакции. Константа равновесия. Отношение скоростей прямой и обратной реакции для данной температуры является постоянным и называется константой
равновесия для данной реакции. В выражении константы равновесия записываются концентрации или давления газообразных или жидких веществ, твёрдые вещества в выражение константы не записываются. Пример: N2(г) + 3H2(г) < = > 2NH3(г) Кс=С2NH3\C2H2 x CN2
12. Электронно-графические формулы атомов. Валентные электроны, понятие валентности.
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
 Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными.
Например, в атоме фосфора 5 валентных электронов: 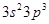 (рис. 1). (рис. 1).

Валентность – это способность атома образовывать химические связи. Данное определение и само понятие валентность корректны только по отношению к веществам с ковалентным типом связи. Для ионных соединений это понятие неприменимо, вместо него используют формальное понятие «степень окисления».
Валентность характеризуется числом электронных пар, образующихся при взаимодействии атома с другими атомами. Например, валентность азота в аммиаке NH3 равна трем (рис. 2).
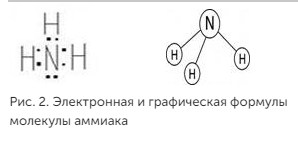
13. Скорость реакции. Уравнения Аррениуса. Понятие об энергии активации, ее влияние на скорость реакции.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
А + В ––> С
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
А ––> K# ––> B
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е'А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции.
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции.
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2: 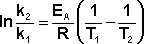
Энергия активации, разность между значениями средней энергии частиц (молекул, радикалов, ионов и др.), вступающих в элементарный акт химической реакции, и средней энергии всех частиц, находящихся в реагирующей системе. Для различных химических реакций Энергия активации изменяется в широких пределах — от нескольких до
10 дж./ моль. Для одной и той же химической реакции значение Энергия активации зависит от вида функций распределения молекул по энергиям их поступательного движения и внутренним степеням свободы (электронным, колебательным, вращательным). Как статистическую величину Энергия активации следует отличать от пороговой энергии, или энергетического барьера, — минимальной энергии, которой должна обладать одна пара сталкивающихся частиц для протекания данной элементарной реакции.
В рамках представлений теории абсолютных скоростей реакций Энергия активации — разность между значениями средней энергии активированных комплексов и средней энергии исходных молекул.
Представления об Э. а. возникли в 70—80-х гг. 19 в. в результате работ Я. Вант-Гоффа и С. Аррениуса, посвященных изучению влияния температуры на скорость химической реакции. Константа скорости реакции k связана с Э. а. (Е) уравнением Аррениуса:
k = koe-E/RT
где R — Газовая постоянная, Т — абсолютная температура в К, ko — постоянная, называемая предэкспоненциальным множителем константы скорости. Это уравнение, основанное на молекулярно-кинетической теории, позже было получено в статистической физике с учетом ряда упрощающих предположений, одно из которых — независимость Э. а. от температуры. Для практики и для теоретических расчетов в сравнительно узких температурных интервалах это предположение справедливо.
Э. а. можно найти по экспериментальным данным несколькими способами. Согласно одному из них, исследуют кинетику реакции при нескольких температурах (о методах см. в ст. Скорость химической реакции) и строят график в координатах In k — 1/T; тангенс угла наклона прямой на этом графике, в соответствии с уравнением Аррениуса, равен Е. Для одностадийных обратимых реакций (см. Обратимые и необратимые реакции) Э. а. реакции в одном из направлений (прямом или обратном) можно вычислить, если известна Э. а. реакции в другом и температурная зависимость константы равновесия (из термодинамических данных). Для более точных расчетов следует учитывать зависимость Э. а. от температуры.
Э. а. сложных реакций представляет собой комбинацию Э. а. элементарных стадий. Иногда, помимо истинной Э. а., определяемой по уравнению Аррениуса, используют понятие «кажущейся» Э. а. Например, если константы скоростей гетерогенно-каталитических реакций определяют по изменению объемных концентраций исходных веществ и продуктов, то кажущаяся Э. а. отличается от истинной на величину тепловых эффектов, сопровождающих процессы адсорбции (См. Адсорбция) и десорбции реагирующих веществ на поверхности катализатора. В неравновесных системах, например плазмохимических (см. Плазмохимия), определение Э. а. является очень сложной задачей. В некоторых случаях, однако, возможно формальное применение уравнения Аррениуса.
Э. а. — важнейшее понятие кинетики химической (См. Кинетика химическая); ее значения включают в специальные справочники и используют в химической технологии для расчета скоростей реакций в различных условиях.
14. Основные законы химии: сохранения массы и энергии, постоянства состава, эквивалентов, кратных отношений, простых объемных отношений, закон Авогадро и следствия из него.
Закон сохранения массы веществ (впервые этот закон сформулировал М.В.Ломоносов.) Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. H2SO4+2NaOH=Na2SO4+2H2O
|
|
|
 Скачать 2.48 Mb.
Скачать 2.48 Mb.



 Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными.
Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. 
