Вопросы к экзамену по химии Предмет и задачи химии. Химия и окружающая среда. Значение химии для инженеров вашей специальности
 Скачать 2.48 Mb. Скачать 2.48 Mb.
|
|
Влияние концентрации растворов. Труднорастворимый электролит с достаточно большой величиной ПР нельзя осадить из разбавленных растворов. Например, осадок PbCl2 не будет выпадать при смешении равных объемов 0,1 M растворов Pb(NO3)2 и NaCl. При смешивании равных объемов концентрации каждого из веществ станут 0,1 / 2 = 0,05 M или 5·10-2 моль/л. Ионное произведение [Pb2+]·[Cl‾]2 = 5·10-2·(5·10-2)2 = 12,5·10-5. Полученная величина меньше ПР(PbCl2), следовательно выпадения осадка не произойдет. Влияние количества осадителя. Для возможно более полного осаждения употребляют избыток осадителя. Например, осаждаем соль BaCO3: BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl. После прибавления эквивалентного количества Na2CO3 в растворе остаются ионы Ba2+, концентрация которых обусловлена величиной ПР. Повышение концентрации ионов CO32-, вызванное прибавлением избытка осадителя (Na2CO3), повлечет за собой соответственное уменьшение концентрации ионов Ba2+ в растворе, т.е. увеличит полноту осаждения этого иона. Влияние одноименного иона. Растворимость труднорастворимых электролитов понижается в присутствии других сильных электролитов, имеющих одноименные ионы. Если к ненасыщенному раствору BaSO4 понемногу прибавлять раствор Na2SO4, то ионное произведение, которое было сначала меньше ПР(BaSO4) (1,1·10-10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка. Это используют, например, при осаждении ценных металлов. Например, ПР AgCl в воде =1,6×10-10. Концентрация серебра в таком растворе над AgCl будет Много это или мало? Это 1,4 мг серебра, выливаемого с каждым литром промывных жидкостей на кинофабрике. Если же мы будем промывать не водой, а 0,1н раствором NaCl, то [Ag+] = ПР/[Cl] = 1.6×10-9моль/л, т.е. концентрация серебра, уносимая в растворе, уменьшится в 10 000 раз. Влияние температуры. ПР является постоянной величиной при постоянной температуре. С увеличением температуры ПР возрастает, поэтому осаждение лучше проводить из охлажденных растворов. Растворение осадков. Правило произведения растворимости важно для переведения труднорастворимых осадков в раствор. Предположим, что надо растворить осадок BaСO3. Раствор, соприкасающийся с этим осадком, насыщен относительно BaСO3.Это означает, что [Ba2+]·[CO32-] = ПР(BaCO3). Если добавить в раствор кислоту, то ионы H+ свяжут имеющиеся в растворе ионы CO32- в молекулы непрочной угольной кислоты: C 2H H2O Вследствие этого резко снизится концентрация иона CO32- , ионное произведение станет меньше величины ПР(BaCO3). Раствор окажется ненасыщенным относительно BaСO3 и часть осадка BaСO3 перейдет в раствор. При добавлении достаточного количества кислоты можно весь осадок перевести в раствор. Следовательно, растворение осадка начинается тогда, когда по какой-либо причине ионное произведение малорастворимого электролита становится меньше величины ПР. Для того, чтобы растворить осадок, в раствор вводят такой электролит, ионы которого могут образовывать малодиссоциированное соединение с одним из ионов труднорастворимого электролита. Этим объясняется растворение труднорастворимых гидроксидов в кислотах Fe(OH)3 + 3HCl → FeCl3 + 3H2O Ионы OH‾ связываются в малодиссоциированные молекулы H2O. Зная ПР, можно объяснить, почему одни вещества растворяются, а другие – нет. И наоборот, легко объяснить, почему одни вещества выпадают в осадок, а другие – нет. Например, FeS растворяется в соляной кислоте, а СuS – нет: FeS + 2HCl → FeCl2 + H2S CuS + HCl ≠ Величины значений ПР(FeS) = 3,7·10–19, ПР(CuS) = 8,5·10–45.Отсюда следует, что в случае сульфида меди в насыщенном растворе находится очень мало ионов S2–, и молекулы H2S не будут образовываться, а, следовательно, равновесие в насыщенном растворе сульфида меди не будет нарушаться. Осадок не будет растворяться. В случае же сульфида железа (II) сульфид-ионов достаточно для образования молекул H2S, и равновесие сдвигается вправо. Осадок сульфида железа (II) растворяется. Другой пример: FeS не осаждается из раствора с помощью H2S и осаждается раствором (NH4)2S: FeCl2 + H2S ≠ FeCl2 + (NH4)2S = FeS↓ + 2NH4Cl Сероводородная кислота является слабой (К2 = 1·10–14). Отсюда ионов S2-недостаточно для выполнения условия [Fe2+][S2–] > ПР, и осадок не выпадает. Сульфид аммония – сильный электролит, и сульфид-ионов достаточно для выполнения вышеуказанного условия. А это приводит к выпадению осадка. Произведение растворимости можно использовать для селективного разделения ионов осаждением из растворов. Например, рассмотрим осаждениеионов Ba2+ и Sr2+ из раствора, содержащего 0,010 моль/л BaCl2 и 0,020 моль/л SrCl2, используя концентрированный раствор Na2SO4. ПР сульфатов бария и стронция определяется соотношениями ПР = [Ba2+][SO42–] = 1,5·10–9; ПР = [Sr2+][SO42–] = 7,6·10–7. Следовательно, осаждение сульфата бария при наличии 0,010 моль/л ионов Ва2+ не будет происходить до тех пор, пока концентрация иона SO42-не достигнет величины [SO42–] = 1,5·10–9 / 0,010 = 1,5·10–7 моль/л. Осаждение сульфата стронция начнётся при концентрации сульфат-иона, равной [SO42–] = 7,6·10–7 / 0,020 = 3,8·10–5 моль/л. Следовательно, ионы бария начнут осаждаться первыми. При достижении концентрации сульфат-ионов величины 3,8·10–5 моль/л начнется осаждение сульфата стронция. К тому времени в растворе останется [Ba2+] = 1,5·10–9 / 3,8·10–5 = 3,9·10–5 моль/л. +Это составит только 0,39% от исходного количества ионов бария. Остальные 99,6% ионов бария будут осаждены до начала выпадения осадка сульфата стронция. 40. Понятие электродного потенциала, двойной электрический слой. При погружении металлической пластины в раствор соли данного металла (электрод или полуэлемент) может происходить один из двух процессов: 1. Если металл является активным восстановителем (т. е. легко теряет электроны), то под действием диполей воды, содержащихся в растворе, некоторая часть атомов металла оставляет свои электроны на электроде и в виде гидратированных ионов переходит в раствор: Me0 + mH2О → Men+ • mН2О + п в растворе на электроде Или без учета гидратации ионов: Ме0 → Меn+ + п В результате этого процесса окисления металлическая пластинка заряжается отрицательно, а катионы металла притягиваются к ней и поэтому прилегающий к пластинке слой раствора заряжается положительно. Таким образом на границе металл—раствор возникает двойной электрический слой (ДЭС), как это показано на рис. 1. 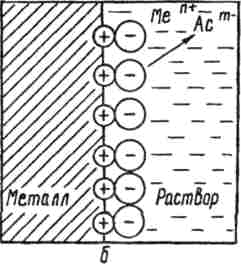 б 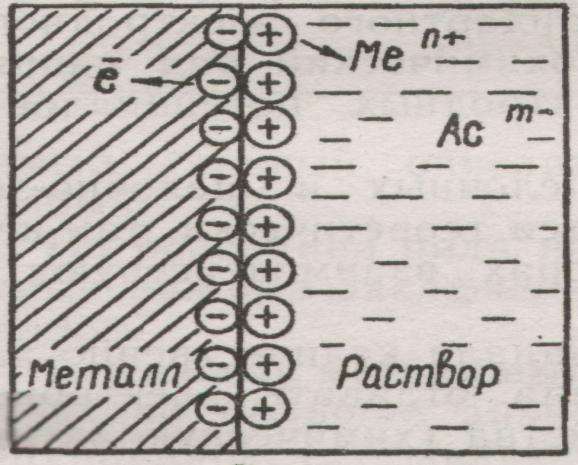 а Рис. 1. Образование двойного электрического слоя на границе Металл – раствор его соли MemAcn: a – в результате перехода ионов металла в раствор; б – в результате перехода ионов металла из раствора 2. Если сам металл является слабым восстановителем, то его ионы, содержащиеся в растворе соли, являются сильными окислителями. Некоторая часть этих ионов подходит к поверхности металлической пластины и восстанавливается за счет имеющихся в ней свободных электронов: Men+ + п В результате осаждения катионов пластина металла заряжается положительно и притягивает к себе отрицательно заряженные анионы. Поэтому прилегающий к пластине слой раствора заряжается отрицательно, как это показано на рис. 1 б. Таким образом, и в этом случае возникает ДЭС. Разность потенциалов, возникающая в ДЭС на границе металл-раствор, называется электродным потенциалом. Непосредственно измерить потенциал отдельного электрода (металла) невозможно. Поэтому электродные потенциалы измеряют относительно стандартного водородного электрода, потенциал которого принимают равным нулю. Потенциал каждого электрода (металла) зависит от природы металла, концентрации его ионов в растворе, температуры. Водородный электрод представляет из себя сосуд с серной кислотой (рис. 2), в который опущена платиновая пластинка, электролитически покрытая губчатой платиной, через которую пропускается водород. 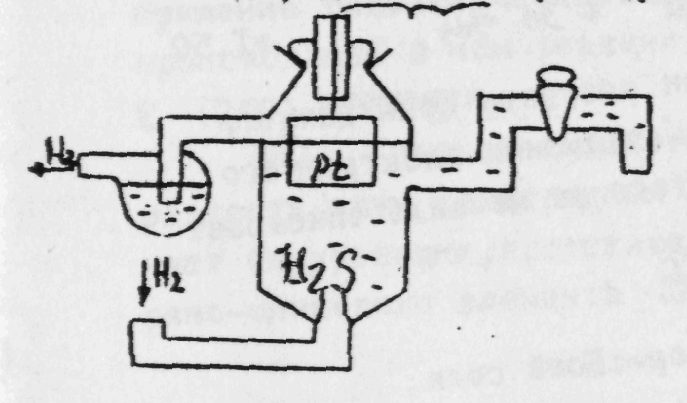 Н2SO4 Рис. 2. Стандартный водородный электрод Водород растворяется в платине и частично переходит в раствор в виде катионов водорода: 2Н Принято считать потенциал водородного электрода равным нулю при условии, что давление в сосуде 105 Па, температура 298 К, а концентрация Н+ в растворе серной кислоты – 1 г-ион/л. Такой электрод называется стандартным. Разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом при стандартных условиях называется стандартным электродным потенциалом металла (Е0). Металлы, расположенные в порядке возрастания алгебраического значения их стандартного электродного потенциала, составляют электрохимический ряд напряжений (ряд стандартных электродных потенциалов), представленный в таблице. Электродные потенциалы щелочных и щелочно-земельных металлов рассчитываются теоретически, так как эти металлы в водных растворах взаимодействуют с водой. Значение электродного потенциала количественно характеризует способность металла отдавать электроны, т. е. его восстановительные свойства (химическую активность металла). В этом ряду восстановительная активность металлов в водных растворах сверху вниз уменьшается: металлы, стоящие в начале ряда, легко отдают электроны и превращаются в положительно заряженные ионы; металлы, стоящие в конце ряда, с трудом отдают электроны. И наоборот, окислительная способность катионов металлов сверху вниз увеличивается. Металлический литий Li – самый сильный восстановитель, а золото Аu – самый слабый. Ион золота Au3+– самый сильный окислитель, ион лития Li+– самый слабый. На основании ряда напряжений можно сделать некоторые важные заключения о химической активности металлов. Каждый металл вытесняет из солей другие металлы, имеющие большие значения стандартных электродных потенциалов, т. е. являющиеся менее сильными восстановителями. Металлы, имеющие стандартный электродный потенциал меньше нуля (т. е. потенциала стандартного водородного электрода), способны вытеснять водород из кислот. Металлы, имеющие очень низкие значения стандартного электродного потенциала, т. е. являющиеся сильными восстановителями (от лития до натрия), в любых водных растворах взаимодействуют прежде всего с водой. Электрохимический ряд напряжений металлов
Положение металлов в электрохимическом ряду напряжений не вполне соответствует их положению в периодической системе. Это объясняется тем, что при измерении электродных потенциалов учитывается не только энергия отрыва электронов от отдельных изолированных атомов, но и энергия, которая тратится на разрушение кристаллической решетки и которая выделяется при гидратации ионов. Зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и от температуры выражается уравнением Нернста: Е = Е0 + Здесь Е0 – стандартный электродный потенциал; R – газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея (96 500 Кл/моль); z – число электронов, участвующих в электродном процессе; [Ох] и [Red] –произведения концентраций (активностей) веществ, принимающих участие в соответствующей полуреакиии в окисленной (Ох) и восстановленной (Red) формах. Уравнение Нернста после подстановки в него значений R, F и Т приобретает для 250С (298 К) следующий вид: Е = Е0 + где n – число электронов, принимающих участие в процессе; С – концентрация ионов металла в растворе, моль/л. Когда в электродном процессе участвует вода, электродный потенциал зависит от концентрации ионов Н+ (или ОН-), т. е. от рН раствора. Из уравнения Нернста: Е = Е0 + рН = Е = – 0,059 рН. +В нейтральных растворах (рН = 7)Е = -0,059·7≈ -0,41 В. 41. Водородный электрод, стандартные электродные потенциалы. Уравнение Нернста. Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н (двунормальным) раствором H2SO4, в котором активность ионов Н+ равна единице 1 (1 моль/л). В этот раствор погружен электрод из платины, покрытый мелкодисперсной платиновой чернью для увеличения поверхности. При использовании водородного электрода через раствор H2SO4 пропускают химически чистый газообразный водород под давлением 100 кПа при T = 298 K (рисунок 2). Боковая трубка с краном также заполнена раствором серной кислоты и служит для соединения водородного электрода с другим электродом. Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (пластина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль губки, пропитанной атомарным водородом. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в пластине электроны. При этом пластина заряжается отрицательно, а раствор положительно. Возникает скачек потенциала между пластиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на электродном водороде можно представить в виде: Н2 = 2Н+ + 2ē. Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов. 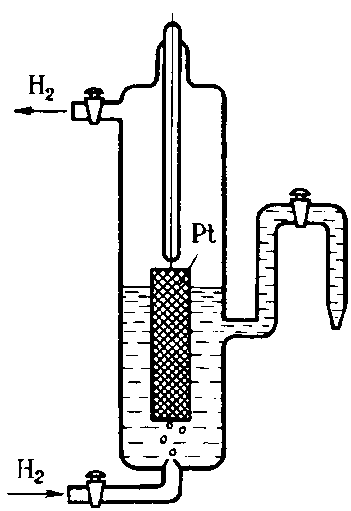 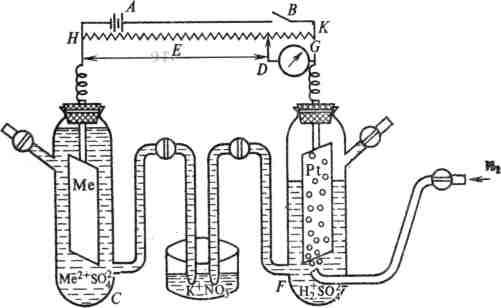 Рисунок 2 – Рисунок 3 – Установка для определения Стандартный водородный электрод электродных потенциалов Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его напряжение (рисунок 3). Поскольку потенциал стандартного водородного электрода равен нулю, то измеренное напряжение будет представлять собою потенциал данного электродного процесса. Таким образом, стандартным электродным потенциалом Е0 металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю. Величина возникающего в результате этого процесса электродного потенциала определяется по уравнению Нернста: 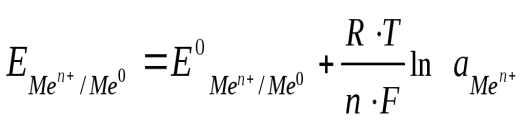 , ,где R – газовая постоянная; Т – температура; F – число Фарадея; n – число электронов, участвующих в электронной реакции; а – активная концентрация ионов металла в растворе. Потенциал электрода, как видно из этого уравнения, зависит от активности (концентрации) ионов металла, которые являются потенциалопределяющими, от природы электролита, от природы электрода, от заряда иона и от температуры. +Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, а так же заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста: 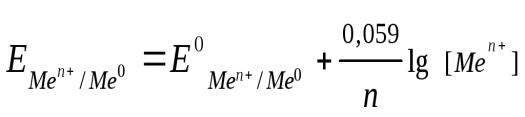 . .42. Окислительно-восстановительные реакции. |
