Вопросы к экзамену по химии Предмет и задачи химии. Химия и окружающая среда. Значение химии для инженеров вашей специальности
 Скачать 2.48 Mb. Скачать 2.48 Mb.
|
|
Методы защиты Электрохимическая защита металлов от коррозии достигается следующими способами: Созданием антикоррозионных сплавов (легированием). Увеличением чистоты индивидуального металла. Нанесением на поверхность различных защитных покрытий. Эти покрытия в свою очередь бывают: Неметаллическими (краски, лаки, смазочные материалы, эмали). Металлическими (анодные и катодные покрытия). Образованными специальной обработкой поверхностей (пассивация железа в концентрированных серной или азотной кислотах; железа, никеля, кобальта, магния в растворах щелочей; образование оксидной пленки, например, на алюминии). 24. Комплексные соединения, их состав, диссоциация в водных растворах. 25. Гидролиз солей, случаи гидролиза, примеры. Степень и константа гидролиза, их взаимосвязь. Гидролиз – это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита. В общем случае обменное взаимодействие растворённого вещества с растворителем носит название – сольволиз. В большинстве случаев гидролиз сопровождается изменением pH раствора. Большая часть реакций гидролиза обратимы Pb(NO3)2 + H2O ↔ Pb(OH)(NO3) + HNO3, Некоторые реакции гидролиза протекают необратимо Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S. Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной оболочки с образованием малодиссоциированных соединений или ионов. Способность солей подвергаться гидролизу зависит от: • свойств ионов, образующих соль; • внешних факторов. Случаи гидролиза 1. Соли, образованные катионом сильного основания и анионом сильной кислоты (например, LiBr,и др), гидролизу неподвергаются, так как ни катион, ни анион соли не могут при взаимодействии с водой образовать молекулы слабых электролитов. (pH = 7). нейтральную реакцию среды Практически не гидролизуются также и труднорастворимые соли (CaCO3) из-за очень низкой концентрации ионов в водных растворах этих солей. 2.Гидролиз по катиону. Соли слабого основания и сильной кислоты гид- ролизуются по катиону NH4Cl + H2O ↔ NH4OH + HCl. В ионно-молекулярной форме NH4+ + H2O ↔ NH4OH + H+. Гидролиз солей, образованных многовалентным катионом, протекает ступенчато, через стадии образования основных солей. Первая ступень: Al(NO3)3 + H2O ↔ Al(OH)(NO3)2 + HNO3, Al 3+ + H2O ↔ [Al(OH)]2+ + H+; вторая ступень: Al(OH)(NO3)2 + H2O ↔ Al(OH)2(NO3) + HNO3, [Al(OH)]2+ + H2O ↔ [Al(OH)2]+ + H+; третья ступень: Al(OH)2(NO3) + H2O ↔ Al(OH)3 + HNO3, [Al(OH)2]+ + H2O ↔ Al(OH)3 + H+. Гидролиз протекает достаточно сильно по первой ступени, При гидролизе по катиону реакция раствора кислая pH < 7. 3. Гидролиз по аниону. Соли, образованные сильным основанием и слабой Кислотой, гидролизуются по аниону CH3COOK + H2O ↔ CH3COOH + KOH. В ионно-молекулярной – CH3COO- + H2O ↔ CH3COOH +OH. Соли многоосновных кислот гидролизуются ступенчато (с образованием кислых солей). Первая ступень: K2CO3 + H2O ↔ KHCO3 + KOH, CO32- + H2O ↔ HCO3 - + OH-; вторая ступень: KHCO3 + H2O ↔ H2CO3+ KOH, HCO3- + H2O ↔ H2CO3 + OH-. Первая ступень гидролиза протекает достаточно сильно, а вторая – слабо, водные растворы таких солей имеют щелочную реакцию (pH > 7). 4.Гидролиз по катиону и аниону. Соли, образованные слабым основани- ем и слабой кислотой, гидролизуются и по катиону и по аниону CH3COONH4 + H2O ↔ CH3COOH + NH4OH или в ионно-молекулярной форме CH3COO- + NH4+ + H2O ↔ CH3COOH + NH4OH. Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота. Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т. е. от их кон- стант диссоциации (Kд). Степень гидролиза (h гидр) – отношение числа гидролизованных моле- кул к общему числу растворённых молекул (выражается в процентах) hгидр = 100 % h= [C]гидр/[C]раст 100 % Степень гидролиза зависит от химической природы образующейся при гидролизе кислоты (основания) и будет тем больше, чем слабее кислота (ос- нование). Константа гидролиза Кh =h2C/1-h или например CH3COONa + H2O ↔ CH3COOH + NaOH К=[CH3COO-] [OH-]/[CH3COOН] Факторы влияющие на степень гидролиза – Добавление одноименных ионов. [H+] подавляет гидролиз по катиону, [OH-] подавляет гидролиз по аниону. – Повышение температуры способствует гидролизу. 26. Осмотический закон Вант-Гоффа. Осмосом называют преимущественно одностороннее проникновение молекул растворителя(диффузию) через полунепроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией. Осмотическим давлением называют величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился. Закон Вант-Гоффа: Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффиценту пропорциональности и абсолютной температуре: π =С(Х)RT, Где π- осмотич давление,кПа; С(Х)- молярная концентрация, моль/л С(Х)= n/V, где n-число молей неэлектролита, V- объём раствора; R- универсальная газовая постоянная,равная 8,31кПа*л/(моль*К); T-абсолютная температура, K. π = n/V * RT или πV= nRT. Чтобы согласовать количественное описание коллигативных свойств электролитов и законы идеальных растворов, Вант-Гофф ввёл поправочный коэффицент i, называемый изотоническим коэффицентом Осмотическое давление зависит от концентрации растворенного вещества и температуры. Так, при увеличении концентрации с сахарозы в воде в два раза осмотическое давление возрастает примерно в два раза, при увеличении концентрации c в три раза осмотическое давление возрастает почти во столько же и т. д. 27. Строение молекулы воды, ее диссоциация, ионное произведение воды, водородный показатель рН. Индикаторы. 28. Принцип Ле Шателье. Влияние температуры, давления, концентрации реагентов на равновесие обратимых реакций. Примеры. Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях Химическое равновесие – состояние системы при котором скорости прямой и обратной реакции равны. Принцип Ле-Шателье-Брауна. Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие сдвигается в направлении, ослабляющем это воздействие. Реакции с участием газообразных веществ. При увеличении давления равновесие смещается в направлении реакции, идущей с уменьшением объема газообразных веществ, при понижении давления в сторону реакции идущей с увеличением объема. При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении в сторону экзотермической. 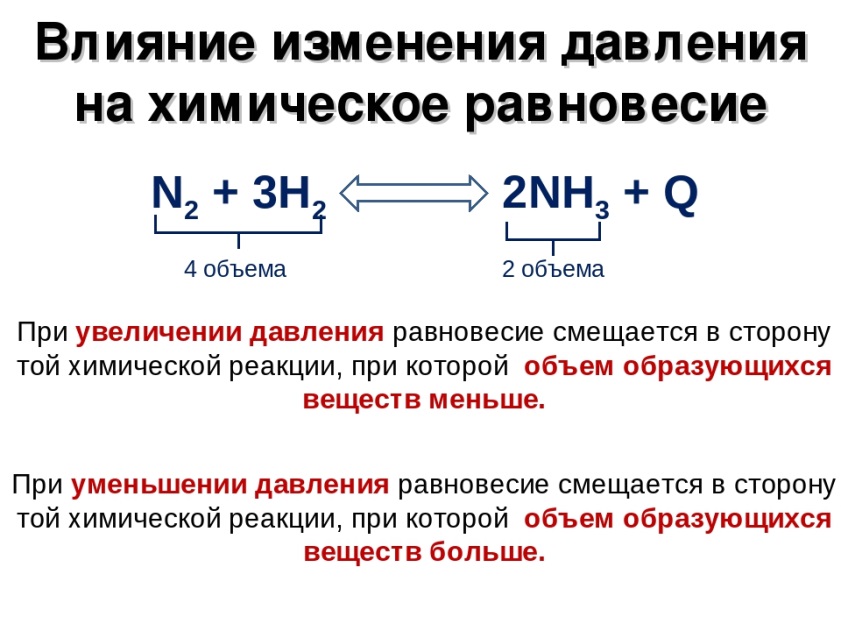 29. Общее представления о растворах. Химическая и физическая теория растворов. Способы выражения концентрации растворов. Раствор - n-компонентная гомогенная система (n³2), состав которой может непрерывно изменяться в некоторых пределах. Растворы могут быть жидкими, твёрдыми, газообразными. Компонент, содержание которого значительно выше содержания остальных компонентов, как правило, называют растворителем. Если одним из компонентов раствора является жидкость, а другие - газы или твёрдые вещества, то растворителем принято считать жидкость. Мы будем говорить о жидких растворах. Поэтому вспомним самые общие сведения о жидком состоянии: В жидкости молекулы ориентированы друг относительно друга благодаря силам Ван-дер-Ваальса, а так же водородной связи. Молекулы не “втягиваются друг в друга” из-за отталкивания электронных оболочек (принцип Паули и принцип неопределённости) и теплового движения молекул. Благодаря указанной ориентации молекулы жидкости напоминают кристаллическое вещество - каждая её молекула окружена примерно одинаковым числом соседей (ближний порядок). Ближний порядок не означает отсутствие движения. В отличие от кристаллического вещества в жидкости отсутствует дальний порядок. При образовании раствора происходитсольватация(от лат. solvere - растворять) частиц растворённого вещества молекулами растворителя. Если растворитель - вода, то говорят о гидратации. При этом за счёт химических связей между разнородными молекулами образуются аквокомплексы (водные растворы) или сольватокомплексы (неводные растворы). На образование химических связей между компонентами указывают явления, наблюдающиеся при растворении: а) значительные тепловые эффекты (вспомните работы по термохимии); б) изменение окраски при образовании растворов; в) нарушение аддитивности объёмов при смешении жидкостей. Особенно это характерно для жидкостей, между компонентами которых образуются водородные связи. Так, при смешении 1 л C2H5OH и 1 л H2O объём раствора равен 1.93 л. Таким образом, растворение– это сложный физико-химический процесс, включающий как химические процессы (гидратная теория растворов Д.И. Менделеева), так и комплекс физических взаимодействий (физическая теория растворов - В.Ф. Алексеев, Вант-Гофф, Аррениус, Оствальд).  Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы веществ. При растворении в воде, например, гидрата окиси натрия, серной кислоты наблюдается сильное разогревание раствора, а при растворении нитрата аммония- сильное охлаждение раствора. В первом случае осуществляется экзотермический процесс, во втором – эндотермический. В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называются сольватными или гидратными, если растворителем является вода. Сольваты (гидраты) образуются за счет донорно-акцепторного, диполь-дипольного взаимодействий, за счет водородных связей, а также дисперсного взаимодействия (в случае растворов родственных веществ, например, бензола и толуола). Особенно склонны к гидратации ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы. Во многих случаях такие соединения непрочны и легко разлагаются при выделении их в свободном виде. Однако, в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора путем кристаллизации. Из раствора выпадают кристаллы, содержащие молекулы воды. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Таким образом, растворение не только физический, но и химический процесс. Растворы образуются за счет взаимодействия растворенного вещества с частицами растворителя и являются физико-химической системами. 30. Металлы. Общие физические и химические свойства. Методы извлечения металлов из руд. Способы получения высокочистых металлов. Занимая в таблице Менделеева I-II группы, а также побочные подгруппы III-VIII групп, атомы металлов способны отдавать валентные электроны, тем самым окисляться. По группе сверху вниз число электронных слоев увеличивается, радиус атомов растет, как и способность отдавать электроны (металлические свойства атомов). В периодах слева направо радиус атомов уменьшается, металлические свойства снижаются. Поэтому самыми активными металлами в периодах являются металлы I-II групп. Общие физические свойства Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа"). 1)Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду ––Au,Ag,Cu,Sn,Pb,Zn,Fe→ уменьшается. 2)Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света. 3)Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду ––Ag,Cu,Al,Fe→ уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа". 4)Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути. 5)Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом. 6)Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие ρ < 5 г/см3 считаются "легкими металлами". 7)Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими. Общие химические свойства металлов Сильные восстановители: Me0 – nē → Men+ I. Реакции с неметаллами 1) С кислородом: 2Mg0 + O2 → 2Mg+2 O 2) С серой: Hg0 + S → Hg+2 S 3) С галогенами: Ni + Cl2 –t°→ Ni+2Cl2 4) С азотом: 3Ca0 + N2 –t°→ Ca3+2N2 5) С фосфором: 3Ca0 + 2P –t°→ Ca3P2 6) С водородом (реагируют только щелочные и щелочноземельные металлы): 2Li0 + H2 → 2Li+1H Ca0 + H2 → Ca+2H2 31. Легкие конструкционные металлы: магний, алюминий, бериллий. Распространенность, строение химические свойства, применение. атома, 32. Коррозия металлов. Типы коррозии. Химическая и электрохимическая коррозия. Металлы и их сплавы - приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушения так как металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются. Самопроизвольное разрушение металлов(Δφ<0), происходящее под химическим воздействием окружающей среды, называется коррозией.  33. Основные классы неорганических соединений: оксиды, гидроксиды, соли. Примеры веществ. 34. Тепловой эффект химической реакции. Внутренняя энергия и энтальпия. Химическая реакция – это процесс, при котором одни соединения разлагаются, другие образуются, в результате одни химические связи заменяются другими. Как следствие химические реакции сопровождаются выделением или поглощением теплоты. Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектомреакции. Тепловой эффект реакции, протекающей в условиях р=const, T=const, равен изменению энтальпии системы ∆Н и измеряется в кДж. При экзотермической реакции энтальпия системы уменьшается и ∆Н < 0, а при эндотермической – энтальпия системы увеличивается и ∆Н > 0. 35. Энтальпия экзо- и эндотермических Энтальпия образования реакций. химических соединений. 36. Стандартная теплота образования химических соединений. Закон Гесса и следствия из него. 37. Гомогенные и гетерогенные системы, примеры. Скорость гомогенных реакций. Закон действующих масс. Константа скорости реакции, физический смысл. Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. Сложная химическая реакция, в которой одни стадии являются гомогенными, а другие гетерогенными, называется гомогенно-гетерогенными. Примером гомогенных реакций может служить любая реакция в растворе, примером гетерогенной реакции - любая реакции, идущая на поверхности твердою катализатора (гетерогенная каталитическая реакция), примерами гомогенно-гетерогенных реакций - некоторые реакции между газами, отдельные стадии которых протекают на стенках реакционного сосуда. Понятия «гомогенный» и «гетерогенный» применимы как к реакции а целом, так и к любой ее отдельной стадии. Гомогенно-гетерогенным может быть только сложный процесс, включающий несколько стадий. Следует отметить, что в гетерогенном процессе исходные вещества и продукты реакции могут находиться в одной фазе. Так, гидрирование этилена в присутствии металлического никеля С2Н4 + 4Н2 > С2Н6 идет на поверхности металла, но оба исходных вещества - этилен и молекулярный водород - к продукт реакции этан образуют одну фазу. Возможны и такие случаи, когда реагирующие вещества находятся в разных фазах, но реакция между ними является гомогенной. В качестве примера можно привести окисление углеводорода в жидкой фазе молекулярным кислородом. Исходные вещества - кислород и углеводород - находятся в разных фазах, но реакция между ними является гомогенной, так как в химическую реакцию вступает растворенный в углеводороде кислород. Гетерогенной в рассматриваемом случае является не химическая реакция, а предшествующая ей нехимическая стадия растворения кислорода. В зависимости от того, одну или несколько фаз образуют исходные вещества и продукты реакции, химические процессы могут быть гомофазными и гегерофазными. Гомофазным называется процесс, в котором исходные вещества, стабильные стабильные промежуточные вещества и продукты реакции находятся в пределах одной фазы. Гетерофазным называться процесс, в котором входные вещества, стабильные промежуточные вещества и продукты реакции образуют более чем одну фазу. Понятия гомо- и гетерофазности совершенно независимы от понятия гомо- и гетерогенности. Так, нейтрализация кислоты щелочью валяется гомогенным гомофазным процессом, рассмотренное выше гидрирование этилена - гомофазным гетерогенным процессом. Окисление углеводорода в жидкой фазе газообразным кислородом представляет собой гомогенный гетерофазный процесс. Наконец, гашение извести СаО + Н2О>Са(ОН)2 когда все три компонента образуют отдельные фазы и процесс идет на границе раздела воды и СаО, является гетерогенным процессом. Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции: закон действующих масс может быть записан в виде кинетического уравнения вида: +где V — скорость химической реакции, k — константа скорости реакции. Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. +Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. 38. Жесткость воды. Виды жесткости: общая, постоянная, карбонатная, некарбонатная. Методы устранения жесткости. Жесткость воды – один из технологических показателей, принятых для характеристики состава и качества природных вод, который характеризуется содержанием числа миллимолей эквивалентов ионов Са2+ и Мg2+ в 1 л воды. Один миллиэквивалент жесткости отвечает содержанию в воде 20,04 мг/л Са2+ или 12,16мг/л Mg2+, что соответствует значению эквивалентной массы этих ионов. Эти ионы появляются в природных водах в результате взаимодействия с известняками или в результате растворения гипса. CaCO3 + H2O + CO2 = Ca2+ + 2HCO3- Жёсткость природных вод колеблется в широких пределах. Вода, жёсткость которой менее 4 мэкв/л ионов Са2+ и Мg2+, характеризуется как мягкая, от 4 до 8 – умеренно жёсткая, от 8 до 12 – жёсткая и более 12 мэкв/л – очень жёсткая. Например, наиболее мягкой является вода атмосферных осадков (0,07-0,1мэкв/л), а жесткость океанской воды составляет 130 мэкв/л. Различают несколько видов жёсткости: общую, временную, постоянную, карбонатную и некарбонатную. Общей жёсткостью называется суммарная концентрация ионов Ca2+, Mg2+ в воде, выраженная в мэкв/л. Постоянная жёсткость - часть общей жёсткости, остающаяся после кипячения воды при атмосферном давлении в течение определённого времени. Временная жёсткость – часть общей жёсткости, удаляющаяся кипячением воды при атмосферном давлении в течение определённого времени. Она равна разности между общей и постоянной жёсткостью. Карбонатная жёсткость – часть общей жёсткости, эквивалентная концентрации гидрокарбонатов кальция и магния. Некарбонатная жёсткость - часть общей жёсткости, равная разности между общей и карбонатной жёсткостью. Использование природной воды в технике требует ее предварительной очистки. Процесс, приводящий к снижению жёсткости воды, называется умягчением воды. Способы умягчения воды можно разделить на три основные группы: 1) термическое умягчение воды; 2) реагентные методы умягчения; 3) умягчение воды методом ионного обмена. 1. Термический. Используется только для устранения карбонатной (временной) жесткости. Метод основан на реакции разложения гидрокарбонатов при нагревании с образованием осадков карбонатов кальция и магния. t0 Са(НСО3)2 = СаСО3↓ + СО2↑ + Н2О t0 Mg (НСО3)2 = MgСО3↓ + СО2↑ + Н2О 2. Химический или реагентный. В этом случае к воде известной жесткости добавляют рассчитанное количество реагента, переводящего ионы Са2+, Mg2+ в связанное состояние. Большое распространение получил известково-содовый метод. Воду обрабатывают растворами гашеной извести Са(ОН)2 и кальцинированной соды Na2CО3. При этом временная жесткость воды устраняется гашеной известью: Са (НСО3)2 + Са (ОН)2 = 2СаСО3↓ + 2Н2О Mg (HCO3)2 + 2Ca (OH)2 = Mg(OH)2↓ + 2CaCO3↓ + 2H2O а постоянная – содой: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4 Среди других реагентов отметим ортофосфат натрия Na3PO4, также часто используемый для умягчения воды: 3Са(НСО3)2 + 2Na3PO4 = Са3(РО4)2↓ + 6NaHCO3 3MgСl2 + 2Na3PO4 = Mg3(РО4)2↓ + 6NaCl Некоторые фосфаты, такие как гексаметафосфат натрия (NаРО3)6 не только служат для устранения жесткости воды, но и позволяют удалять образовавшиеся отложения (накипь). Подобные вещества называются антинакипинами. Антинакипины являются обязательной составной частью присадок к различным техническим жидкостям. Они переводят соли кальция и магния в рыхлые осадки, циркулирующие в системе охлаждения и легко удаляемые вместе с жидкостью при ее замене. Для расчета массы умягчителя, необходимого для снижения жесткости воды в каждом конкретном случае, воспользуемся законом эквивалентов: где m1 и m2 – массы реагирующих веществ; МЭ(1) и МЭ(2) – молярные массы эквивалентов этих веществ. Обозначим m1 – масса реагента (мг), m2 – масса соли кальция или магния (мг) МЭ(1) – молярная масса миллиэквивалента реагента, МЭ(2) – молярная масса миллиэквивалента соли кальция или магния (мг/ммоль). т.к. где то В зависимости от типа используемого реагента жесткость воды удается снизить до 0,3 ммоль/л при использовании известково-содовой смеси и до 0,04-0,02 ммоль/л при действии фосфатами. Однако, все разновидности реагентного способа умягчения требуют значительных затрат времени на образование осадков и их фильтрование. 3. Метод ионного обмена. Широкое применение в практике умягчения или полного обессоливания воды получили иониты. Это природные или синтетические вещества, способные к обмену катионов (катиониты) или анионов (аниониты). Катиониты бывают органические и неорганические. Органические имеют в своем составе группы (–СООН, –SO3H), содержащие катион водорода Н+, способный замещаться на катионы кальция Са2+ и Mg2+ по схеме: RH2 + Са2+ → RCa + 2Н+ RH2 + Mg2+ → RMg + 2H+ Неорганические катиониты – алюмосиликаты Na2[Al2Si2O8∙nH2O]. Эти соединения можно условно выразить формулой Na2R, где R – анион. В данном случае обмениваться с катионами Са2+, Мg2+ будет обмениваться Nа+ по схеме: Na2R + Са2+ → CaR + 2Na+ Na2R + Mg2+ → MgR + 2Na+ При натрий-катионировании жесткость воды может быть снижена до 0,03–0,05 ммоль/л, при повторном – до 0,01 ммоль/л. После прохождения воды через катионит ионы кальция и магния оказываются связанными (адсорбированными) его поверхностью, а ионы натрия (или водорода) переходят в воду. Катионит при этом теряет постепенно свою работоспособность. Для регенерации через отработанные катиониты пропускают концентрированные растворы НС1 или NaCl в зависимости от типа катионита. Аниониты имеют основный характер. Гидроксид-ион ОН-, входящий в его состав, способен обмениваться на анионы солей, содержащихся в воде, например: 2ROH + SO42- → R2SO4 + 2OH- +Полного обессоливания воды можно добиться, пропуская воду последовательно через катионит, а затем через анионит. 39.Произведение растворимости труднорастворимого сильного электролита. Условия выпадения и растворения осадка, примеры. Закон действия масс применим к гетерогенной равновесной системе, состоящей из кристаллов малорастворимого электролита (соли, основания, кислоты) и его ионов в насыщенном растворе. Рассмотрим равновесия, наблюдаемые в насыщенном растворе какого-нибудь труднорастворимого вещества, например, CaSO4. В этой системе осадок находится в равновесии с насыщенным раствором этого вещества: СaSO4 осадок раствор При установившемся гетерогенном ионном равновесии в раствор переходит в единицу времени столько ионов, сколько их снова возвращается в осадок (вследствие ничтожно малой растворимости считаем, что степень ионизации электролита в растворе равна 1). Константа равновесия для процесса растворения осадка имеет следующий вид: 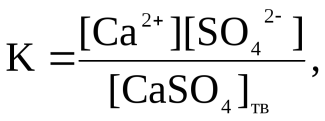 откуда, K∙[CaSO4]тв = [Ca2+]∙[SO42-] Концентрация твердого вещества есть величина постоянная: [CaSO4]тв = const. Учитывая это, K∙[CaSO4]тв как произведение двух постоянных величин также можно считать величиной постоянной, некоторой константой, характерной для данного вещества. Эту константу называют произведением растворимости. Её обозначают через ПР: Для насыщенного раствора сульфата кальция произведение растворимости при 25оС найдено равным 3,72∙10-5 г-ион2/л2. Произведение растворимости характеризует растворимость электролитов. Для бинарных электролитов растворимость численно равна s В общем случае, если малорастворимый электролит имеет сложный состав AnBm и при его диссоциации образуется более двух ионов: AnBm ↔ nAa+ + mBb–, то в выражении константы равновесия записывают концентрации ионов в степенях, равных стехиометрическим коэффициентам n и m. Тогда ПР = [Aa+]n [Вb–]m Следовательно, для насыщенного водного раствора малорастворимого электролита произведение равновесных молярных концентраций его ионов в степенях, равных стехиометрическим коэффициентам, при данной температуре есть величина постоянная, называемая произведением растворимости. Сравнивая значения произведений растворимости труднорастворимых солей, можно видеть, какая из них растворяется лучше (табл. 15). Значения ПР используются в общей химии, аналитической химии, гидрохимии, химии океана, экологии и др., т. к. позволяют количественно оценить: условия образования и растворения осадков; рассчитать растворимость труднорастворимого электролита; рассчитать молярную концентрацию ионов электролита в насыщенном растворе. Из величины ПР вытекает условие образования и растворения осадка: Если [Aa+]n [Вb–]m = ПР, то осадок находится в равновесии с раствором (насыщенный раствор); Если [Aa+]n [Вb–]m > ПР, то осадок выпадает (перенасыщенный раствор); Если [Aa+]n [Вb–]m < ПР, то осадок растворяется (ненасыщенный раствор). Таблица 15. Произведение растворимости некоторых малорастворимых электролитов при 25 оС
Таким образом, если при той или иной химической реакции, произведение концентраций участвующих в ней ионов станет больше произведения растворимости, то выпадает осадок труднорастворимого вещества. И обратно, если произведение концентраций ионов данного электролита в насыщенном его растворе в результате той или иной реакции становится меньше произведения растворимости для ионов этого электролита, то осадок переходит в раствор. Из всего сказанного выше можно сделать вывод о влиянии различных факторов на образование осадков. |
